枸杞多糖减轻雷公藤多苷致卵巢颗粒细胞损伤的研究
楚玉凤,王 静,王 彤,崔瑞琴
(宁夏医科大学,银川 750004)
雷公藤为传统中草药中的常用药,性寒,味苦、辛,有大毒,具有通络除痹、祛风活血、除湿止痛等功效。雷公藤多苷(tripterygium wilfordii glycosides,GTW)是最常用的雷公藤制剂之一,是从雷公藤根部提取精制而成的脂溶性混合物,由我国自主研发的免疫抑制药,被誉为“中草药激素”,对自身免疫性疾病、肾系病症、癌症、皮肤病、移植后抗排异等有确切疗效[1]。GTW是一种疗效与毒性并存的药物,即其有效成分和毒性成分为相同物质,临床用药时无法精准区分GTW的治疗与中毒剂量,故GTW在临床应用期间,其毒副作用及不良反应被大量报道,尤其是生殖毒性,严重限制该药的临床使用范围[2]。枸杞多糖(lycium barbarum polysaccharide,LBP)是从枸杞子中提取的水溶性多糖物质,是枸杞生物活性的重要组成成分。LBP有抗衰老、抗氧化作用,可保护心脏、肝脏、神经及生殖系统,还有抗癌、免疫调节作用,对现代医学中辐射或化疗所致的器官毒性也有保护作用[3]。LBP对生殖系统的保护作用主要体现在抑制细胞凋亡、降低氧化损伤及调节人体激素分泌等多个方面[3-4]。本实验通过研究GTW及LBP对人卵巢颗粒(SVOG)细胞增殖与凋亡的影响,探讨GTW对SVOG的毒性作用,以及LBP对该毒性损伤的减毒作用,以期为雷公藤多苷在临床用药的安全性提供重要实验依据。
1 材料与方法
1.1 材料
1.1.1 细胞来源 SVOG细胞来自宁夏医科大学生育力保持重点实验室。
1.1.2 药物与相关试剂 得恩德雷公藤多苷片(浙江得恩德制药有限公司),95%浓度LBP(宁夏宏德公司),胎牛血清、1640培养液(Gibco公司),胰蛋白酶消化液(0.25%不含EDTA和酚红)(Solarbio公司),PBS(HyClone公司),CCK8检测试剂盒(苏州优逸兰迪公司),ELISA试剂盒(武汉伊莱瑞特公司),全蛋白提取试剂盒、BCA蛋白定量试剂盒、Annexin-V-FITC/PI流式检测试剂盒(江苏凯基公司),Caspase3、Bax(Abmart公司),Bcl-2(Proteintech公司),β-actin(BIOSS公司),羊抗兔、羊抗鼠二抗(Abbkine公司),ECL显色剂(兰博利德公司)。
1.1.3 实验仪器 电子天平(先行者,OHAUS公司),WH-861台式震荡器(华利达实验设备公司),离心机(SC-05,中科中佳公司),流式细胞仪(Accuri C6,美国BD公司),全波长酶标仪(Multiskan GO,美国Thermo公司),ICO150细胞培养箱(德国MEMMERT公司),ChemiDoc XRS+凝胶成像仪(美国BioRad公司)。
1.2 方法
1.2.1 细胞培养 将SVOG细胞复苏后接种于10 cm培养皿中,加入8 mL完全培养基(10%FBS+青、链霉素各100μg·mL-1+1640培养液)后放入细胞培养箱中常规培养(培养条件:37℃、5%CO2)。在显微镜下观察细胞,密度在80%~90%时进行细胞传代、冻存。取2代以后对数期稳定状态的细胞进行后续实验。
1.2.2 制备不同安全浓度的GTW与LBP溶液 精准称取12.8 mg GTW粉末加入100μL DMSO中,涡旋至完全溶解,并用新配完全培养基将其浓度稀释到0.1%以下,定容至4 mL[5];称取2 mg LBP粉末加入2 mL完全培养基中,涡旋溶解。将以上2种母液均经0.22μm滤膜过滤除菌,包上锡纸,GTW母液避光保存于-20°C备用,LBP母液现配现用,实验时按浓度需要进行配比。
1.3 指标检测
1.3.1 细胞增殖抑制实验
1.3.1.1 GTW对SVOG细胞存活率的影响 用胰酶消化颗粒细胞后,以2×104/mL的细胞浓度接种于96孔板中,100μL/孔,细胞完全贴壁后用不同浓度的GTW(0、20、40、60、80μg·mL-1)干预24 h。0μg·mL-1即对照组,加入等体积的培养基。24 h后弃去所有组的旧培养基,避光条件下每孔加入含有90μL培养基和10μL CCK8溶液的新鲜培养基,孵育1.5 h后于450 nm处测定OD值。细胞存活率(%)=(OD给药组-OD空白孔)/(OD对照组-OD空白孔)×100%。每组5个平行复孔,每组复做3次。
1.3.1.2 LBP对SVOG细胞因GTW所致损伤的影响 将传代后细胞分为3组:对照组(等体积无药物的培养基)、损伤组(60μg·mL-1GTW)、干预组(在加入60μg·mL-1GTW前24 h加入LBP 200μg·mL-1),加药后继续培养24 h后,用CCK8法测定各组OD值。
1.3.1.3 细胞形态学观察各组细胞变化 传代后将细胞分为3组:对照组(等体积无药物的培养基)、损伤组(60μg·mL-1GTW)、干预组(在加入60μg·mL-1GTW前24 h加入LBP 200μg·mL-1)种于6孔板,加入对应药物处理细胞,24 h后拍照记录。
1.3.2 ELISA法检测抗苗勒氏管激素(AMH)浓度 细胞分组、药物干预同步骤1.3.1.3,24 h后3 000 r·min-1、4℃离心20 min。各组培养基按说明书操作,检测OD值,在Origin 2019软件中制作标准化曲线,并计算AMH浓度。
1.3.3 流式细胞术检测颗粒细胞凋亡率 细胞分组及药物处理同步骤1.3.2。收集3组细胞培养液以终止无EDTA胰酶对细胞的消化,1 500 r·min-1离心5 min,用2 mL PBS重悬细胞,此步骤重复2次。加入Binding-Buffer 500μL,吹打与细胞充分混匀,避光加入5μL Annexin-V-FITC及5μL PI,混匀避光静置15 min。立即上机检测各组细胞凋亡情况。
1.3.4 Western blot检测 细胞分组、处理同1.3.3步骤。加入200μL裂解液后冰上静置30 min裂解细胞,提取总蛋白并测定蛋白浓度。40μg/孔加样,进行电泳分离(80~120 V),转膜1 h(200 mA),室温5%脱脂奶粉慢摇封闭1 h。加入一抗Caspzase3(1∶1 000)、Bax(1∶1 000)、鼠抗Bcl-2(1∶3 000)、β-actin(1∶1 000)摇床孵育,4℃过夜。洗膜3次(TBST),10 min/次,分别加入羊抗兔(1∶20 000)、羊抗鼠(1∶10 000)室温慢摇1 h,洗膜同前,显色曝光。Image J软件分析蛋白表达量。
1.4 统计学方法
数据应用GraphPad 7.0软件进行分析。计量资料以均数±标准差(±s)表示,多组间比较采用单因素方差分析(ANOVA)。P≤0.05为差异有统计学意义。
2 结果
2.1 GTW对SVOG细胞存活率的影响
与对照组比较,0、20、40、60、80μg·mL-1GTW作用于细胞24 h后细胞存活率均降低(P均<0.05),且细胞存活率随着GTW浓度的增高而降低,见图1。
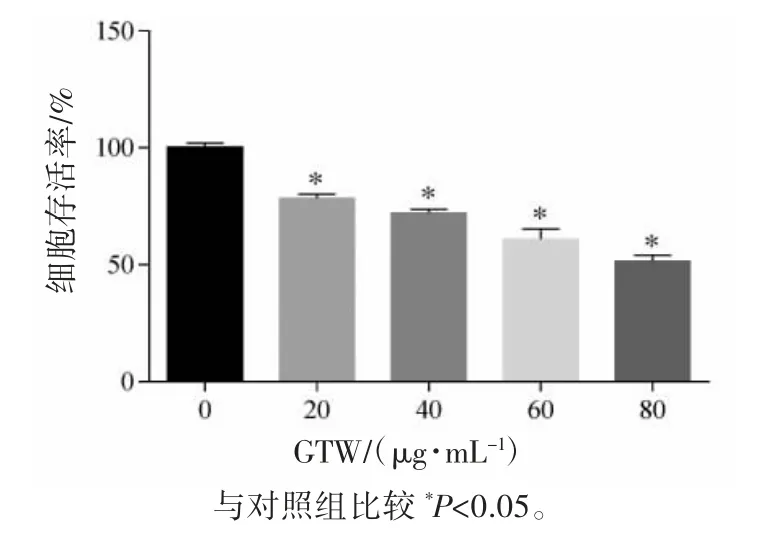
图1 GTW对SVOG细胞存活率的影响
2.2 细胞形态学变化
显微镜下可见,药物作用24 h后,正常SVOG生长状态良好,细胞间紧密连接,大小均一、数量较多,边界清楚,透光性良好;损伤组逐渐出现形态固缩、变圆,细胞间隙增大,存活细胞较正常组明显减少,可见坏死细胞及凋亡细胞脱落漂浮于培养基上;与损伤组比较,干预组存活细胞数量较多,损伤程度较轻,见图2。

图2 不同药物组干预24 h后细胞形态学变化(×200)
2.3 对细胞活力的影响
损伤组细胞活力低于对照组,干预组细胞活力高于损伤组(P均<0.05),见图3。
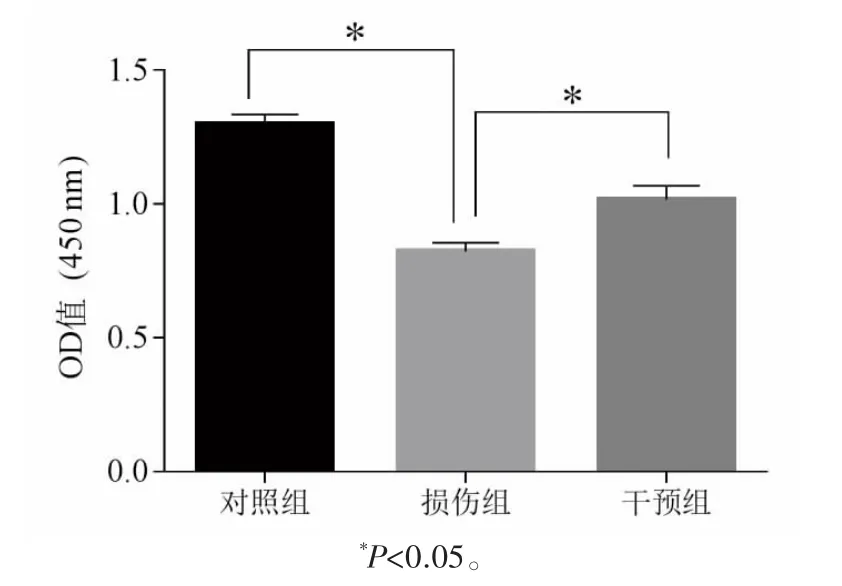
图3 不同药物干预后对SVOG细胞活力的影响
2.4 细胞培养基上清液中AMH水平变化
损伤组细胞培养基上清中AMH水平低于对照组,干预组的细胞培养基上清中AMH水平高于损伤组(P均<0.05),见图4。
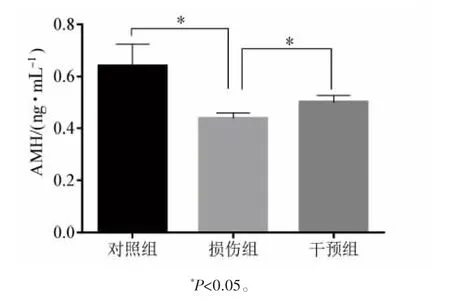
图4 不同药物干预后对细胞AMH分泌水平的影响
2.5 对细胞凋亡的影响
与对照组比较,经GTW处理后的细胞凋亡率增高(P<0.05);与损伤组比较,干预细胞凋亡率降低(P<0.05),见表1、图5。
表1 各组细胞凋亡情况(±s)

表1 各组细胞凋亡情况(±s)
与对照组比较*P<0.05;与损伤组比较#P<0.05。
分组对照组损伤组干预组n 3 3 3细胞凋亡率/%4.333±0.59 20.90±0.81*15.23±0.23#
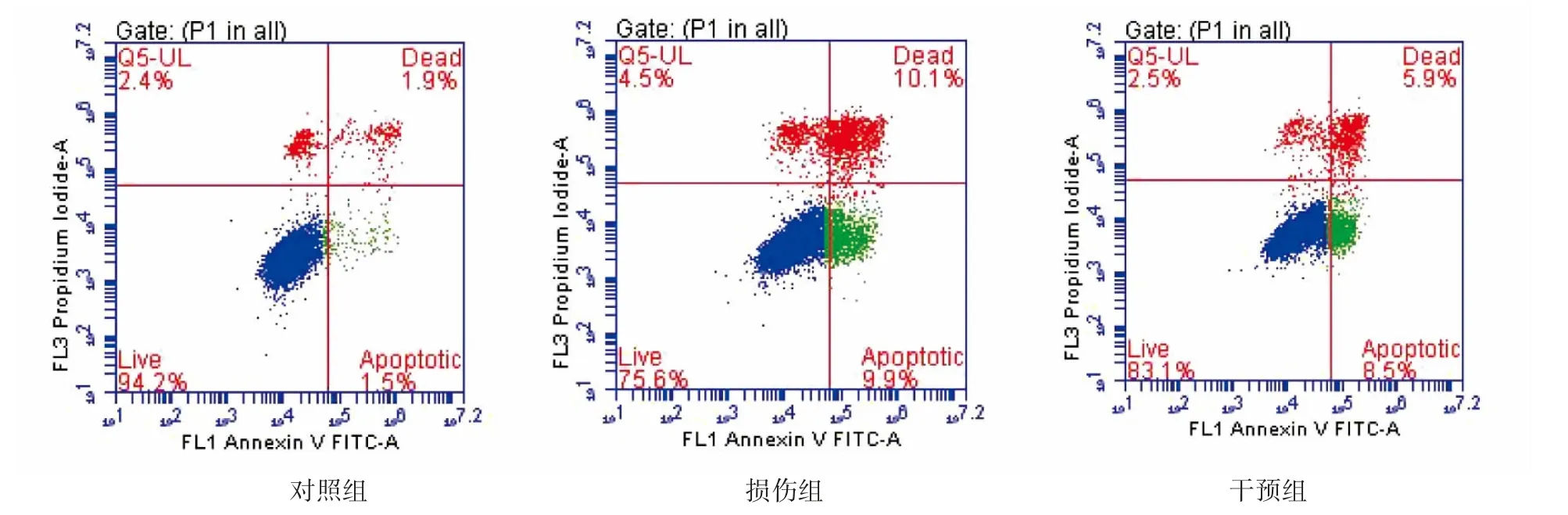
图5 不同药物干预后对各组细胞凋亡的影响
2.6 Western blot法检测Caspase3、Bax、Bcl-2蛋白表达
与对照组比较,损伤组细胞Bax、Caspase3蛋白表达量上调,Bcl-2蛋白表达量下调(P均<0.05);与损伤组相比,干预组细胞Bax、Caspase3蛋白表达量下调,Bcl-2蛋白表达量上调(P均<0.05),见图6。

图6 各组不同药物干预后对细胞凋亡相关蛋白表达量的影响
3 讨论
卵巢颗粒细胞(granulosa cells,GCs)是卵巢的体细胞,参与卵泡的生长、发育、成熟及激素生成。GCs与卵母细胞构成了卵泡,GCs提供相应的营养物质促进卵母细胞的生长成熟,卵母细胞指导支持GCs的增殖分化,二者互给互存,共同促进了卵泡的成熟。当GCs出现10%以上凋亡时,会引起卵泡闭锁增加,阻碍卵泡发育[6-7]。GCs过度凋亡会加速卵泡闭锁,引起性激素分泌紊乱,诱导卵母细胞在数量和(或)质量下降,使卵巢储备功能减退[8]。在女性生殖系统中,卵巢储备功能是女性生育能力的体现,故GCs的功能状态影响了女性的生育能力。同时GCs的细胞毒性程度是评价药物对卵巢的毒性大小的重要的体外指标,因此,GCs常被视作研究雌性生殖及内分泌功能的最佳靶细胞。
AMH为卵巢储备情况的敏感指标,主要由窦前卵泡和小腔GCs分泌并持续表达,在始基卵泡及闭锁卵泡中不表达。AMH能调节卵泡的生长发育,可判断生长卵泡池的大小,能够准确地预测卵巢储备能力及生殖潜能。AMH不受月经周期及性激素变化的影响,且灵敏度优于FSH、E2、AFC等指标,能更早反映出卵巢储备功能的变化趋势。卵巢功能的减退或衰竭直接反应在颗粒细胞数量的减少及功能的下降,造成AMH分泌的减少[9-11]。这是本研究选择颗粒细胞的凋亡率和AMH作为评价指标的依据。
GTW可损伤女性生殖功能,造成卵巢储备功能减退或卵巢早衰。临床上可见月经周期紊乱、月经量减少,随着病情的加重逐渐发展成闭经、不孕等[1]。孙凤等[12]通过Meta分析评价GTW在临床应用中生殖毒性的发生率,发现GTW组造成生殖毒性的风险是对照组的5.1倍,出现月经不调的风险随用药时间和剂量的累积而升高。卵巢储备功能对女性生育力的保持具有重要作用,育龄期女性长期服用雷公藤制剂可促进生殖细胞凋亡,加速卵巢功能的衰退。研究[13]发现,用GTW给小鼠灌胃后可出现小鼠的动情周期紊乱、AMH、E2值及体质量均降低,卵巢组织萎缩并呈纤维结缔样或脂肪样改变,子宫内膜较正常组变薄,闭锁卵泡增多,颗粒细胞层明显减少。停药后小鼠体质量虽恢复,但对小鼠生殖功能的损伤任然存在。Ai等[14]发现GTW诱导内源性miR-15α表达,抑制Hippo-YAP通路,从而影响了GCs的正常生理生化,诱导产生细胞毒性,促进GCs衰老。本研究重复验证了GTW可损伤GCs功能这一结果。
GTW为脂溶性制剂,不溶于水。本研究选择DMSO做溶剂,通过查阅文献确认DMSO浓度在0.1%~0.25%,对细胞生长趋势的影响同空白对照组相似,因此可忽略其对研究结果可能造成的偏倚[15-16]。本研究发现,用GTW作用细胞24 h时后,细胞的存活率随GTW浓度的增加而降低,提示GTW对GCs增殖有抑制,用LBP干预后可提高细胞存活率,说明LBP能够减轻GTW对颗粒细胞增殖抑制的作用强度;同时,GTW作用后的颗粒细胞形态出现典型的凋亡样改变(呈固缩、变圆状),细胞间隙增大,可见大量坏死及凋亡细胞,AMH浓度也随颗粒细胞的减少而降低;用LBP干预后细胞的形态、培养基中坏死及凋亡细胞明显减少,AMH浓度增高,提示LBP可减轻GTW对GCs的损伤强度。
细胞凋亡贯穿了细胞生长、发育、衰老的过程,是维持生物体内环境稳态,体内细胞的自我更新、调控的重要机制[2]。细胞凋亡主要包括内源性途径和外源性途径。Bcl-2、Bax是内源性途径即线粒体凋亡途径中的关键蛋白,二者互为拮抗但同源的两个亚群,均属于Bcl家族。Bcl-2具有抗凋亡特性,可直接阻断Caspase级联反应,保持线粒体膜电位稳定。在GCs中,且Bcl-2可促进GCs的分裂,降低卵泡闭锁率;Bax是促凋亡的主要执行因子,通过降解细胞底物降低线粒体的活性,触发线粒体膜电位的变化,增加细胞色素c的释放加速Caspase3及其下游促凋亡过程[17-18]。Caspase级联反应是内、外源凋亡途径下游的共同途径,Caspase3是该途径的关键因子及标志因子。Bcl-2/Bax的比值反映细胞的凋亡与否。当细胞受到损伤时,Bax表达上调,此时Bcl-2<Bax,线粒体膜电位降低,加速细胞凋亡。反之,细胞存活率增加[19]。本研究结果显示,GTW诱导的细胞损伤与促凋亡蛋白Bax水平升高和抗凋亡蛋白Bcl-2降低有关。GTW损伤组Caspase3、Bax蛋白相对表达量增多,Bcl-2蛋白相对表达量降低,提示GTW可诱发GCs的凋亡,推测其作用机制是上调相关促凋亡蛋白Caspase3、Bax的表达,加速了细胞的凋亡进程,引发生殖损伤;而LBP可有效减轻GTW的生殖损伤强度。本研究结果可证实LBP对GCs凋亡的抑制作用,尚不能确定是否可完全消除GTW对卵巢颗粒细胞的毒性作用。
综上所述,GTW可造成GCs的功能损伤,表现为细胞存活率的下降和AMH分泌量的降低,推测其作用是增加了颗粒细胞的凋亡率和凋亡分子的表达量,促进了细胞凋亡;LBP通过拮抗GTW的部分毒性损伤来完成减毒作用。

