呼吸机相关性肺炎对急性呼吸窘迫综合征患者预后的影响
何广宾,左海涛,陈永青
(三河燕郊福合第一医院内科,河北 三河 065201)
急性呼吸窘迫综合征(acute respiratory distress syndrome,ARDS)是常见的呼吸科危重症,主要表现为进行性呼吸困难及顽固性低氧血症,临床死亡率较高[1]。由于ARDS 病情危重,治疗时给予气管插管和机械通气等侵入性操作,患者易并发呼吸机相关性肺炎(ventilator-associated pneumonia,VAP)。ICU是医院机械通气患者集中的科室,ICU 中VAP 的发生率为15%~60%,病死率高达49%~70%[2]。由于VAP 临床风险较高,可能与ARDS 的多器官功能衰竭和死亡风险增加有关。因此,准确评估VAP 的相关危险因素,有针对性给予预防措施可以减少并发症及改善预后。本研究旨在明确VAP 对ICU 行肺保护性机械通气治疗ARDS 患者预后的影响,分析引起VAP 的危险因素,为临床提供治疗策略。
1 资料与方法
1.1 一般资料 2015 年6 月-2019 年6 月在三河燕郊福合第一医院ICU 接受机械通气治疗的ARDS 患者195 例。ARDS 诊断符合中华医学会重症医学分会制定的急性呼吸窘迫综合征诊断和治疗指南[3],VAP 诊断参照中国成人医院获得性肺炎与呼吸机相关性肺炎诊断和治疗指南(2018 年版)制定[4]。纳入标准:①年龄>18 岁;②急性起病;③确诊ARDS后行机械通气时间在48 h 以上。排除标准:①颅内压增高,需要长时间氧疗的慢性呼吸系统疾病;②肺栓塞、气胸;③怀孕及哺乳期;④临床资料不完整者。根据患者是否并发VAP,将其分为VAP 组59 例和对照组136 例。所有患者或其家属对本研究知情同意且已签署知情同意书。
1.2 方法 患者入ICU 后对其原发病进行积极治疗,抗休克,纠正水电解质紊乱,应用广谱抗生素治疗严重感染,加强营养支持治疗等。机械通气采用肺保护性通气策略:潮气量为6~8 ml/kg,呼吸频率为16~20 次/min,根据P-V 曲线对呼气末正压进行调节,气道平台压≤30~35 cmH2O。
1.3 观察指标 收集两组一般及临床资料,包括年龄、性别、原发疾病(严重感染、休克、急性重症胰腺炎、创伤、DIC 等)、呼吸道病原菌培养结果。比较两组呼吸机参数、动脉血气、有无使用质子泵抑制剂、入院时Glasgow 评分、机械通气时间及28 d 死亡率,分析发生VAP 的危险因素。
1.4 统计学方法 应用SPSS 18.0 统计软件包进行数据处理分析,计量资料数据以()表示,两样本间比较采用t检验;计数资料以[n(%)]表示,比较采用X2检验;采用多因素Logistic 回归确定发生VAP 的危险因素。P<0.05 表示差异有统计学意义。
2 结果
2.1 两组一般及临床资料比较 VAP 组发病年龄高于对照组,差异有统计学意义(P<0.05);两组性别、体重指数、原发疾病比较,差异无统计学意义(P>0.05);VAP 组耐甲氧西林金黄色葡萄球菌(MASA)感染多于对照组,差异有统计学意义(P<0.05),见表1。
表1 两组一般及临床资料比较[,n(%)]
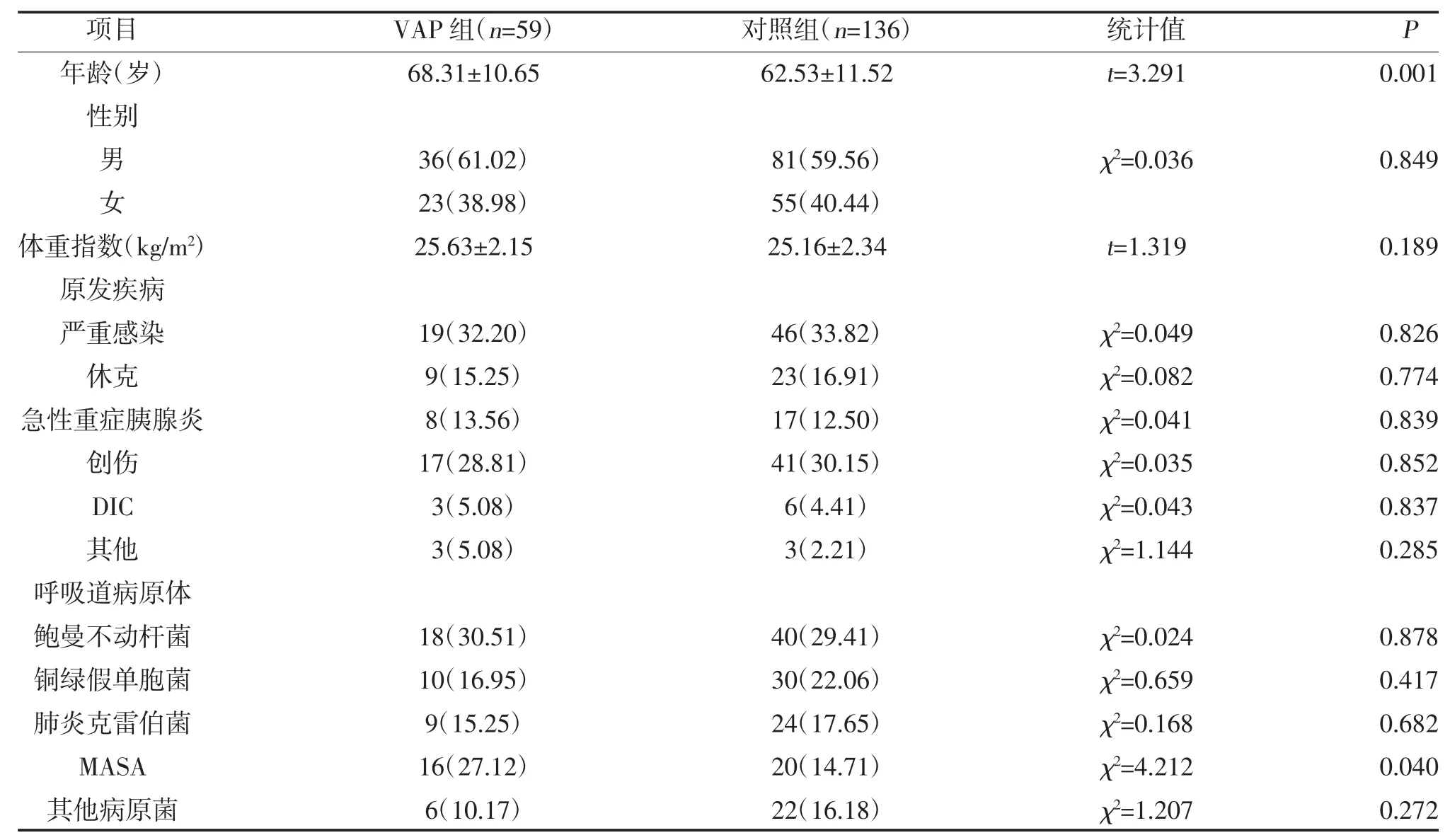
表1 两组一般及临床资料比较[,n(%)]
2.2 两组呼吸机参数、血气指标及预后比较 两组呼吸机参数、血气指标、体位比较,差异无统计学意义(P>0.05);VAP 组使用质子泵抑制剂多于对照组,入院时Glasgow 评分低于对照组,机械通气时间长于对照组,差异有统计学意义(P<0.05);VAP 组28 d死亡率高于对照组,但差异无统计学意义(P>0.05),见表2。
表2 两组呼吸机参数、血气指标及预后比较[,n(%)]

表2 两组呼吸机参数、血气指标及预后比较[,n(%)]
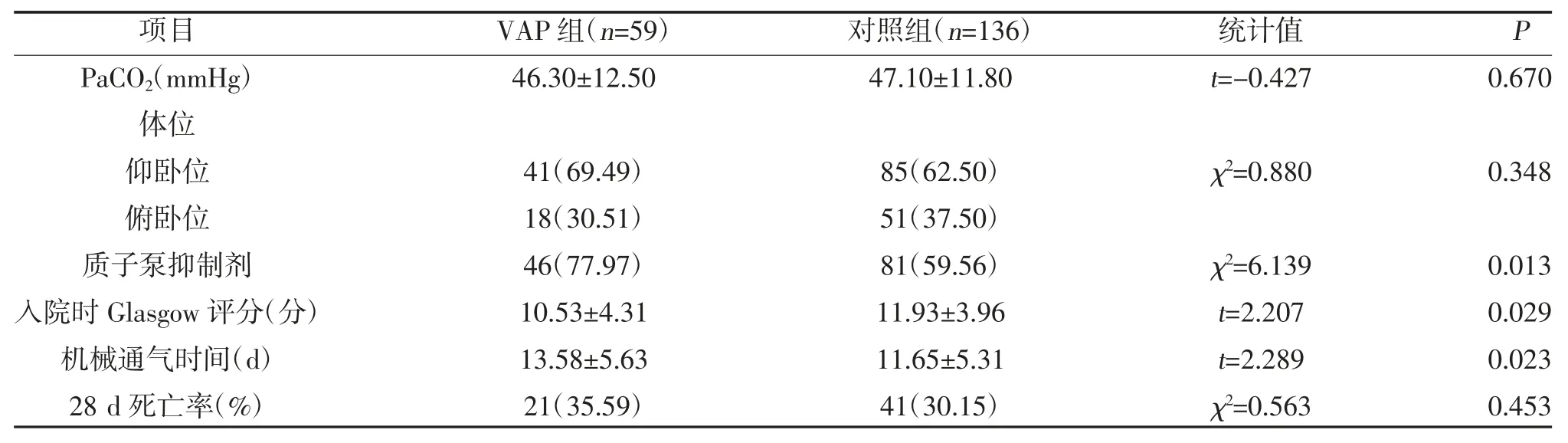
表2 (续)
2.3 影响ARDS 并发VAP 的多因素Logistic 回归分析 多因素Logistic 回归分析显示,入院Glasgow 评分<8 分、机械通气时间>2 周、应用质子泵抑制剂是引起ARDS 并发VAP 的危险因素,见表3。
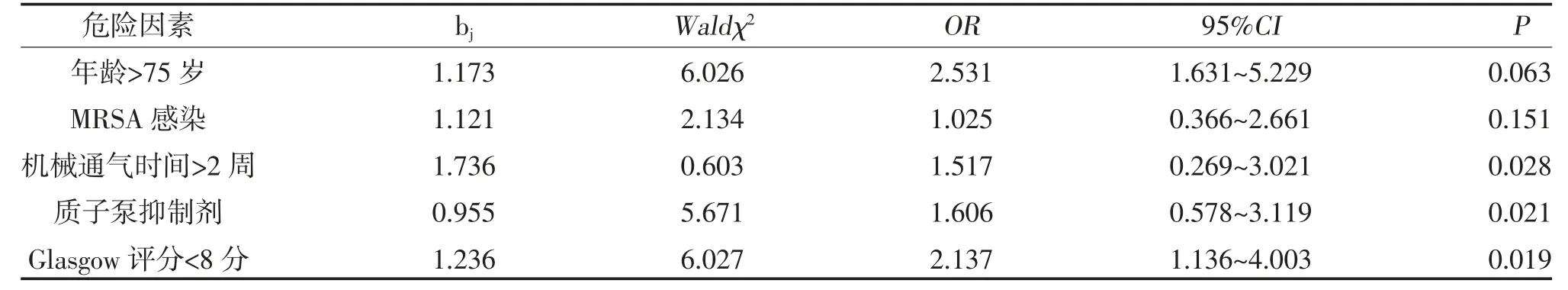
表3 影响ARDS 并发VAP 的多因素Logistic 回归分析
3 讨论
ARDS 是一种严重的急性呼吸衰竭,以弥漫性肺泡损伤、水肿或肺部结构扭曲引起的难治性低氧血症为临床特征[5]。ARDS 并发VAP 后,病情更复杂,可能通过加重低氧血症,以及引起败血症、多器官功能衰竭而影响预后[6]。ARDS 在病程中出现的发热、白细胞增多和气道脓性分泌物均属非特异性症状,由于所有ARDS 患者在胸部X 线片上均存在双侧弥漫性浸润阴影,单纯根据胸部影像学改变可能影响ARDS 并发VAP 的正确诊断。获得未受污染的远端呼吸道分泌物标本用于病原体培养,对于VAP的正确诊断至关重要[7,8]。VAP 的诊断除了胸片示肺部出现新的或进行性增大的浸润性阴影、实变体征外,还应要求气管内吸出物或支气管肺泡灌洗(BAL)中分离出新的致病菌,这降低了VAP 诊断出现假阳性的可能。本研究发现,ARDS 病程中,有59例(30.26%)患者诊断为VAP,与Forel JM 等[9]报道的ARDS 病程中VAP 28.9%的发病率相近,表明VAP 在ARDS 病程中并不少见。
由于多种因素可能导致ARDS 患者死亡率增加,因此很难评估VAP 对ARDS 死亡率的影响。有研究表明[10],在机械通气的危重ARDS 患者中有20%~75%因并发VAP 而最终死亡。而VAP 是否与ARDS 患者死亡率增加相关仍存争议。研究发现[11],与其他相关因素比较,VAP 对ARDS 患者预后影响差异并不显著,肺保护性通气时使用较低潮气量与ARDS 患者死亡率降低有关。ARDS 高死亡率可能与患者入院时SAPSⅡ评分高及合并多器官功能衰竭有关,两者均为增加死亡率的主要决定因素。Gonzales JN 等[12]研究发现,严重ARDS 患者使用神经肌肉阻滞剂后,并发VAP 的死亡率为41.8%,无VAP的ARDS 患者死亡率为30.7%(P=0.05);另外,男性和入院时格拉斯哥昏迷量表评分差与VAP 风险增加独立相关;该研究未发现VAP 是ARDS 患者死亡的重要预测因子,不支持VAP 与死亡率之间存在显著相关性。另有研究发现[13],VAP 可归因的ICU 死亡率仅为1%,患者多死于各种病因引起的多器官功能衰竭。本研究发现,VAP 患者ICU 住院期间死亡率为35.59%,无VAP 患者为30.15%,尚不能认为VAP 可增加ARDS 患者的死亡率。
本研究显示,机械通气时间>2 周、应用质子泵抑制剂、Glasgow 评分<8 分是引起VAP 的危险因素。多数研究支持VAP 发生与机械通气持续时间增加存在关联,VAP 患者机械性通气时间比无VAP 患者延长约9 d[14]。质子泵抑制剂是重症患者经常使用的药物,对于防治应激性溃疡的产生有重要临床意义。关于抗应激性溃疡药物预防作用的研究发现,增加胃肠pH 的药物与VAP 风险增加有关[15]。这与呼吸道误吸胃肠内容物和正常肠道菌群失调及异位有关。有学者发现,影响胃肠pH 值及肠道菌群的其他药物,如硫糖铝(及其使用的持续时间)也与VAP 风险增加有关。硫糖铝通过影响前列腺素代谢及肠道正常的运动功能可能参与肠道菌群失调及异位[16]。此外,Glasgow 评分可客观评估患者的意识状态,小于8 分时提示患者处于昏迷状态,出现吞咽反射、咳嗽反射不同程度减弱甚至消失,易发生误吸而导致下呼吸道感染[17]。因此,低Glasgow 评分处于昏迷状态的患者,应加强和重视呼吸道管理,预防误吸和反流,对于防止VAP 发生具有重要的临床意义[18,19]。本研究中,呼吸道分泌物病原微生物培养MRSA感染在VAP 组增多。MASA 是引起下呼吸感染常见的病原微生物,多见于近期使用过广谱抗生素以及长期静脉留置导管治疗的危重病患者,有发展为全身性炎症反应、脓毒性休克和器官功能衰竭的可能[20]。由于本组均为危重疾病患者,给予广谱、长疗程、大剂量的抗生素联合抗菌治疗,年龄因素及MASA 感染在多因素Logistic 回归分析均未显示统计学意义。
综上所述,ARDS 患者易并发VAP,与机械通气时间延长、应用质子泵抑制剂、低Glasgow 评分有关。VAP 并未增加ARDS 患者的28 d 的死亡率,可能与ARDS 存在多种致死性因素有关。但VAP 使ARDS 的病情变得更为复杂,影响ARDS 患者临床用药及ICU 住院时间,应重视VAP 患者临床管理,以减轻VAP 对ARDS 患者病情的不利影响。

