双重血浆分子吸附系统模式人工肝治疗对血小板的影响
贾金凤,梁 菲,黄建伟,王 昊,韩璞青
(广州医科大学附属第五医院消化内科,广州 510700)
肝功能衰竭是由于各种原因导致的肝功能严重损害或失代偿,如不进行及时干预,预后极差[1]。患者发生肝功能衰竭时,肝无法正常摄取、转化和排泄细胞毒性物质——胆红素,导致胆红素在人体内大量聚集,会对人体各个器官系统造成严重损害[2]。肝移植是治疗肝功能衰竭最有效的方法,但受困于供体较少、医学伦理复杂以及费用较高等限制,临床推广极为困难[3]。人工肝是一种利用体外支持装置,清除血液中循环有害物质的临时性替代性治疗方式,能够为患者肝细胞再生和等待肝移植等赢得时间[4]。血浆置换(plasma exchange,PE)是最早的人工肝模式,但其对新鲜血浆的需求量较高,且清除胆红素等毒性物质的能力稍弱[5]。双重血浆分子吸附系统(double plasma molecular absorb system,DPMAS)是一种特异性吸附胆红素、胆汁酸及大分子毒素等的系统,适用于治疗伴有高胆红素血症的各种重症肝功能衰竭[6]。既往的临床经验发现DPMAS模式可能降低患者的血小板水平,增加出血风险。因此本研究回顾分析了广州医科大学附属第五医院行人工肝治疗患者的病例资料,比较DPMAS模式和传统的PE模式人工肝治疗对患者血小板的影响,并评价重组人血小板生成素注射液对此类血小板下降的临床疗效。
1 资料与方法
1.1 一般资料
选择2018年1月—2020年11月于广州医科大学附属第五医院住院治疗的15例DPMAS模式人工肝患者纳入DPMAS组,其中男14例,女1例,年龄28~65岁,平均50岁,住院时间8~35 d,中位数为20 d,其中有肝衰竭12例,急性黄疸型肝炎2例,梗阻性黄疸1例;另选择同期、年龄匹配(±5岁)接受血浆置换(PE)的患者15例,纳入PE组,其中男性12例,女性3例,平均年龄51岁,住院时间中位数21 d,其中肝衰竭11例,急性黄疸型肝炎2例,梗阻性黄疸2例。对两组患者病例资料进行回顾性分析比较。纳入标准:患者均符合2016年版《非生物型人工肝治疗肝衰竭指南》中的人工肝适应证。排除标准:(1)活动性出血或弥漫性血管内凝血者;(2)对治疗过程中所用血制品或药品如血浆、肝素和鱼精蛋白等严重过敏者;(3)血流动力学不稳定者;(4)心脑血管意外所致梗死非稳定期者;(5)血管外溶血者;(6)严重脓毒症者;(7)血液系统疾病、失血性休克及年龄<18岁者。
本研究开始前已经广州医科大学附属第五医院伦理委员会审查批准。
1.2 方法
所有患者予以常规内科治疗,PE患者采用Microplas MPS血浆分离器MPS07(贝尔克公司,意大利),每次血浆置换量2 500~3 000 mL,血流速度100 mL/min,分浆率20%,血浆补充量 2 000~2 500 mL及5%(质量分数)人血白蛋白500 mL,一般治疗时间2.5~3 h。DPMAS组患者采用MultiFiLtrate设备(FRESENIUS KABI,德国),血浆从体内泵除后首先经过Plasmaflus血浆过滤器,然后依次流过离子交换树脂(BS330)和中性大孔吸附树脂(HA330-Ⅱ),与血细胞混合后输注回患者体内,根据疾病严重程度,进行1~15次人工肝支持治疗。
1.3 观察指标
比较两组患者人工肝治疗前后的临床症状(如乏力、黄疸、少尿、水肿等)是否改善,并比较两组患者治疗前后的血常规(特别是血小板)、凝血功能等指标变化趋势,比较患者治疗期间重组人血小板生成素的使用情况以及血小板的输注量。
1.4 疗效判定
有改善:乏力、食欲减退等肝功能衰竭临床症状明显好转,肝性脑病、肝肾综合征等得到控制,血清总胆红素<正常上限值的5倍。无改善:治疗后,临床症状或肝功能指标无明显变化,或病情加重,出现并发症。
1.5 统计学分析
采用SPSS 22.0软件,计量资料经方差检验后以均数±标准差表示,组间比较采用独立样本t检验;计数资料采用频数(率)的形式表示,组间比较采用卡方检验,P<0.05认为差异有统计学意义。
2 结果
2.1 两组患者临床症状改善情况和转归比较
两组患者的临床症状改善率差异无统计学意义[86.67%(13/15)vs.73.33%(11/15),χ2=0.833,P>0.05],两组患者90 d内的病死率差异无统计学意义[46.67%(7/15)vs.66.67%(10/15),χ2=1.222,P>0.05]。
2.2 两组患者治疗前后血常规和凝血功能指标比较
治疗后白细胞(white blood cell, WBC)、红细胞(hemoglobin, Hb)两组患者比较差异无统计学意义(P>0.05)。DPMAS组患者治疗后血小板(platelet, PLT)水平明显低于治疗前(P<0.05),且显著低于治疗后PE组(P<0.05)。治疗后PE组患者的国际标准化比值(international normalized ratio, INR)得到明显改善(P<0.05),但DPMAS组患者INR水平变化无统计学意义(P>0.05, 表1)。
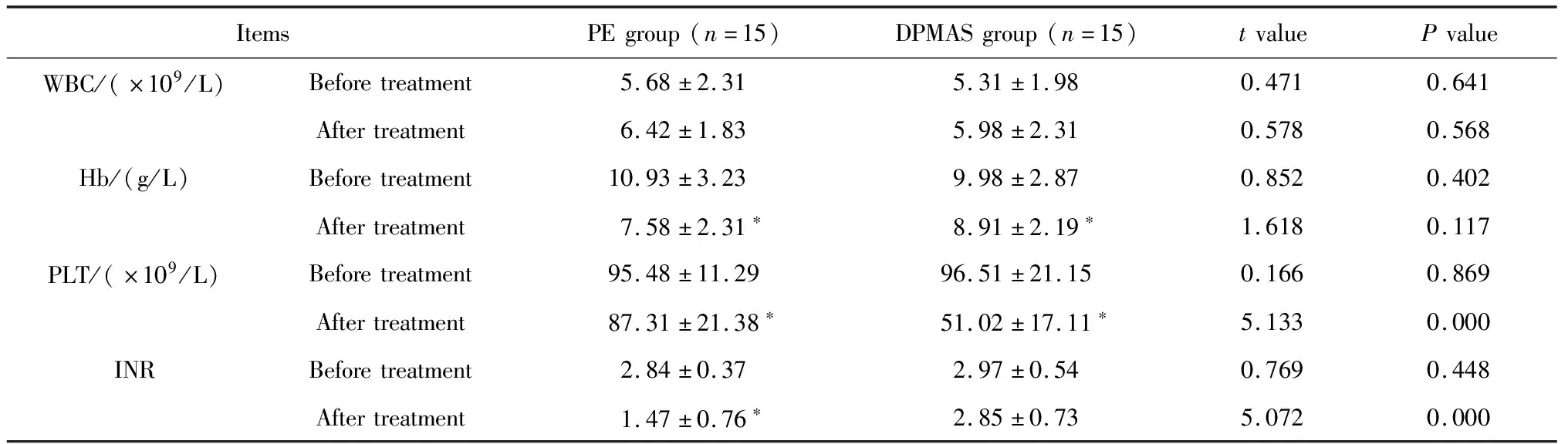
表1 两组患者治疗前后血常规和凝血功能指标比较
2.3 两组患者治疗前后生化指标比较
PE组治疗前后ALT、AST、TBil比较,差异有统计学意义(P<0.05)。DPMAS组治疗前后ALT、AST、TBil比较,差异有统计学意义(P<0.05, 表2)。

表2 两组患者治疗前后生化指标比较
2.4 DPMAS组重组人血小板生成素使用情况及血小板变化情况
DPMAS组使用重组人血小板生成素平均(8.2±3.1)支,住院期间输注血小板(1.5±0.3)IU,输注重组人血小板生成素后血小板明显上升(图1)。

Red arrow, start time of infusion of recombinant human thrombopoietin.
3 讨论
肝是人体极为重要的器官之一,各种原因引起的肝功能衰竭可能会导致高胆红素血脂、出凝血异常、腹水甚至肝性脑病等严重后果,如得不到及时治疗可能危及患者生命。人工肝治疗是临床上用于临时治疗肝功能衰竭的方法之一,可以临时替代肝的部分功能,过滤血液中的胆红素等,减轻肝的负担,为肝细胞再生创造机会,也为部分患者赢得移植前的等待供体时间[7-8]。临床最常见的人工肝是非生物型的,通过各项不同模式的互相组合,发挥不同的肝替代功能,应用最为广泛的是血浆置换或血浆置换联合滤过[9]。
胆红素作为一种细胞毒型物质,其在体内的大量聚集会启动肝细胞凋亡程序,还会导致免疫损伤的发生[10-11]。DPMAS是一种针对高胆红素血症的有效治疗方法,其通过HA330-Ⅱ和BS330吸附柱特异性吸附胆红素,并通过HA330-Ⅱ吸附柱吸附血液中的大分子毒素、氨、硫醇等。既往的研究显示,DPMAS模式比常规的PE模式更能降低血液中的胆红素水平[12]。本研究发现DPMAS模式比PE模式更容易降低血小板水平,这可能是因为在单纯进行DPMAS模式人工肝治疗过程中,无法补充新鲜血浆(包括凝血因子、血小板等)。本研究也证实单纯DPMAS模式并不能有效改善患者的凝血功能,提示应用DPMAS模式进行人工肝治疗的时候需加强对凝血因子、血小板的补充。农村立等[13]指出,DPMAS序贯PE,既能够改善凝血功能,亦达到了吸附胆红素、炎性介质等的目的。但由于临床新鲜血浆供应短缺以及费用等问题,DPMAS序贯PE治疗技术的推广存在较大难度,因此,临床上希望可以找到更好的改善方法。
重组人血小板生成素是通过中国仓鼠卵巢细胞表达,经提纯制成的,其药理作用与内源性血小板生成素具有很高的相似性,通过结合靶细胞表面的血小板生成素受体实现刺激干细胞增殖的作用,还能够诱导巨核细胞增殖、分化和成熟[14-15]。本研究发现,对于接受DPMAS模式人工肝治疗后血小板降低的患者,运用重组人血小板生成素后能够提高血小板的水平,特别是在用药8 d后可使血小板达到正常值,从而降低因血小板下降导致的出血风险,但本研究的病例数较少,且未与DPMAS序贯PE模式等其他人工肝模式进行比较,因此还有待更深入的研究。
综上所述,与PE模式相比,DPMAS人工肝模式可能降低患者血小板水平,应用重组人血小板生成素可刺激患者血小板再生,提高血小板水平,从而降低因血小板低下而发生的出血风险。

