玉米秸秆降解真菌的筛选鉴定
张艳萍 赵瑛 张运晖
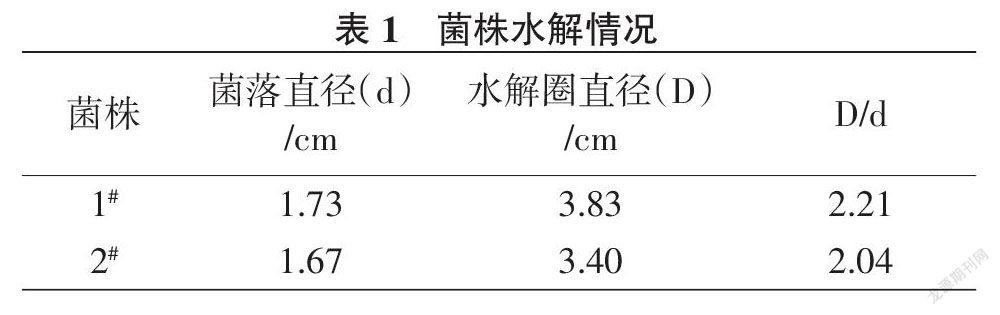

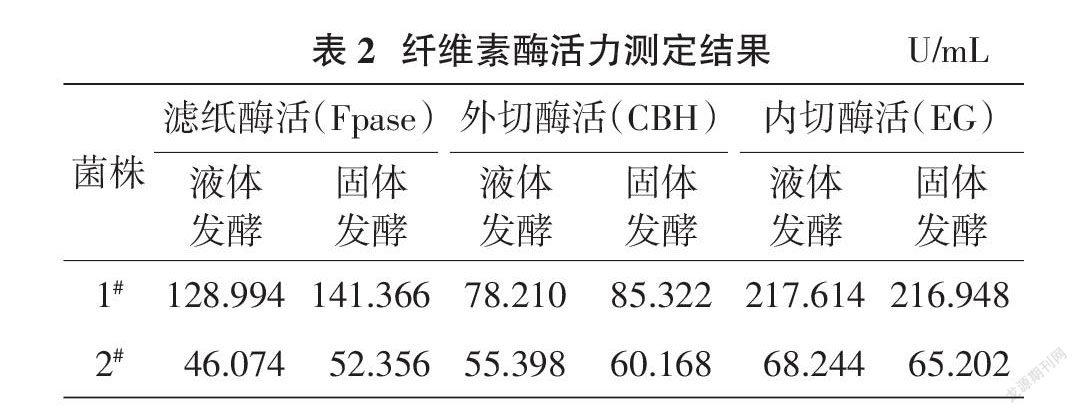


摘要:为筛选适宜的玉米秸秆纤维素降解菌株作为玉米秸秆腐熟菌剂菌株资源储备,通过采用腐殖玉米秸秆土壤微生物培养筛选、刚果红水解圈测试及酶活测定等多种方法的应用,筛选得到2株具有纤维降解能力的真菌1#菌株和2#菌株。经形态学和分子生物学鉴定,初步确定1#菌株为长枝木霉,2#菌株为聚多曲霉。真菌1#菌株和2#菌株在刚果红培养基上均呈现比生长圈大2倍的水解圈。2个菌株在液体、固体2种酶液发酵情况下均表现内切酶活较强(65.202~217.614 U/mL),均高于外切酶活(55.398~85.322 U/mL)和滤纸酶活(46.074~141.366 U/mL),认为这2个菌株可作为玉米秸秆专用腐熟菌剂研发的储备菌株。
关键词:玉米秸秆;降解;真菌;菌株;纤维素;筛选;鉴定
中图分类号:S513;X172 文献标志码:A 文章编号:1001-1463(2022)05-0055-05
doi:10.3969/j.issn.1001-1463.2022.05.014
Screening and Identification of Fungi for Maize Straw Degradation
ZHANG Yanping, ZHAO Ying, ZHANG Yunhui
(Institute of Biotechnology, Gansu Academy of Agricultural Sciences, Lanzhou Gansu 730070, China)
Abstract:In order to screen cellulose-degrading strains for maize straw as the reserve of decomposing agents, in this study, a variety of methods such as screening medium with only corn stalk powder,congo red hydrolytic circle test and enzyme activity determination were used toscreen out two strains 1# and 2# with fiber degradation ability. After morphological and molecular identification, strain 1# was Trichodema longibrachiatum and strain 2# was Aspergillus sydowii. Two fungi showed hydrolytic circles twice larger than growth circles on congo red medium. Through liquid and solid fermentation, two fungi showed stronger endonuclease activity(65.202 to 217.614 U/mL) than exonuclease activity(55.398 to 85.322 U/mL) and filter paper activity (46.074~141.366 U/mL), two fungi could be used as reserve strains for developing special decomposing agent of maize straw.
Key words:Maize straw; Degrade; Fungus; Strain; Cellulose; Screening; Identification
作物的秸稈是一种有利于土壤改良的有机肥源,是直接有效的可再生资源,主要由木质素和纤维素组成,含有非常丰富的有机质、微量元素、氮、磷、钾,可以提供农作物生长所需的多种营养元素,对作物增产起到一定作用[1 - 2 ]。我国每年产生的玉米秸秆可超过2亿t[3 ]。目前对秸秆较广泛且有效的利用方式为直接机械破碎还田[4 - 5 ]。秸秆因其主要成分为纤维素、木质素和半纤维素[6 ],还田后普遍存在降解所需时间长问题,有时会影响种植需求[7 ]。能降解秸秆纤维素的微生物得到诸多学者的关注和研究[8 - 13 ],这些微生物将是解决秸秆问题的重要资源。目前报道的秸秆降解菌虽然已经很丰富,但菌株也会有衰退发生,筛选更多的秸秆降解菌作为资源库储备,对秸秆还田意义重大。
1 材料与方法
1.1 供试材料
1.1.1 试验样品 腐殖玉米秸秆土壤采集于甘肃省临洮县玉米种植地。60目玉米秸秆购于惠丰秸秆农产品深加工专业合作社。
1.1.2 试验药品 试验中所用药品试剂均购于甘肃艾尔维科学仪器有限公司。
1.1.3 培养基 土壤中微生物培养、纯化和保存采用马铃薯葡萄糖培养基(PDA),筛选采用玉米秸秆筛选培养基(YS)、羧甲基纤维素钠刚果红琼脂培养基(CMC-Na),发酵采用玉米秸秆液体发酵培养基(YFY)和玉米秸秆固体发酵培养基(YFG)。①PDA培养基:马铃薯200 g、葡萄糖20 g、琼脂18 g,加蒸馏水定容至1 L,自然pH,121 ℃灭菌30 min。②YS培养基:称取60目的玉米秸秆80 g,加蒸馏水煮沸30 min,用纱布过滤,滤液中加琼脂18 g,加蒸馏水定容至1 L,自然pH,121 ℃灭菌30 min。③CMC-Na培养基:CMC-Na 2.0 g、刚果红0.4 g、K2HPO4 1.0 g、MgSO4 0.5 g、(NH4)2SO4 2.0 g、NaCl 0.5 g、琼脂18.0 g,加蒸馏水定容至1 L,自然pH,121 ℃下灭菌30 min。④YFY培养基:称取60目的玉米秸秆20 g,赫奇逊氏无机盐培养基1 000 mL,pH 7.2左右,121℃下灭菌30 min。⑤YFG培养基:称取60目的玉米秸秆20 g,赫奇逊氏无机盐培养基40 mL,pH 7.2左右,121 ℃蒸汽灭菌30 min。⑥赫奇逊氏(Huchinson)无机盐培养基:NaNO3 2.5 g、KH2PO4 1.0 g、MgSO4·7H2O 0.3 g、NaCl 0.1 g、CaCl2 0.1 g、FeCl3 0.01 g、蒸馏水1 000 mL,pH 7.2左右。
1.2 试验方法
1.2.1 菌株初筛 称取腐殖玉米秸秆土壤1 g接种于100 mL的PDA液体培养基内,180 r/min、28 ℃富集培养24 h。在无菌操作台内,取1 mL培养液用无菌水按梯度稀释至10、102、103、104、105的浓度,分别涂布于YS平板上,在28 ℃条件下培养3~5 d。选取长势旺盛的真菌菌株再接种于PDA培养基上纯化后保存。
1.2.2 CMC-Na水解圈筛选 将初筛得到的菌株用0.5 cm的打孔器制备成菌饼,分别倒置接种在CMC-Na培养基上,28 ℃恒温培养箱中暗培养5 d。根据刚果红培养基显示的透明圈的大小及透明圈与菌落直径比,挑取比值大的菌株保存备用。
1.2.3 酶液的制备 ①液体发酵酶液的制备:将菌株孢子液(×108个孢子量)按1%的体积比接种到YFY培养基上,28 ℃、200 r/min下培养6 d,取发酵液于4 ℃、10 000 r/min下离心10 min,取上清液即为制备的粗酶液。②固体发酵酶液的制备:将菌株孢子液(×108个孢子量)按10%的体积比接种到YFG培养基上,28 ℃下暗培养6 d后取出1 g发酵培养物,加10倍于酶曲质量的无菌水,30 ℃、200 r/min下浸提1 h,取发酵液于4 ℃、10 000 r/min下离心10 min,取上清液即为粗酶液。
1.2.4 酶活测定 ①全酶活(FPase)测定:将50 mg无淀粉的新华滤纸置于刻度试管,再加入1.5 mL柠檬酸缓冲液(0.05 mol/L、pH 5.0)和0.5 mL粗酶液,混合后50 ℃下水浴1h,随后按DNS法测定还原糖含量[14 ]。②外切酶活(CBH)测定:将50 mg的脱脂棉置于刻度试管,再加入1. 5 mL柠檬酸缓冲液(0.05 mol/L、pH 5.0)和0.5 mL粗酶液,混合后放于50 ℃水浴1 h,隨后按DNS法测定还原糖含量[14 ]。③内切酶活(EG)测定:取具刻度试管,依次加入1.5 mL含有1% CMC的柠檬酸缓冲液(0.05 mol/L、pH 5.0)和0.5 mL粗酶液,混合后50 ℃下水浴30 min,随后按DNS法测定还原糖含量[14 ]。
酶活性单位定义:50 ℃时1 mL酶液在1 h内生成1 μmol葡萄糖所需要的酶量。
酶活力(U/mL)=(葡萄糖含量×1 mg葡萄糖物质的量)/(酶液用量×反应时间×1 000)
1.2.5 菌株鉴定 ① 形态学观察。蘸取一环菌株接种于PDA培养基上,28 ℃培养5~7 d,观察和记录菌株生长形态。②分子生物学鉴定。菌株DNA提取和ITS扩增测序均交于南京集思慧远公司进行。将测序结果拼接,除去两端不可信序列,利用Nucleotide BLAST进行序列比对分析,用MEGA 6.0软件聚类分析,构建系统发育树。
2 结果与分析
2.1 玉米秸秆降解真菌筛选
通过富集、稀释,从筛选培养基YS上筛选培养的微生物中,选取其中生长旺盛的2株真菌,分别标记为1#菌株和2#菌株,在PDA培养基上连续点接进行分离纯化。
2.2 CMC-Na水解圈检测
纯化好的真菌接于刚果红培养基上,培养5 d后测量菌落直径(d)和水解圈直径(D),以D/d > 2为界限筛选菌株(表1)。结果(图1)显示,在刚果红培养基上1#菌株和2#菌株均有所生长,生长圈呈圆形,直径分别为1.73 cm和1.67 cm,生长圈边缘均呈现比生长圈大2倍的水解圈,直径分别为3.83 cm和3.40 cm。
2.3 菌株纤维素酶活力
将1#菌株和2#菌株分别进行液体和固体发酵下的滤纸酶活(Fpase)、外切酶活(CBH)和内切酶活(EG)测定结果(表2)显示,2个菌株在液体、固体2种发酵情况下均表现为内切酶活较强(65.202~217.614 U/mL),均高于外切酶活(55.398~85.322 U/mL)和滤纸酶活(46.074~141.366 U/mL)。
2.4 菌株形态学观察
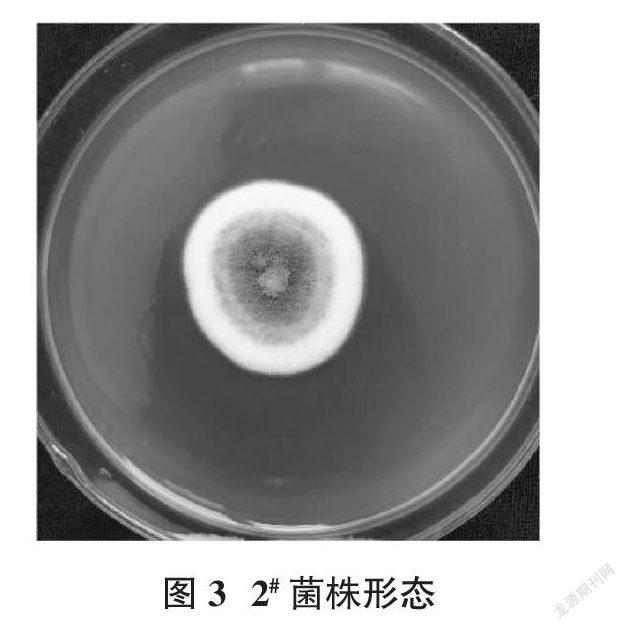
2.4.1 形态鉴定 1#菌株在PDA培养基上室温培养5 d,菌体铺满整个培养皿,菌丝在菌落中央生长浓密且为草绿色,向外逐渐生长稀疏且颜色变浅,边缘白色菌斑较多。菌体生长的培养基颜色也变为黄绿色(图2)。2#菌株在PDA培养基上室温培养5 d,菌体仅在初期接种部位有所生长变厚,初期为白色,逐渐变成灰黑色(图3)。
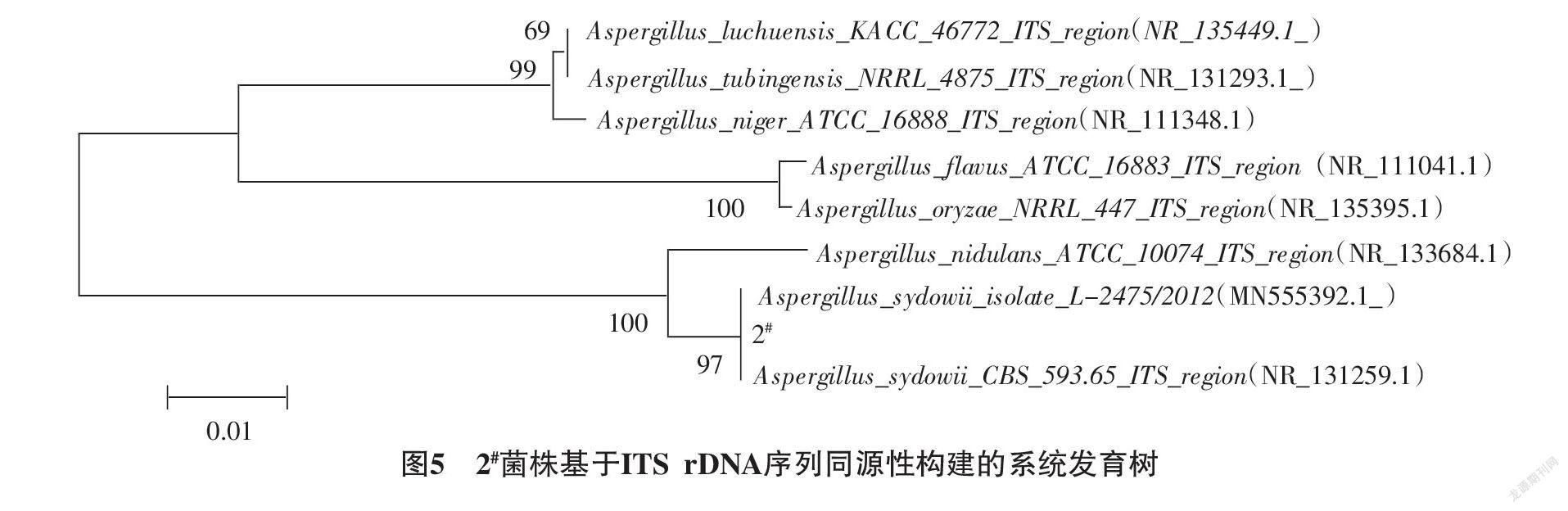
2.4.2 分子生物学鉴定 对1#菌株和2#菌株进行ITS扩增测序,对测序结果通过NCBI进行同源比对分析可看出,1#菌株的基因序列与公开发表的木霉属同源性较高,相似度达99.66%;2#菌株与曲霉属同源性较高,相似度达99.81%。采用MEGA6.0的Neighbor-Joining将1#菌株与木霉菌属内的多个不同种的基因序列进行系统发育树的构建,遗传距离显示1#菌株与长枝木霉种的最近(图4)。对2#菌株与曲霉菌属内的多个不同种的基因序列进行系统发育树构建,遗传距离显示菌株2#与聚多曲霉种最近(图5)。结合形态鉴定,参照《真菌鉴定手册》《中国真菌志》并结合相关文献[15 - 20 ],初步确定1#菌株为长枝木霉(Trichoderma longibrachiatum),2#菌株为聚多曲霉(Aspergillus sydowii)。
3 結论与讨论
试验通过采用腐殖玉米秸秆土壤微生物培养筛选、刚果红水解圈测试及酶活测定等多种方法,筛选得到了2株具有纤维降解能力的菌株1#菌株和2#菌株。经形态学观察和分子生物学鉴定,初步确定1#菌株为长枝木霉(Trichoderma longibrachiatum),2#菌株为聚多曲霉(Aspergillus sydowii)。1#菌株和2#菌株在液体、固体2种发酵情况下均表现内切酶活较强(65.202~217.614 U/mL),均高于外切酶活(55.398~85.322 U/mL)和滤纸酶活(46.074~141.366 U/mL)。纤维素酶不是单一酶,而是起协同作用的能够使纤维素变成纤维二糖和葡萄糖的一组酶的总称,其中外切酶和内切酶主要的作用就是溶解纤维素[21 ]。经测定1#菌株和2#菌株均有较高的内切酶活和外切酶活,接下来应进一步探索其对玉米秸秆纤维素的降解能力,分析将其制备成玉米秸秆腐熟菌剂的现实应用价值。
参考文献:
[1] 朱 敏,于和平,涂国良,等. 秸秆腐熟剂对玉米秸秆腐熟及土壤肥力的影响[J]. 甘肃农业科技,2021,
52(12):14-21.
[2]王德贤,王希恩,吴巧红,等. 天水市作物秸秆综合利用现状及对策[J]. 甘肃农业科技,2020(1):55-59.
[3] 王艳锦,王博儒,张全国. 秸秆资源化利用途径及建议[J ]. 河南农业科学,2009(7):23-26.
[4] 李江燕,王俊飞,王云立. 玉米秸秆降解菌的筛选[J]. 再生利用,2018,11(11):33-35.
[5] 马欣雨,孙丽娜,卢 珊,等. 秸秆降解菌的筛选及对秸秆的降解效果[J]. 生态学杂志,2020,39(4):1198-1205.
[6] NAKASHIMA Y,ORSKOV E R. Rumen degradation of straw. Effect of cellulaseandammonia treatment on different varieties of rice straw and their botanical fractions[J]. Animal Science,2010,50 (2):309-317.
[7] 邢慧珍,宋水山,黄媛媛,等. 一株低温玉米秸秆降解真菌的筛选、鉴定及降解特性[J]. 微生物学通报,2020,47(9):2923-2933.
[8] 赵 旭,王文丽,李 娟. 玉米秸秆低温降解菌的分离筛选及鉴定[J]. 土壤与作物,2017,6(3):192-198.
[9] 胡海红,孙继颖,高聚林,等. 低温高效降解玉米秸秆复合菌系发酵条件优化及腐解菌剂的研究[J]. 农业环境科学学报,2016, 35(8):1602-1609.
[10] 王 垚,韩燕峰,梁宗琦. 两株戴氏霉对水稻秸秆的降解及产酶研究[J]. 菌物学报,2017,36(5):598-603.
[11] 江高飞,暴彦灼,杨天杰,等. 高温秸秆降解菌的筛选及其纤维素酶活性研究[J]. 农业环境科学学报,2020,39(10):2465-2472.
[12] 于慧娟,郭夏丽. 秸秆降解菌的筛选及其纤维素降解性能的研究[J]. 生物技术通报,2019,35(2):58-63.
[13] 王炳坤,郭立炜,王 刚,等. 秸秆降解菌筛选及其应用研究进展[J/OL]. 分子植物育种:1-11[2021- 12-19]. http://kns.cnki.net/kcms/detail/46.1068.S.2021 1109.1357.004.html.
[14] 田淑雨,鹿士峰,吴杨洋,等. 超声破碎辅助提取灵芝多糖工艺优化及抗氧化活性研究[J]. 食品研究与开发,2019,40(8):101-107.
[15] 魏景超. 真菌鉴定手册[M]. 上海:上海科学技术出版社,1979.
[16] 沈亚恒,叶东海. 中国真菌志[M]. 北京:科学出版社,2006.
[17] 王春明,元维伟,郭 成,等. 二月兰种子中甘蓝链格孢带菌率检测及6种杀菌剂对病菌的毒力测定[J]. 甘肃农业科技,2021,52(4):18-22.
[18] 蒋晶晶,王春明,杜 蕙. 蛇床子素对6种植物病原真菌的毒力测定[J]. 甘肃农业科技,2017(11):33-35.
[19] 杜 蕙,蒋晶晶. 农药助剂激健和安融乐对防治葡萄霜霉病杀菌剂的减量增效试验初报[J]. 甘肃农业科技,2020(11):55-59.
[20] 周天旺,王春明,张小杰,等. 288份玉米种质资源普通锈病的抗性鉴定与评价[J]. 甘肃农业科技,2021,
52(2):15-19.
[21] 张继泉,王瑞明,孙玉英,等. 里氏木霉生产纤维素酶的研究进展[J]. 饲料工业,2003,24(1):9-13.

