金黄色葡萄球菌诱导大鼠乳腺炎模型的建立
张 迪,靳国忠,王 霄,韩 超,吴占军,史万玉,2
(1.河北农业大学中兽医学院,河北保定 071000;2.河北省兽医生物技术创新中心,河北保定 071000;3.河北省农林科学院粮油作物研究所,河北石家庄 050035)
牛奶作为人类日常生活中的必需品,而奶牛乳房炎对奶牛养殖业来说是非常严重的疾病,奶牛一旦发生乳房炎,牛奶品质必将受到影响,产奶量也会降低[1],严重的会引发败血症,导致死亡[2]。引起奶牛乳房炎的病原菌主要为金黄色葡萄球菌(Staphylococcusaureus)、大肠埃希氏菌以及链球菌,而金黄色葡萄球菌性乳房炎是其中最常见的病原菌[3]。金黄色葡萄球菌感染的乳房炎类型多为隐性或慢性感染,它可以进入乳腺上皮细胞以及巨噬细胞内生存,从而使抗菌药物很难发挥作用[4]。以奶牛作为试验动物成本高,且不易操作,自从20世纪70年代Chandler成功建立了小鼠乳腺炎模型后[5],成为众多科研人员进行疫苗研发及药物治疗的不二之选,但小鼠乳腺炎必须借助体式显微镜才能观察到乳导管[6],操作要求较高,而大鼠乳腺不需要放大也可以看到,相比小鼠更加方便,建立大鼠乳腺炎模型,反映机体的炎症水平,为奶牛乳房炎的体内机制研究、药物治疗效果评价,提供可靠的乳腺炎模型成为一种趋势[7]。为此,本试验采用临床患有乳房炎的奶牛乳汁中分离纯化得到的金黄色葡萄球菌感染大鼠乳腺从而建立大鼠乳腺炎模型,为后续乳房炎研究提供依据。
1 材料与方法
1.1 材料
1.1.1 实验动物和菌种 健康SPF级Wistar大鼠,购自斯贝福(北京)生物技术有限公司[实验动物许可证号SCXK(京)2019-0010];金黄色葡萄球菌分离自临床乳房炎病例,由河北农业大学预防兽医实验室提供。
1.1.2 主要试剂 LB肉汤、琼脂粉,北京索莱宝科技有限公司产品;Rat TNF-α ELISA试剂盒、Rat IL-1β ELISA试剂盒,上海酶联生物科技有限公司产品;Rat IL-6 ELISA试剂盒,R&D SYSTEMS产品;组织蛋白抽提试剂盒,康为世纪生物科技有限公司产品;SDS-PAGE凝胶制备试剂盒、4×蛋白上样缓冲液,北京博迈德生物技术有限公司产品;蛋白Marker、GAPDH抗体,北京全式金生物技术有限公司产品;BCIP/NBT显色液,北京百智生物科技有限公司产品;TLR2抗体、p-p65 抗体,北京博奥森生物技术有限公司产品。
1.1.3 主要仪器 兽用全自动血液细胞分析仪(BC-2800Vet),深圳迈瑞生物医疗电子股份有限公司产品;生化培养箱(SPX-250B-Z),上海博讯实业有限公司产品;台式恒温振荡器(TH2-3-20),上海精宏实验设备有限公司产品;组织匀浆机(T10BS25),艾卡(广州)仪器设备有限公司产品;高速低温离心机(CT14RD),上海天美生化仪器设备工程有限公司产品;电泳仪(DYCZ-24DN)、转膜仪(DYCZ-40D)、电泳仪电源(DYY-8C),北京六一生物科技有限公司产品;组织包埋机(KD-BM Ⅲ)、切片机(KD-2508),浙江省金华市科迪仪器设备有限公司产品。
1.2 方法
1.2.1 动物分组与处理 SPF大鼠54只,18只公鼠,36只母鼠,先适应1周,随后公母1∶2合笼,观察阴栓辨别是否怀孕,怀孕后将母鼠分笼饲养。将泌乳至第7天的健康母鼠36只随机分为C、M1、M2、M3、M4、M5共6组,每组6只。C组:生理盐水组,每只母鼠第4对乳腺每侧注射0.1 mL无菌生理盐水;M1、M2、M3、M4、M5组:每只母鼠第4对乳腺每侧分别注射0.1 mL含金黄色葡萄球菌2×105、2×106、2×107、2×108、2×109CFU/mL的细菌悬液。具体操作为取泌乳第7天的母鼠于接菌前2 h使其与仔鼠分离,用乙醚麻醉后固定母鼠。大鼠第4对乳腺用750 mL/L酒精消毒皮肤,然后用小镊子轻轻夹起乳头,用100 μL微量注射器沿乳头管插入,大约插入2 mm~3 mm,保持注射器不动,缓慢注入菌液。
1.2.2 大鼠临床表现及眼观病理变化 观察并记录大鼠饮食饮水情况、精神状况、有无死亡等表现,以及处死后乳腺病理变化。
1.2.3 乳腺组织HE染色 注菌后24 h用乙醚麻醉大鼠,脱椎处死,剪开腹部皮肤但不剪开腹腔,用手术刀和镊子轻轻分离第4对乳腺,一侧乳腺放入中性福尔马林溶液中固定,随后进行HE染色,观察组织病理变化。
1.2.4 乳腺组织细菌计数 取另一侧部分乳腺按照1 mL∶100 mg的比例加入生理盐水后使用匀浆器匀浆,取匀浆液100 μL采用平板计数法测定乳腺组织内的细菌数量。
1.2.5 血常规检查 将感染24 h的大鼠乙醚麻醉后,左手固定母鼠,右手持10 mL注射器进行心脏采血,将血液打入抗凝管,立即用血细胞分析仪进行血细胞分析。
1.2.6 乳腺组织中IL-1β、IL-6、TNF-α含量测定 采集乳腺组织,称取0.1 g加入900 μL的磷酸盐缓冲盐溶液,用匀浆器充分匀浆,匀浆过程在冰盒上进行,之后使用4°C离心机2 500 r/min离心20 min,收集上清进行白细胞介素1β(interleukin-1β,IL-1β)、白细胞介素6(interleukin- 6,IL-6)、肿瘤坏死因子α(tumor necrosis factor-α,TNF-α)含量测定。
1.2.7 乳腺组织中TLR2、p-p65蛋白表达的测定
将Tissue protein extraction reagent与Protease inhibitor cocktail 、Phosphatase inhibitors按98∶1∶1的比例配置蛋白提取液,称取0.1 g乳腺组织加入1 mL蛋白提取液,使用BCA(bicinchoninic acid)法测定蛋白浓度并调整至同一浓度,Western blot检测各组乳腺组织中Toll样受体2(Toll-like receptor 2,TLR2)、磷酸化的核因子κB(p-NFκB,p-p65)蛋白含量,结果使用Image J图像分析软件测量灰度值,以目的蛋白条带与内参条带的灰度值比值表示其相对含量。
1.2.8 数据处理 使用SPSS 19.0分析软件(IBM Corporation,Armonk,NY,USA)对试验数据进行统计分析,显著性水平为P<0.05或P<0.01。
2 结果
2.1 临床表现及乳腺眼观病变
C组空白对照未出现任何临床症状;M1和M2组大鼠饮水采食轻微减少,活动量相比空白组减少,精神轻度沉郁;M3及M4组大鼠饮食和饮水量明显减少,精神沉郁,被毛粗糙,蜷缩弓背,偶见腹泻;M5组大鼠被毛粗糙无光泽,蜷缩在一角,精神萎靡,用手触碰反应慢,死亡2只。剖开腹部皮肤后观察乳腺组织,C组乳腺呈粉白色,无出血,有光泽;M1组乳腺组织出血较轻微,有光泽;M2组乳腺弥散出血,体积较正常组织增大,颜色发暗;M3组乳腺组织相比空白组粗糙,有明显出血点,体积缩小,无光泽;M4组乳腺组织可见明显大量弥散性出血点,血管增多,颜色明显发暗,体积缩小;M5组乳腺组织出血和淤血严重,组织化脓,颜色暗沉,体积显著缩小,组织损伤严重(图1)。
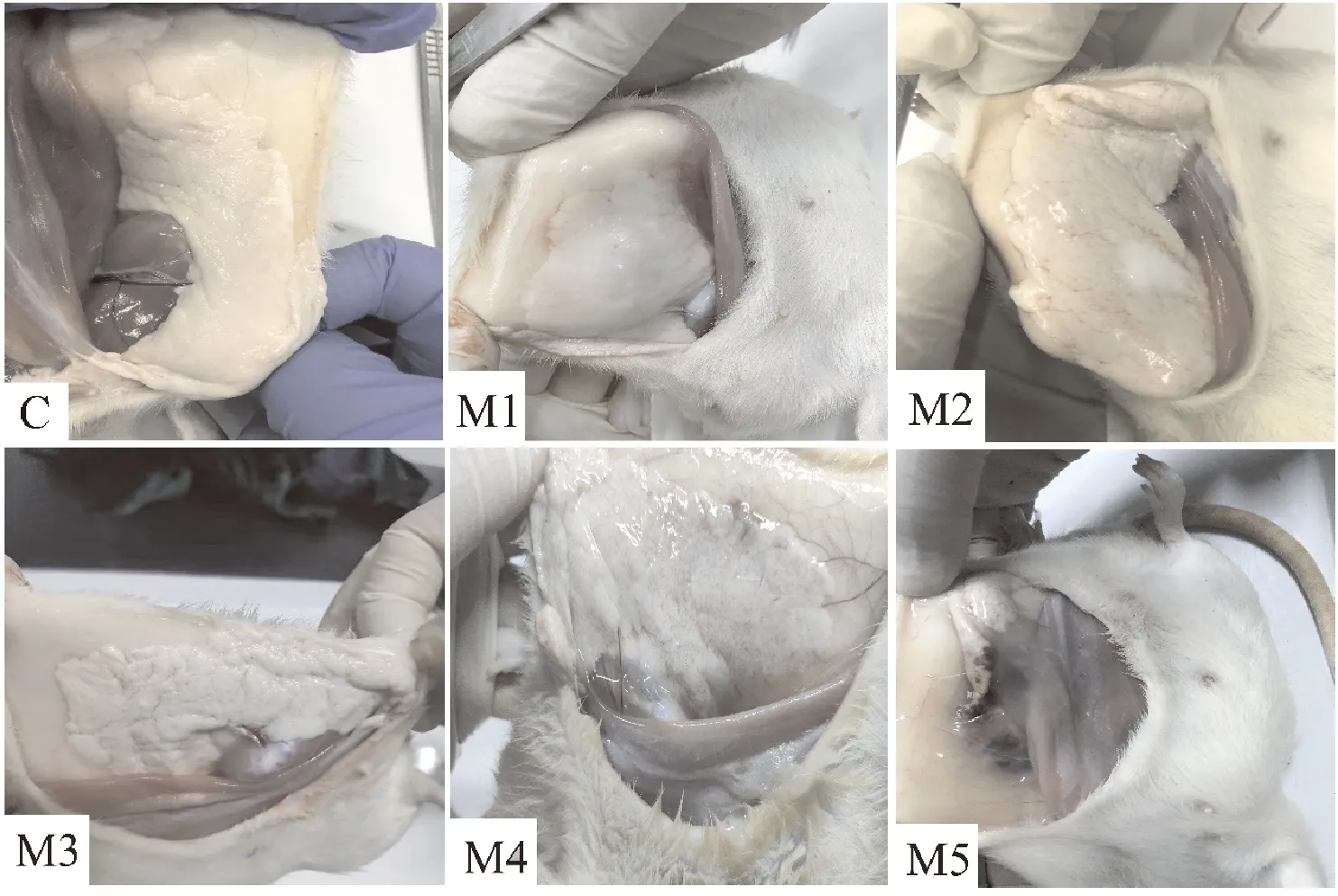
C.空白对照组;M1.2×105CFU/mL;M2.2×106CFU/mL;M3.2×107CFU/mL;M4.2×108CFU/mL;M5.2×109 CFU/mL
2.2 乳腺组织病理组织切片
C组乳腺组织结构清晰,乳腺腺泡结构完整,各个小叶之间的间隙小,腺泡腔饱满且乳汁充盈,扁平状的乳腺上皮细胞细胞核染色呈蓝色,依次排列在腺泡外侧;M1组乳腺小叶结构清晰,小叶间隙相比C组有所增宽,个别上皮细胞脱落进入腺泡内;M2组偶见粉色渗出,腺泡之间界限略微增宽,腺泡结构比较清晰,腺泡腔内出现少量脱落的上皮细胞、中性粒细胞及淋巴细胞;M3组腺泡结构相比M2组不完整,腺泡间隙出现明显的渗出液,腺泡腔内的炎性细胞相比M2组明显增多,少部分的上皮细胞体积增大,并出现少量细胞坏死脱落,乳汁减少;M4组乳腺小叶结构仍能辨认,可见腺泡间隙内有渗出及出血点,乳腺上皮细胞排列疏松,乳汁减少,腺泡腔内明显可见一定数量的炎性细胞浸润,如中性粒细胞、淋巴细胞;M5组腺泡结构破坏严重,无法辨认腺泡界限,上皮细胞明显肿胀,细胞核变大,大量细胞坏死脱落,结缔组织内出现大量渗出的乳汁及红细胞,腺泡腔内相比M3和M4组出现大量浸润的炎性细胞(图2)。
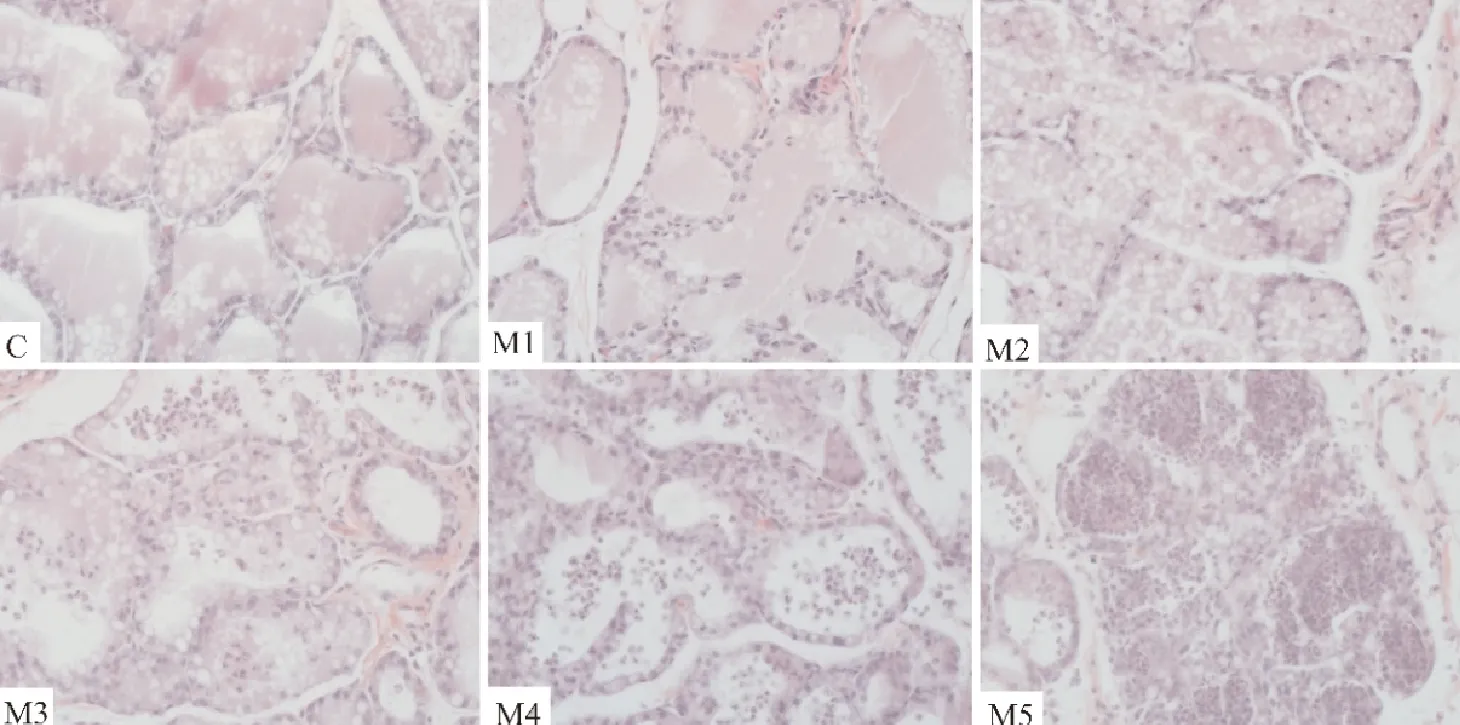
C.空白对照组;M1.2×105CFU/mL;M2.2×106CFU/mL;M3.2×107CFU/mL;M4.2×108CFU/mL;M5.2×109 CFU/mL
2.3 细菌计数
与对照组相比,M1组有显著差异(P<0.05),其余各组均有极显著差异(P<0.01);各组间比较,M1组与M2组差异不显著(P>0.05),M2组与M3组差异显著(P<0.05),M3、M4、M5组之间差异极显著(P<0.01)(图3)。
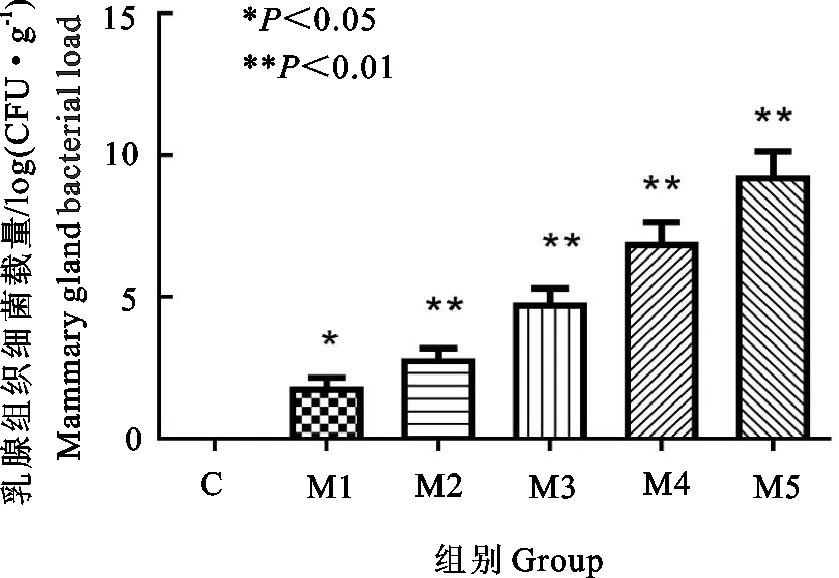
图3 乳腺组织细菌计数
2.4 血常规
白细胞数量空白组与M1及M2组相比差异不显著(P>0.05),M3、M4、M5组与空白组相比显著或极显著增高(P<0.05或P<0.01);中性粒细胞方面,M1及M2组与空白对照组相比差异不显著(P>0.05),M3、M4、M5组与空白组相比极显著增高(P<0.01);血小板方面,M3组显著高于对照组(P<0.05),M4、M5组极显著高于对照组(P<0.01)(表1)。
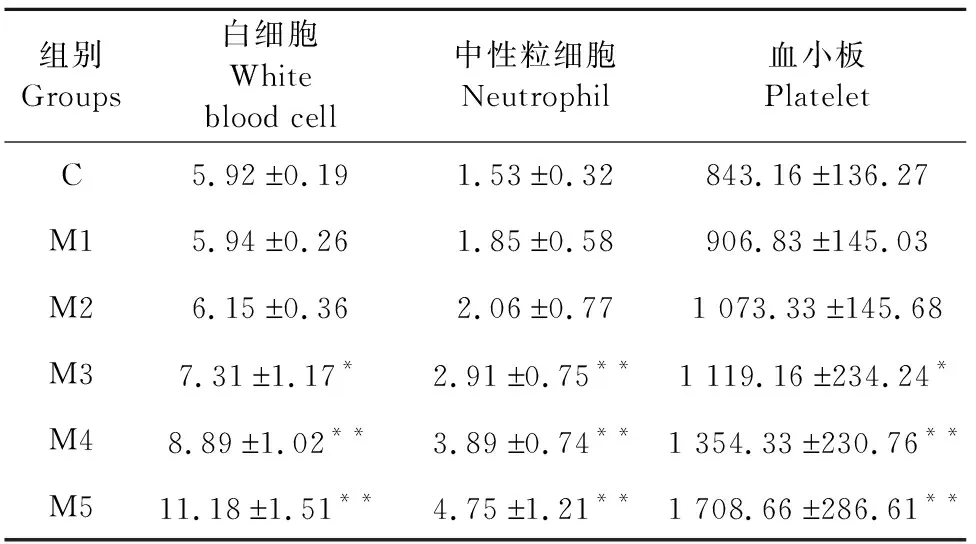
表1 各组血细胞的数量变化
2.5 乳腺组织中相关炎症因子的含量变化
在IL-1β方面,与对照组相比,M1、M2组无显著差异(P>0.05),M3组显著提高(P<0.05),M4、M5组极显著提高(P<0.01);IL-6方面,与对照组相比,M1组差异不显著(P>0.05),M2、M3、M4、M5组均有极显著增高(P<0.01);TNF-α方面,与对照组相比,M1、M2组无显著差异(P>0.05),M3、M4、M5组均有极显著增高(P<0.01)(表2)。
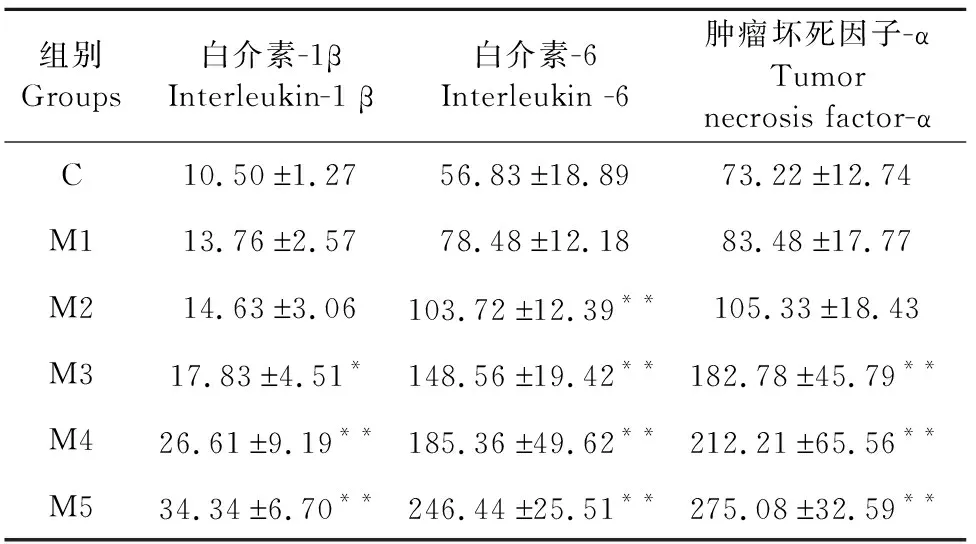
表2 乳腺组织中相关炎症因子的含量变化
2.6 各组乳腺组织中TLR2、P-P65蛋白的表达
由图4可知,与C组对照组相比,M1、M2组乳腺组织中TLR2及p-p65的蛋白表达无显著差异(P>0.05),TLR2蛋白表达方面,M3、M4、M5组与C组相比极显著升高(P<0.01),p-p65蛋白表达方面,与C组相比,M3组显著升高(P<0.05),M4、M5组极显著升高(P<0.01)。
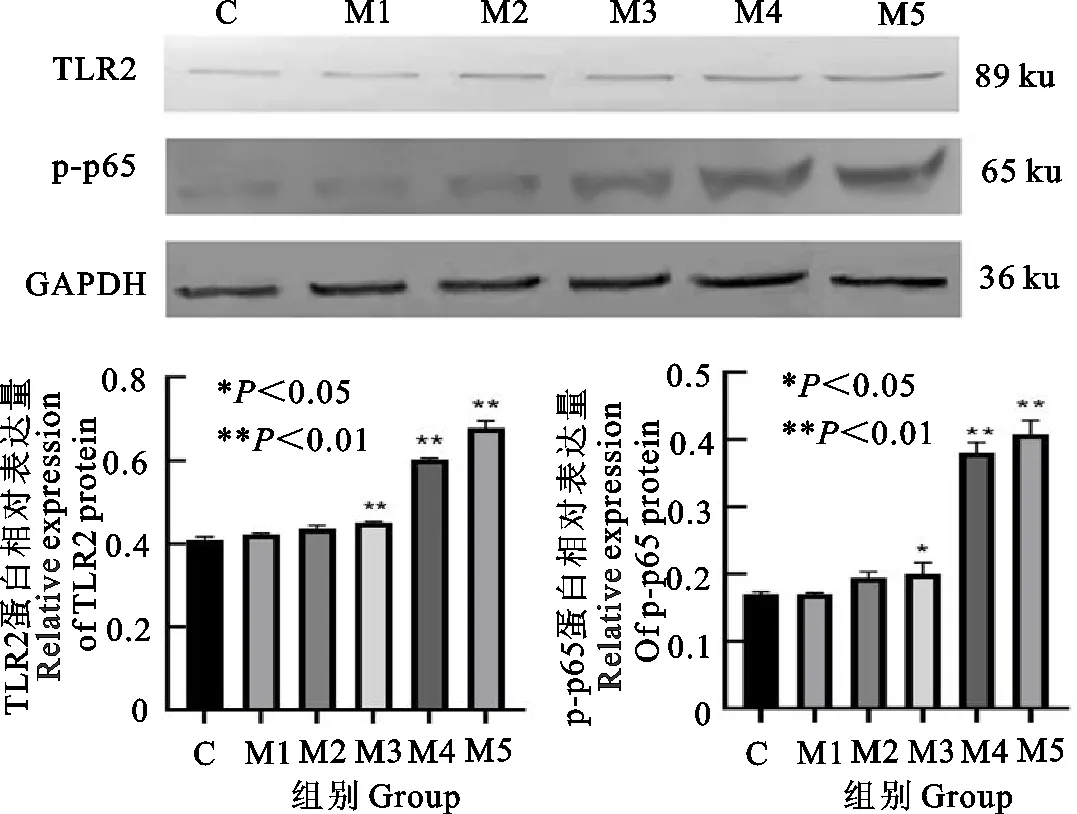
图4 各组乳腺组织TLR2和p-p65的蛋白表达水平
3 讨论
金黄色葡萄球菌作为奶牛乳房炎最常见的病原菌之一,一直被研究人员广泛关注[8],有学者利用不同剂量的脂多糖(lipopolysaccharide,LPS)成功建立了大鼠乳腺炎模型[9],LPS已成为商品化、质量稳定的内毒素,而引起奶牛乳房炎的细菌为具有完整细菌结构,从临床患有乳房炎的病牛身上分离更具有说服力,所以本试验选用从患有乳房炎的病牛乳汁中分离得到的金黄色葡萄球菌进行大鼠乳腺炎的造模。本试验采用微量注射器直接通过乳头管将菌液注入乳池,以模拟自然发病状态,设置金黄色葡萄球菌2×105、2×106、2×107、2×108、2×109CFU/mL的5个浓度,以确定造成大鼠乳腺炎的最佳造模浓度。
大鼠在注菌后24 h处死,期间的临床症状及剖检腹部后的眼观病理变化显示,与C组相比,灌注金黄色葡萄球菌后24 h,各试验组大鼠均发生了不同程度的炎症反应,其中,M5组出现2只死亡,HE染色观察组织病理变化发现,各试验组乳腺组织充血、出血、炎性细胞浸润以及乳腺上皮细胞坏死脱落和腺泡结构完整性出现不同程度的破坏,且破坏水平随着金黄色葡萄球菌灌注浓度的增加而逐渐严重,大量乳腺上皮细胞破坏直接使泌乳能力降低,这与张宝君等[10]报道的随着注菌数的增加,小鼠的乳腺组织病变逐渐加重的结果相一致;乳腺组织中的细菌数可以直接反映出乳腺的感染程度[11]。高瑞娟研究发现,注菌剂量越高,小鼠乳腺中菌落数越高。刘萍等[12]研究发现,试验组小鼠乳腺组织中的细菌数与注射金黄色葡萄球菌浓度呈正比,与炎症的严重程度也呈正比,本试验所得结论与他们的结论相一致。
大鼠乳腺注入金黄色葡萄球菌后,乳腺局部会发生炎症反应,机体为了防御细菌的侵入白细胞会从骨髓中被释放入血[13],数量增多,中性粒细胞作为机体非特异性免疫的先锋部队,具有游走和吞噬能力,在炎症早期发挥作用[14]。张军[15]研究发现,注入金黄色葡萄球菌后的大鼠血液中白细胞以及中性粒细胞数量显著增高(P<0.05),本试验结果与之相一致。Yeaman M R[16]研究发现,血小板不仅能影响血栓形成以及内环境稳定,而且还能在炎症过程中发挥重要作用,炎症会使血小板体积增大,数量增多,同时血小板可以表达多种趋化因子和细胞因子,在本试验中,注菌浓度越高血小板数量越多,其中M4、M5组相比对照组极显著增高(P<0.01),这与Yeaman M R的研究结果相一致。
乳腺发生炎症会导致中性粒细胞、单核巨噬细胞等炎性细胞增多,而炎性细胞会根据炎症的轻重释放少量或多量的细胞因子,比如IL-1β、IL-6、TNF-α就是典型的促炎细胞因子,IL-1β可以由多种细胞产生,过量产生在损伤乳腺组织的同时,会使小吞噬细胞向乳腺组织浸润[17]。IL-6由急性炎症期的中性粒细胞产生,TNF-α由巨噬细胞产生,它们在乳腺组织中的含量可以反映炎症发生的程度,这些细胞因子大量的释放,可以起到清除病原体的作用,但同时会引起一系列级联反应,导致炎症的发生[18]。李炎燚[19]研究发现,随着用药浓度的增高,由金黄色葡萄球菌引起的大鼠乳腺炎乳腺中的IL-1β、TNF-α显著减少,有效缓解炎症。Wesson C等[20]研究发现,金黄色葡萄球菌感染乳腺组织及乳腺细胞时,IL-1β、IL-6、TNF-α等炎性细胞因子分泌显著增加。本试验研究发现,随着造模浓度的增加,IL-1β、IL-6、TNF-α在乳腺组织中的含量与金黄色葡萄球菌浓度呈正比,IL-1β含量在金黄色葡萄球菌浓度达到2×107CFU/mL时显著升高(P<0.05),而当浓度到达2×108CFU/mL之后出现极显著升高(P<0.01),IL-6的含量在金黄色葡萄球菌浓度达到2×106CFU/mL时就表现出极显著升高(P<0.01),TNF-α含量在浓度达到2×107CFU/mL时呈现极显著增高(P<0.01),各细胞因子含量随金黄色葡萄球菌浓度升高而升高,这与李炎燚及Wesson C等的研究结果相一致。
Toll样受体(Toll-like receptors,TLRs)在天然免疫及炎症反应过程中起着重要作用,TLRs信号的激活可以有效控制致病原的感染,但过度的表达同样会对机体造成损伤[21]。研究发现,革兰氏染色阳性菌及脂磷壁酸可以刺激TLR2的表达,同时它与乳腺炎及其他一些炎症的发生密切相关。NF-κB是一种转录因子,可以被多种刺激因素激活,从而引起炎症反应及免疫应答,它有2种亚基,分别是p50和p65,正常情况下它们与IκB组合成三聚体在胞质内,感染病原后,p65亚基发生磷酸化并进入细胞核引起相关炎症因子的转录。本研究发现,与对照组相比,TLR2蛋白表达水平在M3、M4、M5组时,出现极显著升高(P<0.01),这与刘明[22]关于金黄色葡萄球菌感染小鼠导致TLR2表达升高的结果相一致。p-p65的表达水平,M3组出现显著升高(P<0.05),M4、M5组则出现极显著升高(P<0.01),这与高雪娇[23]的研究结果相一致。
综合各试验组数据发现,当金黄色葡萄球菌含菌量在2×107CFU/mL及以下时,炎症反应较轻微或无炎症反应,而当含菌量为2×109CFU/mL时,炎症反应过于强烈,甚至出现死亡,此剂量不适合进行模型的建立,含菌量为2×108CFU/mL时,既能保证大鼠乳腺炎症反应的完整发生,又能不引起大鼠死亡,所以本次试验结果确立金黄色葡萄球菌引起乳腺炎的最佳含菌量为2×108CFU/mL。

