常染色体显性多囊肾合并肺栓塞一例并文献复习
蔡晓婷,易华华,林佳媛,陈 聆
(上海交通大学医学院附属瑞金医院a.呼吸与危重症医学科,上海交通大学医学院呼吸病研究所,上海市呼吸传染病应急防控与诊治重点实验室;b.药剂科,上海 200025)
肺栓塞(pulmonary thromboembolism,PTE)是来自静脉系统或右心的血栓阻塞肺动脉或其分支所致的以肺循环和呼吸功能障碍为主要临床和病理生理特征的疾病。PTE 与深静脉血栓(deep vein thrombosis,DVT)密切相关。任何可导致静脉血流淤滞、血管内皮损伤和血液高凝状态的因素均为静脉血栓形成(venous thromboembolism,VTE)的危险因素[1]。此外,VTE 还存在遗传性因素及制动、手术、肥胖、肿瘤、妊娠等获得性因素。常染色体显性多囊肾(autosomal dominant polycystic kidndy disease,ADPKD)是一种常染色体显性遗传病,患者除了表现为多囊肾,还可累及全身多个器官,表现为多囊肝(polycystic liver disease,PLD)、颅内动脉血管瘤等[2]。临床少见多囊肾、PLD 合并VTE 病例,且这些不常被认为是VTE 的病因。本研究报告1 例ADPKD 患者(存在PLD)合并PTE,并结合文献对其进行回顾性分析,旨在进一步探讨VTE 的少见病因及治疗。
资料与方法
一、资料
患者为男性,49 岁。因“胸痛、气促10 d”收治入本院呼吸与危重症科。患者既往有家族性多囊肾,表现为蛋白尿、肾功能不全,并有高血压病史,平时口服“厄贝沙坦、硝苯地平”。6 年前患者曾因头晕查头颅核磁共振示脑血管狭窄。患者职业为出租车司机。入院体检示,呼吸频率22 次/min,心率92 次/min,血压135/75 mmHg,吸空气指端氧饱和度95%;神清;两肺呼吸音粗,未及干湿啰音;双下肢无水肿,周径对称。入院后予完善实验室、影像等检查。
二、方法
1.CT 检查:仪器采用佳能Aquilion PRIME TSX-303A;扫描参数为,层厚5.0 mm,螺距0.6 mm,单球管扫描,管电压120 kV,管电流300 mA。对比剂采用典迈伦,浓度400 mg I/mL,注射量70~80 mL,患者注射速率为2 mL/s。注射对比剂后50 s 行扫描。
2.MRI 检查:仪器采用通用GE SIGNA Architect-70 cm;扫描参数为,层厚7.0 mm,层间距2.0 mm;扫描序列分别为T1 加权和T2 加权、弥散加权成像、压脂共4 种序列,根据病灶的形态学不同分别扫描斜位、矢状位、冠状位3 个面。对比剂采用马根维显,分别扫描动脉期、静脉期和延迟期。
3.超声检查:血管超声采用Mindray M7;心脏超声采用:GE-Vivid E90;探头频率为3.5~10 MHz。
4.DNA 测序:经本例患者知情同意,采集其静脉血4 mL,置于含乙二胺四乙酸抗凝试管中,用Bestseq 靶向捕获技术进行全外显子测序 (该步骤由北京康旭医学检验所开展)。
5.文献复习:在Pubmed 数据库中,以“thrombosis”与“polycystic kidney disease”、“thrombosis”与“polycystic liver”作为关键词分别联合搜索,截至2022 年1 月1 日共检索到相关文献6 篇,共15 例患者。通过万方数据库对中文文献进行检索,检索词为“栓塞”与“多囊肾”和“栓塞”与“多囊肝”分别检索,截至2022 年1 月1 日共检索到相关文献0 篇。资料收集采用Excel 表格登记,计数资料采用百分比表示,连续变量如年龄、病程等采用算数均数表示。
结 果
一、本例患者诊治
1.实验室检查:本例患者纤维蛋白降解产物(fibrinogen degradation products,FDP)40.94 μg/mL,D-D 二聚体5.99 μg/mL,动脉血气分析(吸空气):pH 值为7.3,动脉氧分压为10.8 kpa,动脉二氧化碳分压为3.89 kPa,氧饱和度为99%。肌酐420 μmol/L,尿常规白细胞(+),蛋白质(++)。血管性血友病因子252.3%↑,凝血因子Ⅴ活性、凝血因子Ⅹ活性、蛋白C 活性、蛋白S 活性、狼疮抗凝物、α 纤溶酶抑制物、抗凝血酶抗原正常。消化道、泌尿道、呼吸道肿瘤指标正常。免疫球蛋白IgG 1 720 mg/mL↑,IgA、IgM、IgE、IgG4 正常,抗环瓜氨酸肽抗体、补体C3、C4、CH50、类风湿因子、抗链球菌溶血素O、抗心磷脂抗体、抗肾小球基底膜抗体、抗中性粒细胞细胞质抗体、抗双链DNA 抗体阴性。
2.影像学及基因检查:因患者肾小球滤过率为14 mL/min,行肺动脉增强CT 检查存在肾衰竭风险,故行胸部CT 平扫显示,右下肺小斑片影(见图1);肺通气(见图2)、肺灌注(见图3、4),右肺上叶前段及尖段局部、中叶各段、下叶各基底段和左肺上叶前段局部、上舌段、下舌段、下叶前基底段通气显像与灌注显像不匹配,考虑为PTE;下肢深静脉显像(见图5)示双侧下肢深静脉不完全梗阻可能。下肢静脉血管超声提示双侧下肢DVT 形成。腹部MRI 增强扫描(见图6)提示,下腔静脉肝段狭窄,多发肝囊肿伴多囊肾。全外显子检测显示患者PKD1 基因c.12674A>C(p.Gln4225Pro)杂合变异;PROS1 基因c.1159C>T(p.Arg387Cys)杂合变异(见图7)。
图1 胸部CT 平扫显示肺实质未见异常(2019 年8 月12 日)
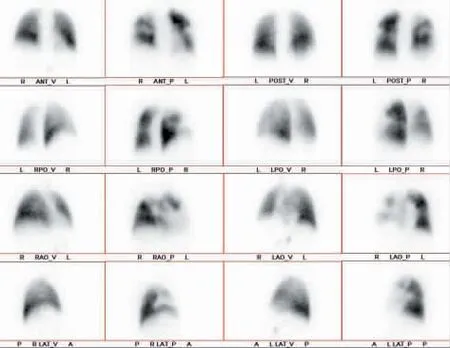
图2 肺通气显像(2019 年9 月5 日)

图3 肺灌注显像(2019 年9 月5 日)

图4 肺通气灌注显像

图5 下肢深静脉显像显示双侧下肢深静脉不完全梗阻可能(2019 年9 月5 日)
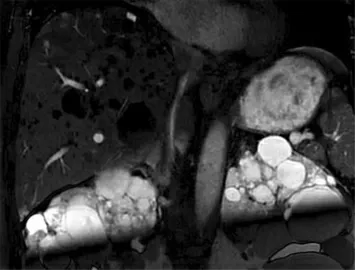
图6 腹部MRI 增强显示下腔静脉肝段狭窄、多发肝囊肿伴多囊肾

图7 全外显子测序结果
3.治疗及转归:患者肌酐清除率<30 mL/min,故先予普通肝素抗凝,然后根据活化部分促凝血酶原激酶时间(activated partial thromboplastin time,APTT)调整剂量,达到正常值1.5 倍后,桥接华法林。治疗后2 周后患者咳嗽、气促、胸痛明显缓解,测D-D 二聚体0.3 μg/mL,INR 为2,下肢静脉超声提示双侧下肢股、腘静脉通畅。本例患者经过肝素桥接华法林抗凝,随访至2021 年8 月,肺栓塞相关症状恢复良好,2021 年8 月因脑血管意外死亡。
二、文献复习
文献检索到ADPKD 合并VTE 患者共计15 例,临床特征见表1。其中女性多见,年龄35~76 岁;合并下腔静脉血栓(15 例)和DVT(12 例)多见,肝静脉血栓(2 例)及PTE(2 例)少见。患者常见的症状和体征分别为下肢肿胀(80%)、腹痛或腹部不适(64.3%)、胸痛(26%)。本院收治的该例ADPKD 合并患者表现为胸痛、气促。所有患者的FDP(10~25 μg/mL)及D-D 二聚体(1.4~3.9 mg/L)均有不同程度升高,蛋白C 及蛋白S 水平正常。本院收治的该例患者凝血功能符合上述特点。
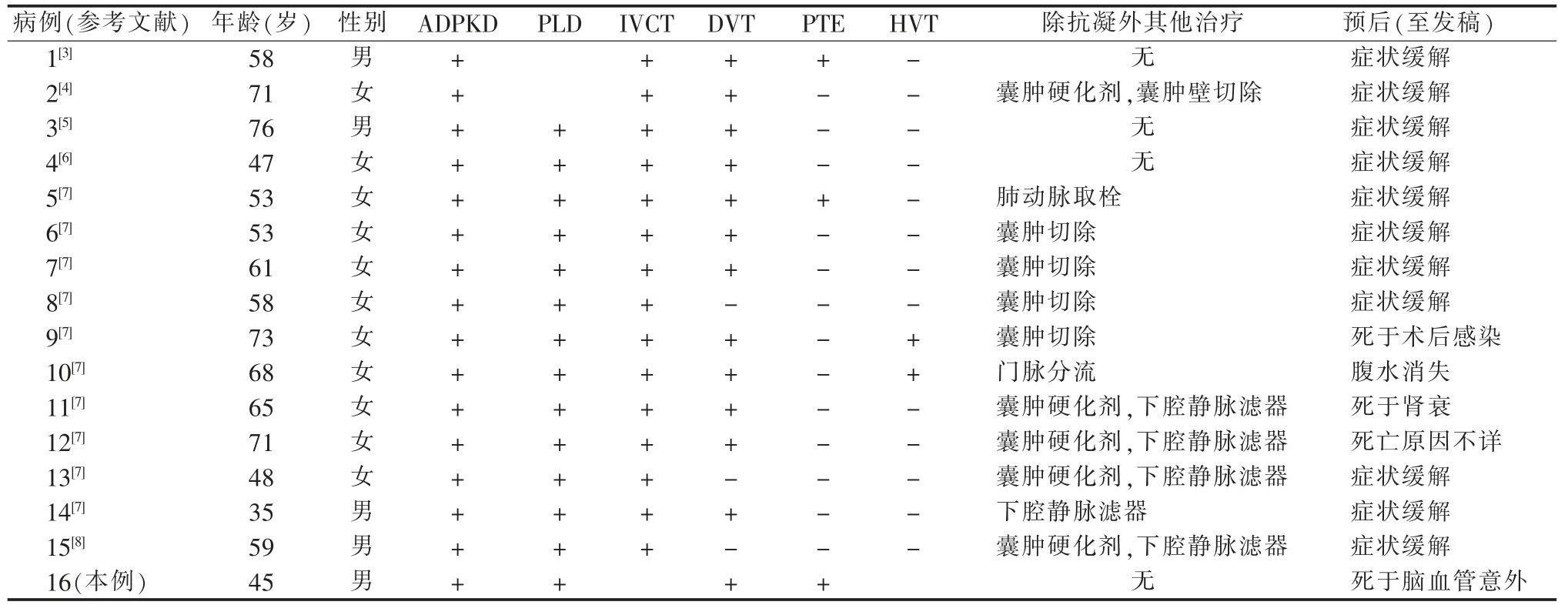
表1 16 例多囊肾或多囊肝合并静脉血栓患者临床特征
文献中15 例患者从栓塞相关症状出现到最终确诊时间平均为18.9 d。本院收治的该例患者从胸痛、气促症状出现到最终确诊之间为12 d。文献收集的15 例患者均接受了低分子肝素桥接华法林抗凝治疗后,其中11 例(86%)的症状缓解。5 例(28%)患者接受对造成下腔静脉压迫的囊肿注射99.5%酒精硬化剂治疗及下腔静脉滤器植入,其中1 例2 个月后双下肢水肿再发,硬化治疗过的囊肿,再次增大,经手术切除病变囊肿壁后,未再复发;1 例经门脉分流后腹水消失;其余3 例死亡。1 例PTE 患者经肺动脉取栓术后,PTE 未复发。
讨 论
ADPKD 是多系统疾病,特征为双肾囊肿及其他器官囊肿,例如肝、胰腺、蛛网膜等。该病是最常见的先天肾疾病,发病率为1/400~1/1 000,同时也是导致终末期肾病常见原因,大约50%的患者在60 岁发展至终末肾病。ADPKD 患者多合并PLD,但PLD症状隐匿,包括由于增大的囊肿导致的腹胀、腹痛及腹水,诊断多依靠MRI。PKD1 基因是ADPKDⅠ型的致病基因,该患者检测发现PKD1 基因突变,结合家族史,ADPKD 诊断成立。
一、ADPKD 患者发生VTE 的诱因
1.压迫:既往认为,ADPKD 及PLD 并不是VTE的常见危险因素。但综合笔者检索得数篇文献中的病例均没有原发凝血功能障碍及其他手术、创伤、药物等栓塞风险,文献作者均推测其栓塞原因可能由于增大的肾囊肿或肝囊肿对下腔静脉压迫。本例患者腹部MRI 亦提示下腔静脉肝段受压狭窄,这可能导致血流淤滞。
2.原发疾病导致高凝状态:本例患者因ADPKD继发慢性肾病综合征,表现为肾功能不全及蛋白尿。慢性肾病与高凝及血小板功能障碍相关[9],可导致动脉心血管系统疾病风险增加[10]。尽管动静脉疾病有共同的发生机制[11],但肾病与VTE、PE 相关的数据很少。目前只有5 项研究探讨了肾病患者的VTE 风险[12],这些研究发现中度肾病、肾小球滤过率轻度下降与VTE 风险相关,终末期肾病透析患者的VTE 风险增加到134%,住院慢性肾病患者的PE风险增加39%、DVT 风险增加72%[13]。但本例患者并未发现凝血因子活性、α 纤溶酶抑制物、抗凝血酶抗原等凝血因素异常,且缺乏其起病前的凝血指标检测结果,不能明确其是否存在肾病相关高凝状态。
3.存在相关易栓症遗传学因素:PTE 的遗传性危险因素包括蛋白C 缺乏、蛋白S 缺乏、抗凝血酶缺乏等。蛋白S 是一种维生素K 依赖的糖蛋白,其为活化蛋白C 的辅因子,在血浆中40%呈游离状态,60%为结合状态的复合物,辅助活性很低。蛋白S 基因分为具有转录活性的蛋白S 基因(PROS1)和不具有转录活性的“假基因”[14]。PROS1 基因是导致蛋白质S 缺乏而致易栓症的基因,为常染色体隐性遗传。多项研究表明,蛋白C、蛋白S 基因突变可导致其抗原含量和(或)活性不同类型的缺乏,是DVT 及PTE 的重要危险因素[15]。本例患者虽然存在PROS1突变,但为杂合子突变,未影响蛋白合成,故蛋白S水平正常,且有报道称,蛋白C 或蛋白S 基因突变单一因素致病率较低,但如同时存在继发性血栓危险因素,会使DVT 患者的PTE 发病率明显升高[16]。血栓继发的凝血系统异常多表现为AT-Ⅲ活性下降,FDP 升高,高纤维蛋白原血症,血小板减少。本例患者及文献复习中患者均未发现狼疮抗凝物、蛋白S、蛋白C 异常。
综上所述,本例患者基础疾病为ADPKD(存在PLD),继发肾功能不全,有驾驶长期久坐制动因素,以咳嗽,胸痛气促为主要表现,通过肺通气灌注扫描及下肢深静脉显像确诊“PTE 合并下肢DVT”。检查排除了原发性凝血功能异常、肿瘤等其他血栓高危因素。肝脏MRI 增强提示下腔静脉肝段狭窄,PTE 发生原因首先考虑肿大的肝囊肿压迫下腔静脉肝段以及职业相关制动,2 种因素协同作用导致血流淤滞,导致肺动脉血栓形成。因患者不考虑介入治疗肝囊肿及更换司机工作,血栓高危因素持续存在,且肌酐清除率<15 mL/min,故建议终身行华法林抗凝治疗[17]。
二、治疗及预防
AKPDK 合并PTE 的内科治疗仍以抗凝为基础[17],抗凝药物选择需考虑肌酐清除率影响,避免加重原有肾功能不全。抗凝疗程取决于静脉梗阻等引起血栓的诱因是否清除。介入治疗的目的在缓解囊肿压迫相关的静脉梗阻。若梗阻由孤立的大囊肿导致,直接减少囊肿压迫是较为直接的方法,若没有肝静脉或肾静脉栓塞,可采取超声引导下囊肿硬化,95%酒精注射硬化治疗有效率可达90%[18]。微创引流也不失为简单囊肿的另一种减压选择[19]。若肝静脉流出道梗阻由多发肿大囊肿导致,且没有主要囊肿,联合肝切除和囊肿开窗引流是唯一选择。若存在肝静脉栓塞,则应考虑非选择性门脉分流[20]或进行肝移植。

