水稻地方品种不同品系对田间稻瘟病菌群体遗传多样性的影响
李海伦 魏环宇 杨伟 李成云 刘永胜 王云月 王扬 谢勇

摘要 ‘月亮谷是云南元陽梯田种植面积最大的地方籼稻品种,种植历史逾百年仍保持对稻瘟菌较稳定的田间抗性,我们猜测其原因与‘月亮谷-稻瘟菌的群体互作有关。为此,本研究采用群体遗传学研究方法,利用稻瘟菌16 对 SSR 引物,对从‘月亮谷不同单粒传纯系、‘月亮谷自然群体、现代品种‘合系 22-2及云南元阳哈尼梯田环境中分离到的稻瘟菌进行遗传多样性分析,以了解不同‘月亮谷纯系对稻瘟菌群体遗传结构的影响。结果显示,来源于梯田环境的稻瘟菌与不同水稻品种(系)的稻瘟菌群体遗传结构差异明显,梯田环境:Ht=0.160 3,I=0.323 8;水稻寄主群体:Ht=0.092 9,I=0.200 9。而且,分离自不同水稻品种(系)的稻瘟菌群体遗传结构差异也较大,Shannons 遗传多样性指数、Nei 基因多样性指数和 PIC 的总体趋势是:‘月亮谷感病纯系(L4、L3)>‘月亮谷自然群体(G5)> ‘月亮谷抗病纯系(L1、L2)>‘合系 22-2(H6)。基于 neighbor-joining 的聚类分析发现,从环境(Y)中挑选的 30 株稻瘟菌和 6 个不同水稻寄主材料上分离到的稻瘟菌群体在相同相似系数下的遗传宗谱的数量变化趋势为:Y>L4>G5>L3>L1>L2>H6,说明现代品种对田间稻瘟菌群体产生的选择压力最大。水稻地方品种的抗病纯系群体对环境中稻瘟菌群体也产生了与现代抗性品种相类似的正向选择作用,而感病纯系和自然群体有利于稻瘟菌群体的稳定性选择。
关键词 水稻地方品种;单粒传;稻瘟病菌;群体遗传;定向选择
中图分类号: S435.111.41
文献标识码: A
DOI: 10.16688/j.zwbh.2021194
Abstract ‘Acuce, an indica landrace with the largest planting area in Yuanyang terrace of Yunnan province, has been planted for more than a hundred years and still maintain relatively stable resistance to Magnaporthe oryzae in the field. We hypothesized that this phenomenon might be related with the population interaction between ‘Acuce and M.oryzae. In order to understand the effects of ‘Acuce SSD lines on population genetic structure of M.oryzae, the genetic diversity of M.oryzae isolated from air in Hani terrace environment, ‘Acuce SSD lines, ‘Acuce natural population and modern variety ‘Hexi 22-2 were analyzed using 16 pairs of SSR primers based on population genetic methodology. The results showed that the genetic structure of M.oryzae population from terraced field environment was significantly different from that from different rice varieties (lines): for the isolates from terraced field environment, Ht=0.160 3, I=0.323 8, and for the isolates from rice host population, Ht=0.092 9, I=0.200 9. Moreover, the population genetic structure of M.oryzae was also significantly different among different rice varieties (lines). The general trend of Shannons genetic diversity index, Nei gene diversity index and PIC from high to low were as followed: susceptible line (L4, L3), natural population (G5), resistant line (L1, L2), and ‘Hexi 22-2 (H6). Based on the neighbor-joining clustering analysis, it was observed that the quantitative variation trend of genetic genealogy of 30 M.oryzae populations selected from the environment (Y) and six different rice host materials under the same similarity coefficient from high to low was as followed: Y, L4, G5, L3, L1, L2, and H6, which indicated that modern varieties had the greatest selection pressure on M.oryzae populations in the field. Similarly, the resistant SSD line also imposed positive selection on the population of M.oryzae, while the susceptible SSD line and natural population were conducive to the stable selection of M.oryzae population.1B464F7B-5FE0-4E50-B08C-3B7275142D42
Key words rice landrace;single seed descent;Magnaporthe oryzae;population genetic;directional selection
稻瘟病是全球危害最大、流行最广的水稻真菌病害之一,严重威胁水稻的生产[1-2]。稻瘟菌Magnaporthe oryzae为异宗配合的子囊菌,生理小种组成复杂,致病性变异频繁,常导致培育出来的抗病品种在大面积推广 3~5 年后就逐渐丧失抗性[3]。而在云南省元阳县哈尼梯田的传统地方水稻品种‘月亮谷已有上百年的种植历史,但尚未有稻瘟病大发生的记载[4]。
稻瘟病发生取决于水稻寄主抗病基因与稻瘟菌致病相关基因的互作。有关稻瘟菌抗病基因和稻瘟菌无毒基因的研究近年来取得了较大的进展。目前已命名的水稻稻瘟病抗病基因100余个,其中24个已被克隆[5-6]。除Pi-d2 外,已克隆的抗病基因大多为具有核苷酸结合位点和富含亮氨酸重复区的NB-LRR类基因。此外,绝大部分为显性基因,少数为隐性基因,如pi21。pi21属于数量抗性基因(QTLs),不能像其他NB-LRR 基因一样引起水稻的完全抗性,即过敏性坏死反应,但能限制病斑的扩展[7]。目前已定位的稻瘟菌无毒基因约有40个,其中已经克隆的至少有9个[8-11]。已有研究表明,水稻-稻瘟菌符合基因对基因互作模式[12],如Pita-AvrPita。随着稻瘟病病害研究的深入,尤其是功能基因组研究的深入,水稻-稻瘟菌已经成为重要的植物病害研究模式[13]。
在生产中,稻瘟病的发生流行与水稻寄主品种-稻瘟菌的群体互作密切相关。然而,有关水稻地方品种遗传背景较一致的品种(系)与稻瘟病菌群体的互作规律还鲜有报道。一般经典群体遗传学理论认为,寄主对病原菌的选择分为正向选择(positive selection)和负向选择(negative selection),即定向选择(directional selection)以及平衡选择(balancing selection)[14-15]。在元阳梯田环境中是否存在这种明显的选择作用,以及不同基因型的‘月亮谷纯系对稻瘟菌群体产生选择作用的规律目前未见报道。
因此,本研究对采自元阳哈尼梯田环境和‘月亮谷单粒传(single seed descent,SSD)純系上分离到的稻瘟菌群体进行遗传多样性分析,比较其群体遗传结构。目的是探明不同基因型水稻品系对稻瘟病菌群体的选择方式,进而探索部分水稻地方品种持久种植的内在原因。
1 材料与方法
1.1 供试材料
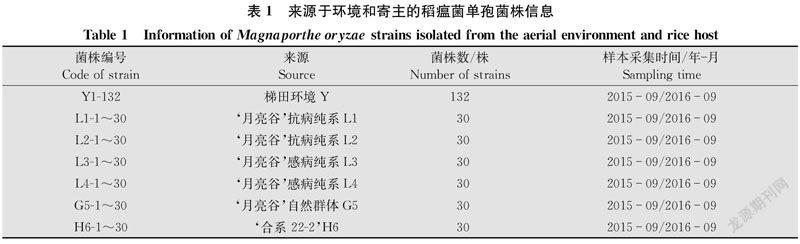
供试水稻品种(系)共6个。‘月亮谷Oryza sativa ssp. indica自然群体G5来源于元阳哈尼梯田农户自留种;‘月亮谷F8代单粒传纯系L1、L2、L3、L4由农户自留种G5经8代单粒传(SSD)获得,经人工接种稻瘟病菌抗性评价,L1、L2抗病,L3、L4感病;现代水稻品种‘合系22-2 (云南省农业科学院选育,常规粳稻,母本‘喜峰,父本‘楚粳4号)。
1.2 方法
1.2.1 田间试验设计
供试的6个水稻品种(系)分别于2015年和2016年的5月-10月种植于元阳哈尼梯田(元阳县箐口村),按当地常规育苗方法育苗、移栽。每品种(系)1个处理,3次重复,每小区30 m2,完全随机区组排列。四周保护行种植‘月亮谷自然群体。所有施肥、水分管理均为当地传统方法,生长期间不喷施杀菌剂。
1.2.2 稻瘟菌的分离
1.2.2.1 水稻寄主上稻瘟菌的分离
2015年-2016年,连续2年在稻瘟病发生期(9 月)从田间随机采集6个水稻品种(系)的穗颈瘟样本(30个/品系),采用毛细管打孔单孢分离法进行单孢分离获得寄主菌株[16]。
1.2.2.2 梯田环境中稻瘟菌的分离
采集穗颈瘟样本的同时,从梯田环境中捕捉稻瘟菌孢子。通过固定式孢子捕捉仪(YFBZ1,河南云飞科技发展有限公司),按照说明书于田间捕捉孢子,为期2周。具体方法为:在上述试验地中按五点取样的方式布置孢子捕捉仪,于晴天定时开机 5~8 h(夜间2:00-次日10:00),每3 d采集1次,共5次。每次采集结束后更换载玻片,将载玻片带回实验室用显微镜观察孢子数量,采用单孢分离法分离稻瘟菌获得环境菌株[17]。对分离到的稻瘟菌株根据来源不同进行统一编号(表1)。
1.2.3 稻瘟菌株的SSR遗传多样性分析
1.2.3.1 DNA的提取与PCR扩增
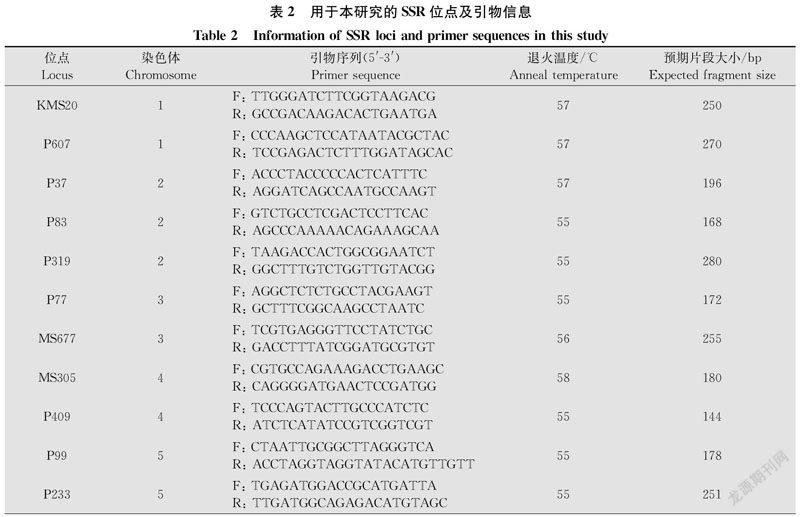
采用CTAB法提取稻瘟菌单孢菌株基因组DNA[18]。PCR反应的SSR引物经多态性筛选后确定,为平均分布在稻瘟菌7条染色体上的16对引物(表2)[19]。引物由北京硕擎生物技术服务有限公司合成。PCR反应体系为20 μL,包含2×master mix 10 μL、20 μmol/L引物各1 μL、DNA模板2 μL,ddH2O 6 μL。PCR反应程序为:94℃预变性 2.5 min;94℃变性40 s,退火温度(表2)下退火30 s,72℃延伸1 min,36个循环;最后72℃延伸10 min,4℃保存。PCR产物用6%聚丙烯酰胺变性胶电泳检测,并在凝胶成像系统下观察结果,采集图像。
1.2.3.2 数据的获取与分析
电泳中稳定清晰的扩增条带赋值为1,无带为0,构建二元数据矩阵。用POPGENE(version 1.32)软件计算多态带数AP和多态带百分率P、等位基因数Na、有效等位基因数Ne、Nei基因多样性指数Ht、Shannons遗传多样性指数I。聚类分析通过DAWwin 6.0 和MEGA 6软件在neighbor-joining算法下按非加权配对法(UPGMA)完成,聚类分析由Figtree1.4.2完成。1B464F7B-5FE0-4E50-B08C-3B7275142D42
2 结果与分析
2.1 稻瘟菌群体SSR遗传多样性分析
2.1.1 梯田环境中稻瘟菌群体SSR遗传多样性分析
利用16对SSR引物对梯田环境中捕获并分离到的132个稻瘟菌单孢菌株进行遗传多样性分析。扩增结果显示,稻瘟菌群体扩增产物大小在 100~500 bp内,与预期大小一致;16对SSR引物在梯田环境采集的132个单孢菌株中共检测到16个多态位点,多态位点百分率为100%,在16个多态位点上共扩增到43个等位基因。每个位点扩增到的等位基因数有较大差异,在2~4个之间。扩增到等位基因数最多的位点为P77,其扩增到4个等位基因。
遗传多样性水平最高的位点也为 P77(Ht=0.514 8,I=0.941 3)。平均有效等位基因数(Ne)为1.267 9,变幅为1.040 3~2.061 0。平均Shannons遗传多样性指数(I)为0.323 8,变幅为0.097 0~0.941 3。平均Nei基因多样性指数(Ht)为0.160 3,变幅为0.038 7~0.514 8(表3)。
2.1.2 寄主来源的稻瘟菌群体的SSR 遗传多样性分析
从6个水稻材料上分离到的稻瘟菌群体中分别挑选22个,共132个菌株构建一个群体,进行遗传多样性分析。结果显示,16对SSR引物从供试水稻品种上分离到的132个单孢菌株中共检测到16个多态位点,多态位点百分率为100%,在16个多态位点上共扩增到42个等位基因。每个位点扩增到的等位基因数有较大差异,在2~4个之间,扩增到等位基因数最多的位点为P77,共检测到4个等位基因;遗传多样性水平最高的引物为MS677(Ht=0.426 6,I=0.667 6)。平均有效等位基因数(Ne)为1.122 3,变幅为1.045 1~1.743 8。平均Shannons遗传多样性指数(I) 为 0.200 9,变幅为 0.105 9~0.667 6。平均 Nei 基因多样性指数(Ht)为 0.092 9,变幅为 0.043 1~0.426 6(表4)。
2.1.3 来源于梯田环境与水稻品种(系)的稻瘟菌群体间遗传多样性的比较
随机挑选30个不同来源的稻瘟菌株组成7个群体,对这些不同来源的稻瘟菌群体进行遗传多样性分析。结果显示,这些群体在16个SSR标记位点的多态位点数介于4(H6)~15(Y)个之间,各群体间的平均有效等位基因数、平均Shannons遗传多样性指数、平均Nei 基因多样性指数、平均期望杂合度、平均多态信息量、多态位点数差异较为明显,且梯田环境中的菌株群体各项指数明显高于水稻品种(系)上分离到的菌株群体。其中,群体间平均Nei基因多样性指数变化范围为0.042 8~0.246 3,平均为0.134 4;平均多态信息量变化范围为0.031 9~0.260 3,平均为 0.122 2。水稻品种(系)的稻瘟菌群体间总体趋势是感病纯系(L3、L4)和‘月亮谷自然群体(G5)的稻瘟菌多样性指数高于抗病纯系(L1、L2)和‘合系 22-2(H6)的稻瘟菌多样性指数(表5)。
以上结果显示,梯田环境和水稻寄主上的稻瘟菌群体遗传多样性指数差异较大,且环境中稻瘟菌群体的遗传多样性指数远远高于来源于水稻寄主上的群体,即环境中稻瘟菌群体经水稻寄主选择后,遗传多样性明显降低。
2.1.4 不同来源稻瘟菌群体的聚类分析
为比较不同来源稻瘟菌群体的遗传多样性,采用neighbor-joining建树方法,以UPGMA算法对2015年和2016年从6个寄主材料和梯田环境中分离到的30株(编号为1~30)稻瘟菌群体进行聚类分析和遗传结构比较,连续两年得到了类似的研究结果。从2016年采集菌株的聚类图可以看出(图1),在Jaccard系数0.1水平上,梯田环境中的菌株群体可以划分为18个不同的遗传谱系,菌株在各谱系分布均匀,不存在优势谱系;而6个寄主材料上分离到的稻瘟菌群体的遗传谱系差异较大,来自于各材料上的30个菌株可划分为8~15个谱系:L4:16,G5:14,L3:13,L1:12,L2:11,H6:8,各群体均存在一定比例的优势谱系。7个稻瘟病菌群体的遗传种群趋势为:Y>L4>G5>L3>L1>L2>H6。说明不同抗、感基因型寄主群体对稻瘟菌群体的选择压力各不相同且选择压力大小趋势为:H6>L2> L1>L3>G5>L4。从改良水稻品种‘合系 22-2(H6)上分离到的稻瘟菌群体遗传结构相对单一,且相似性水平较高,这表明其对稻瘟病菌群体的选择压力最大。
3 讨论
本研究選取的16对SSR标记分布在稻瘟菌的7条染色体上,能较全面地反映供试材料的遗传多样性和遗传背景。多样性指数分析的结果均表明梯田环境中稻瘟菌群体的遗传多样性水平远远高于水稻寄主材料上稻瘟菌群体的多样性。多态信息量(PIC)用于连锁分析时标记基因(标志序列)的多态性估计,现在常用来衡量座位多态性高低程度,本研究中梯田环境中菌株群体和寄主稻瘟病菌群体的 PIC均值分别为0.150 3和0.088 8,说明梯田环境中稻瘟菌株群体在测定的16个遗传位点上的多样性水平远远高于水稻寄主材料上分离到的稻瘟菌群体。从遗传进化的观点看,寄主与病原菌是一种“军备竞赛”(arm race)关系,这种协同进化(coevolution)使寄主的防卫系统与病原菌的致病因子形成一种动态关系。元阳哈尼梯田种植水稻的历史超过1 300多年,独特的水稻生产模式保持了数量较多的地方品种。据统计,在这特定区域中种植的地方品种约为 50个[20]。由于品种来源复杂,各品种内存在普遍的遗传异质性(intra-heterogeneity),且品种内个体间存在抗性差异[21-22]。 对‘月亮谷单粒传纯系接种稻瘟菌后0~48 h的转录组分析发现,抗/感纯系差异表达基因在数量和表达时序上均存在较大差异(结果另文发表),从群体遗传学与寄主-病原菌互作的角度看,这种品种内或品种间遗传异质性群体对稻瘟菌群体的选择方式与大面积栽培单一品种群体对稻瘟菌的选择方式应当存在较大差异。1B464F7B-5FE0-4E50-B08C-3B7275142D42
多年来,对稻瘟菌的群体遗传多样性研究已有较多的报道,但绝大多数研究的样本都是来源于水稻寄主,忽略了田间环境的情况,难以反映栽培环境中稻瘟菌群体的组成结构。而本研究从梯田环境分离稻瘟菌,目的是了解梯田生态环境中稻瘟菌的群体遗传组成,以利于定量描述不同基因型品种(系)对环境中稻瘟菌群体的选择压力。本研究结果表明,单一的抗性品种(系)会显著降低稻瘟菌群体的遗传多样性,有大量的不同基因型稻瘟菌会因寄主抗性的选择压力而被淘汰。因此,从水稻寄主上分离稻瘟菌仅仅能了解稻瘟菌群体中的一部分。
本研究通过比较来源于不同水稻品种(系)和环境中稻瘟菌群体遗传多样性,证明了现代品种对稻瘟菌群体产生了较大的选择压力,单一品种大面积种植必然会造成具有毒性的稻瘟菌小种群体数量上升,导致病害流行。本研究中,来源于合系品种 ‘合系22-2(H6)的稻瘟菌遗传多样性水平最低,是其对稻瘟菌群体的选择压力大的结果,这也可能是现代品种难以在哈尼梯田推广的一个原因。相反,传统地方品种‘月亮谷丰富的遗传多样性促进了稻瘟菌群体的稳定选择,并保持相对的动态平衡,这也许就是一些地方品种能够持续种植的内在原因之一。因此,‘月亮谷作为元阳梯田种植历史悠久的地方籼稻品种,中抗稻瘟病,其对栽培环境广泛的适应性和丰富的群体遗传多样性已经引起了很多学者的关注[4,20-23]。但‘月亮谷是否携带抗稻瘟病相关基因,尤其是广谱抗性基因及可能存在的抗病新位点仍值得深入研究。
参考文献
[1] DEAN R, KAN J, PRETORIUS Z A, et al. The top 10 fungal pathogens in molecular plant pathology [J]. Molecular Plant Pathology, 2012, 13(4): 414-430.
[2] OSS-RUIZ M, SAKULKOO W, MARTIN-URDIROZ M, et al. Two independent S-phase checkpoints regulate appressorium-mediated plant infection by the rice blast fungus Magnaporthe oryzae [J]. Proceedings of the national Academy of Sciences, 2017, 114(2): E237-E244.
[3] 李婷, 王建龙. 水稻稻瘟病抗性基因研究进展[J].作物研究, 2012, 26(6): 713-718.
[4] 夏欣, 陈平, 杨伟, 等. 水稻地方品种‘月亮谷纯系对田间稻瘟病菌的选择[J].植物保护, 2018, 44(4): 74-80.
[5] 马建, 马小定, 赵志超, 等. 水稻抗稻瘟病基因Pi35功能性分子标记的开发及其应用[J].作物学报, 2015, 41(12): 1779-1790.
[6] 何峰, 张浩, 刘金灵, 等. 水稻抗稻瘟病天然免疫机制及抗病育种新策略[J].遗传, 2014, 36(8): 756-765.
[7] ZHANG Yu, ZHAO Jianhua, LI Yali, et al. Transcriptome analysis highlights defense and signaling pathways mediated by rice pi21 gene with partial resistance to Magnaporthe oryzae [J/OL]. Frontiers in Plant Science, 2016, 7: 1834. DOI: 10.3389/fpls.2016.01834.
[8] LI Jinbin, LU Lin, JIA Yulin, et al. Effectiveness and durability of the rice Pi-ta gene in Yunnan province of China [J]. Phytopathology, 2014, 104(7): 762-768.
[9] 韓艺娟, 鲁国东. 水稻与稻瘟病菌相互作用研究进展[J].生物技术通报, 2018, 34(2): 25-37.
[10]柏斌, 吴俊, 周波, 等. 稻瘟病抗性分子育种研究综述[J].杂交水稻, 2012, 27(3): 5-9.
[11]田妍, 李承夏, 邢俊杰. 水稻稻瘟菌无毒基因研究进展[J].湖南农业大学学报(自然科学版), 2013(S1): 74-79.
[12]WANG Baohua, EBBOLE D J, WANG Zonghua. The arms race between Magnaporthe oryzae and rice: Diversity and interaction of Avr and R genes [J]. Journal of Integrative Agriculture, 2017, 16(12): 2746-2760.
[13]陈其国, 韦淑亚, 章萍. 水稻与稻瘟病菌互作的分子机制研究进展[J].中国稻米, 2018, 24(3): 62-65.
[14]VITTI J J, GROSSMAN S R, SABETI P C. Detecting natural selection in genomic data [J]. Annual Review of Genetics, 2013, 47(1): 97-120.
[15]MCCLELLAN D A. Directional Darwinian Selection in proteins [J/OL]. BMC Bioinformatics, 2013, 14(S13): S6. DOI: 10.1186/1471-2105-14-S13-S6.
[16]王英俊, 邱梅. 一种高通量真菌的分离方法: CN201210554055.8 [P]. 2014-06-25.
[17]谢勇, 徐返, 杨伟, 等. 一种简易有效的气传植物真菌病害孢子的单孢分离法: CN201610000854 [P]. 2016-03-23.
[18]刘丽, 张永军, 许长征, 等. 一种改良的CTAB法提取产多糖真菌DNA[J].中国生物工程杂志, 2014, 34(5): 75-79.
[19]ADREIT H, SANTOSO, ANDRIANTSIMIALONA D, et al. Microsatellite markers for population studies of the rice blast fungus, Magnaporthe grisea [J]. Molecular Ecology Notes, 2007, 7(4): 667-670.
[20]高东, 何霞红, 朱有勇. 元阳水稻地方品种多样性变化及换种规律研究[J].植物遗传资源学报, 2011, 12(2): 311-313.
[21]董超, 徐福荣, 杨文毅, 等. 云南元阳哈尼梯田水稻地方品种‘月亮谷的遗传变异分析[J].中国水稻科学, 2013, 27(2): 137-144.
[22]翟婉婉, 李雪萍, 徐返, 等. 云南水稻地方品种‘月亮谷的群体多样性分析[J].植物遗传资源学报, 2016, 17(3): 423-432.
[23]LIAO Jingjing, HUANG Huichuan, MEUSNIER I, et al. Pathogen effectors and plant immunity determine specialization of the blast fungus to rice subspecies [J/OL]. eLife, 2016, 5: e19377. DOI: 10.7554/eLife.19377.
(责任编辑:杨明丽)1B464F7B-5FE0-4E50-B08C-3B7275142D42

