蝉花抑菌抗氧化谱效关系的初步研究
王 惠,陈 康,郝雯雯,陈义昌,于瑞莲,林丽莎,韩烨枫
(南京中医药大学 药学院,江苏 南京210046)
蝉花是一种虫菌相依的组合体,是麦角菌科类真菌寄生在蝉类若虫上的子座及若虫的干燥复合体,属于生物病态现象[1],因其夏季成熟体头部有类花枝样物,故名蝉花。蝉花是一味传统中药材,性味甘寒,具散风热、定惊镇痉作用[2]。
现代大量研究证实蝉花含有多种活性物质,如多糖、核苷类、甾醇类、多球壳菌素、环肽类等物质[3]。这些成分具有抗氧化、抗肿瘤、提高机体免疫力、调节内分泌及治疗白血病等作用,也是一种良好的自由基清除剂或自由基反应抑制剂[4-7],分析蝉花的特定生物活性成分及药理作用对其进一步开发是非常必要的。
由于野生蝉花菌种和生长环境差异,使得其品质参差不齐,主要的活性成分不明。国家有明文规定,开发新药和食品等工业化产品时不得使用野生品种,使得人工蝉花的研究日益重要。与野生蝉花相比,人工培养的蝉花因全程无菌栽培,其中重金属含量和种类远低于野生蝉花,且孢子粉产量远高于野生蝉花,是一种应用前景广阔的药食新资源[8-9],见图1。然而,目前针对蝉花的研究大多是药理作用的传统验证研究[10-11],或仅仅研究蝉花的化学成分[12-13],将化学成分用色谱技术进行表征的“谱”与合适药理指标的“效”结合的还很少。本课题组前期研究发现,人工蝉花具有良好的治疗肠炎与肠道黏膜修复活性,因此,通过所在实验室制备的不同培养批次人工蝉花建立超高效液相指纹图谱,结合与抑制肠道炎症和黏膜修复活性有关的抑菌抗氧化药效指标进行灰色关联度分析,筛选活性成分,为蝉花药材的活性成分研究及开发提供参考。

图1 野生和人工蝉花的比较Fig.1 Comparison of the leaves of wild and artificial Isaria cicadae Miquel(Ic M)
1 材料与方法
1.1 材料与试剂
不同批次蝉花:作者所在实验室培养并鉴定为正品,信息见表1;蝉棒束孢菌:江苏句容野生蝉花经菌种纯化分离得到;金黄色葡萄球菌:江苏省无锡质检院馈赠;尿苷(批号:E2540025)、尿嘧啶(批号为:D4710010)、鸟苷(批号:H0170025):购自上海安谱实验科技股份有限公司;腺苷 (批号:KMO529CA14)、虫草素(批号:RJ0730BA14):购自上海源叶有限公司,所有对照品纯度均>98%;DPPH:购自南京建成有限公司;甲醇、乙腈为色谱级:购自TEDIA公司。

表1 人工蝉花来源信息表Table 1 Information table of artificially cultivated Ic M
1.2 仪器与设备
Ultimate3000型四元梯度分析兼半制备液相:美国赛默飞世尔科技公司产品;BSA224S型电子分析天平:德国赛多利斯公司产品;Q-500B型高速多功能粉碎机:上海冰都电器有限公司产品;SHZ-D(Ⅲ)型循环水真空泵:南京文科仪器设备有限公司产品;PST-JY-10型纯水机:普力菲尔公司;KQ-500B型超声波清洗机:昆山超声仪器有限公司产品;DHG-9140A型电热恒温鼓风干燥箱:上海精宏实验设备有限公司产品;DNM-9602G型酶标仪:美国赛默飞世尔科技公司产品。
1.3 UPLC指纹图谱的建立
1.3.1 色谱条件 Megres C18色谱柱(50 mm×4.6 mm,5μm);流动相水(A)-甲醇(D),梯度洗脱:0~5 min,5%D;5~20 min,5%~15%D;20~30 min,15%~30%D;30~40 min,30%~95%D;40~50 min,95%D;检测波长254 nm;柱温30℃;流量1.0 mL/min,进样量10.0μL。按照上述色谱条件进样,各出峰峰型良好,峰与峰之间分离度也良好。
1.3.2 人工蝉花制备 按照实验室前期处理方法,将9批次不同时间制备的人工蝉花收集后,放入烘箱中于60℃烘干。干燥后样品转入旋风分离器中,分别收取孢子粉和孢子梗、培养基质[14]备用。用时进行粉碎处理,过80目筛。
1.3.3 溶液制备
1)对照品溶液制备 精密称取尿嘧啶、尿苷、鸟苷、腺苷、虫草素对照品适量,置5 mL量瓶中,加甲醇溶解制成质量浓度为1 mg/mL的对照品储备溶液,过0.22μm微孔滤膜备用。分别取对照品储备液适量,加甲醇定容至5 mL,并逐级稀释,得到一系列不同质量浓度的混合对照品溶液,于4℃供分析用。
2)供试品溶液制备 取各批次蝉花孢子粉和孢子梗细粉各1 g,置50 mL离心管中,加入10%甲醇25 mL,超声处理1 h,趁热过滤取上清液,过0.22μm滤膜,即得供试品溶液。
1.3.4 方法学考察 重复性考察、精密性考察及稳定性考察,样品各峰保留时间及峰面积的RSD<3.0%,说明该法重复性、精密性及稳定性良好,可用于建立人工蝉花的指纹图谱。
1.3.5 指纹图谱的建立 制备供试品溶液,在色谱条件下进样,孢子梗部位以S1样品为参照,孢子粉部位以S10用中药色谱指纹图谱相似度评价软件(2004版)进行共有峰的匹配。
1.3.6 质量浓度测定 制备供试品溶液,在色谱条件下进样,记录不同质量浓度对照品的峰面积,利用相关线性方程分别计算供试品溶液5种目标成分的质量浓度。
1.4 药效试验
作者所在实验室在前期研究中发现[15],蝉花对5-氟尿嘧啶造成的小鼠结肠黏膜损伤有一定的修复作用,而黏膜损伤和自由基含量过多有一定关联,大多数化脓性球菌都属于革兰氏阳性菌,其感染以外伤、接触、粪口感染为主,能产生外毒素使人致病。因此我们选择有代表性的金黄色葡萄球菌在pH 8的生理条件下以及DPPH自由基清除抗氧化试验来联合探索蝉花与药效间的关联。
1.4.1 抑菌实验
1)样品液制备 在前人研究基础上进行改进[16],结合预试验结果,得出蝉花质量浓度≥0.1 g/mL时抑菌效果良好,故将供试品溶液进行浓缩,使其质量浓度达到0.1 g/mL,再分别取1 mL用质量分数10%的碳酸钠调至pH 8,以pH 8的碳酸钠溶液为空白对照,在超净工作台上经微孔滤膜(0.45μm)滤过,即为抑菌样品液。
2)培养基及指示菌悬液的制备 称取6.6 g营养琼脂于200 mL蒸馏水中,加热煮沸至完全溶解,121℃高压灭菌15 min,冷却至46℃备用。称取0.9 g营养肉汤溶解于50 mL蒸馏水中,在121℃下高压灭菌15 min,得营养肉汤培养基。然后用接种环挑取一环金黄色葡萄球菌于装有50 mL营养肉汤液体培养基中,在27℃摇床下振荡4 h,制成菌悬液,备用。
3)抑菌圈半径测定 在超净工作台上用移液枪吸取0.2 mL菌悬液于平板上,将培养基倒入培养皿中,迅速摇匀,等待其凝固。采用“滤纸片法”,用镊子将无菌的直径为6 mm的双层滤纸片取出贴在平板上,吸取20μL样品液于滤纸片上。将培养皿置于37℃恒温培养箱中培养24 h,测量抑菌圈大小。
1.4.2 DPPH抗氧化实验
1)样品液制备 基于王余宸铭等人[17]的研究,作者将蝉花孢子粉、孢子梗、培养基质部位样品溶液冷冻干燥后,用体积分数10%甲醇复溶为质量浓度10 mg/mL的样品溶液,以维生素C作为阳性对照,4℃冰箱保存待用。取DPPH固体1 mg溶于24 mL 10%甲醇中,超声10 min,充分振摇使上下部分均匀。
2)DPPH测试液制备 取1 mL DPPH溶液,加入0.5 mL 10%甲醇稀释后,使其吸光度在0.6~1.0。根据前期预试验结果,采用同样方法处理蝉花两部位9批次。于96孔板中加入270μL DPPH和30 μL 10%甲醇溶液作为对照空白;其余每孔中分别加入270μL DPPH和30μL的蝉花孢子粉、孢梗束提取液(9批次)作为试验组,每个样品平行测3份,暗处放置30 min后在517 nm处测定吸光度。按照以下公式进行计算。

式中:A0为空白对照组吸光度值;A1为样品组吸光度值。
1.5 谱效分析
1.5.1 聚类分析 采用SPSS 19.0软件,以人工蝉花共有峰峰面积为变量,对数据进行标准化处理,采用组间平均联接法,以夹角余弦为样品相似度,对人工蝉花不同批次的两个部位进行聚类分析。
1.5.2 灰色关联度分析 两个系统或者两个因素间关联性大小的量度称为关联度。灰色关联度分析是根据因素间发展趋势的相似或者相异程度,利用确定参考数据列和若干比较数据列的几何相似程度,对不同因素间关联度大小进行动态分析的一种度量方法。作者以蝉花抑菌圈半径(cm)和抗DPPH值为参考序列,以指纹图谱共有峰面积数据为比较序列,对孢子粉和孢子梗部位共有峰峰面积进行均一化处理,再通过DPS软件中灰色关联度程序(V3.0)将指纹图谱共有峰数据分别与2组药效数值进行关联分析。
2 结果与分析
2.1 蝉花不同指纹图谱的建立
2.1.1 指纹图谱的建立 将9批次样品制备供试品溶液,在色谱条件下进行测定,记录各样品的UPLC图。将孢子粉和孢子梗样品图谱以cdf格式导入“中药色谱指纹图谱相似度评价系统(2004版)”,以2019.2.22批次样品图为参照图谱,对保留时间进行多点校正,时间宽度为0.1 min,分别生成孢子粉和孢子梗部位的对照指纹图谱,结果见图2。
3.精益求精,力争打造教、康、保三位一体整合服务模式的典范。教、康、保三位一体整合服务模式现阶段还处于实践阶段,由于操作时间短,个案量和个案经验都非常有限,在今后的工作中,庄园将会为更多孤残儿童提供教、康、保整合的服务。通过实践,不断精进,打造出可以推广的、较为先进的服务模式。
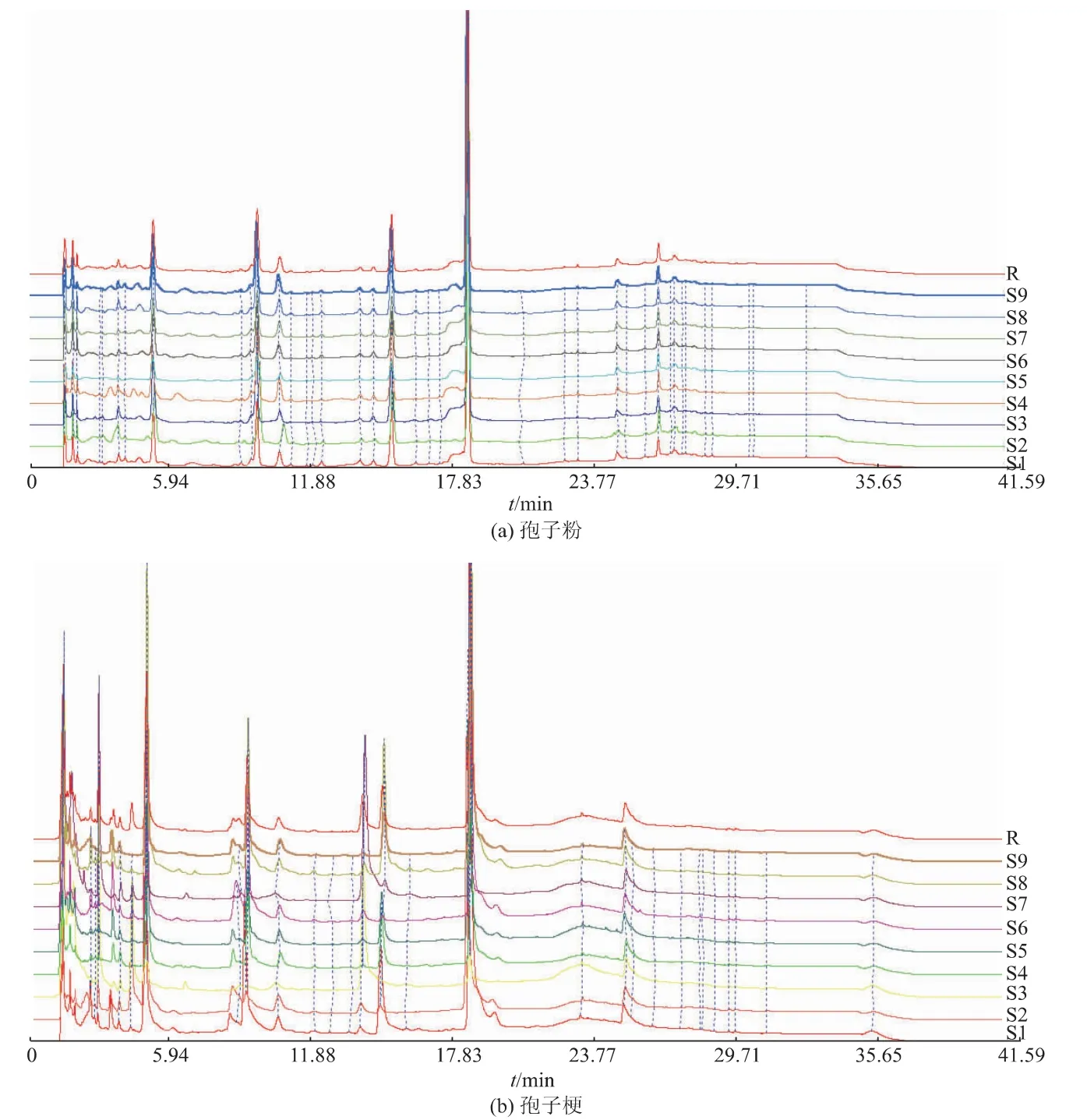
图2 人工蝉花不同部位指纹图谱叠加图Fig.2 Fingerprint overlay of different parts of artificially cultivated Ic M
2.1.2 相似度评价及共有峰指认 按照色谱方法进样,得到的指纹图谱色谱峰分离度良好。人工蝉花孢子粉和孢梗束部位在2个部位的指纹图谱来源于9批不同制备时间的人工蝉花样品,并分别与其生成的对照图谱比较。其中,蝉花孢子粉部位相似度较高,分别为0.942、0.988、0.958、0.980、0.975、0.989、0.988、0.982、0.980。孢梗束部位相似度分别为0.910、0.942、0.538、0.940、0.941、0.946、0.437、0.953、0.933。2019.3.1和2019.4.3批次孢梗束差别较大。其中孢子粉有28个共有峰,孢梗束有15个共有峰。通过对照品比对,发现4个成分在各批次样品图谱中均有发现,保留时间一致,故确定8号峰为尿苷,12号峰为虫草素,11号峰为鸟苷,19号峰为腺苷,结果见图3。
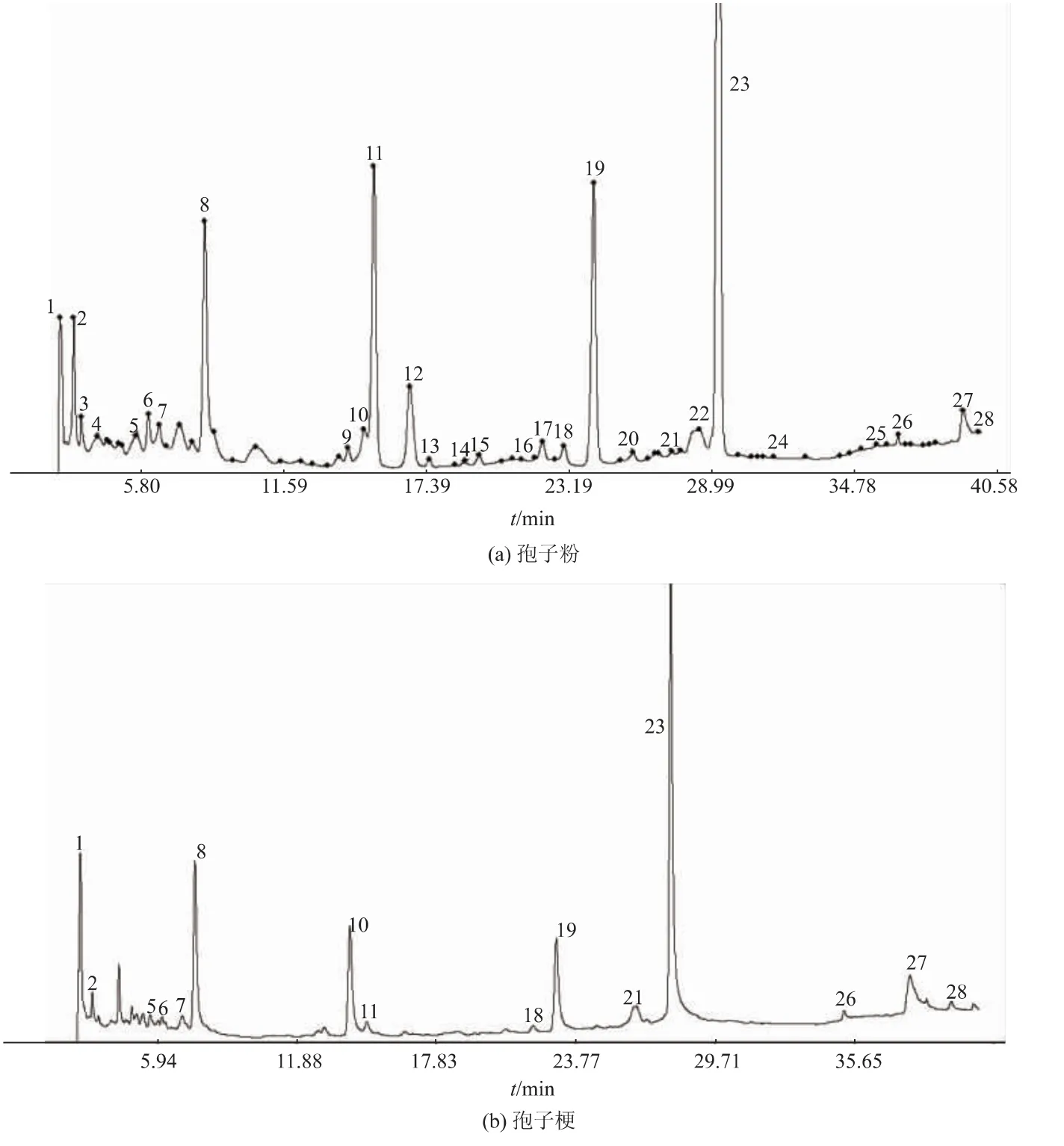
图3 各成分UPLC图谱Fig.3 UPLC chromatogram of each component
2.2 样品质量分数测定
精密吸取一系列质量浓度的对照品标准溶液,进行进样分析,以对照品的峰面积(Y)及相应的质量浓度(X,μg/mL)进行线性回归,得到回归方程,结果见表2。
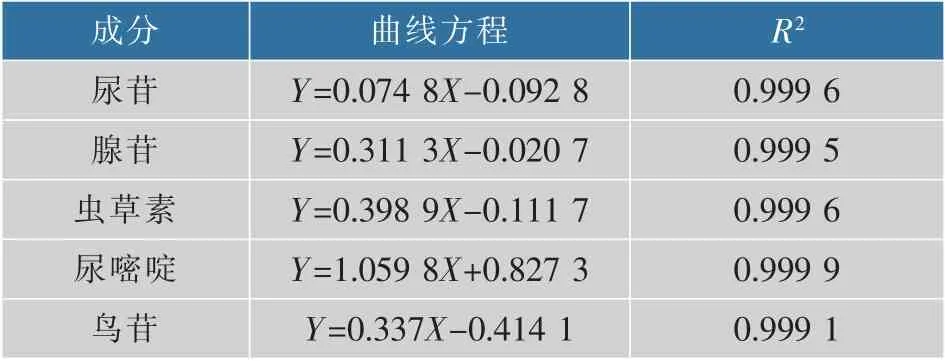
表2 5种目标成分的回归方程Table 2 Regression equations of five targeted constituents
根据相关线性方程,用Excel和Graph Pad软件绘制,分别计算蝉花不同批次孢子粉和孢子梗中尿嘧啶、尿苷、鸟苷、腺苷、虫草素的质量分数(μg/g)结果见表3和图4~5。

图4 蝉花不同部位各成分的百分比Fig.4 Percentage content of various components in different parts of Ic M

表3 蝉花不同部位各类目标成分质量分数Table 3 Content of various components in different parts of Ic M μg/g
由表3和图4可知,不同采收时间的蝉花中5种活性成分质量分数具有一定的差异,其中孢子梗部位尿嘧啶、尿苷、鸟苷、腺苷的总质量分数整体高于孢子粉部位,而虫草素质量分数二者较为接近。
由图5可知,蝉花孢子粉和孢子梗部位所测成分中,尿苷质量分数较高,占所测总成分质量分数的一半以上,而尿嘧啶、尿苷、鸟苷、腺苷质量分数较低,孢子粉部位中尿嘧啶质量分数最低,占比为1.023 45%,而孢子梗部位中以虫草素质量分数较低,仅占所测成分质量分数的0.985 26%。
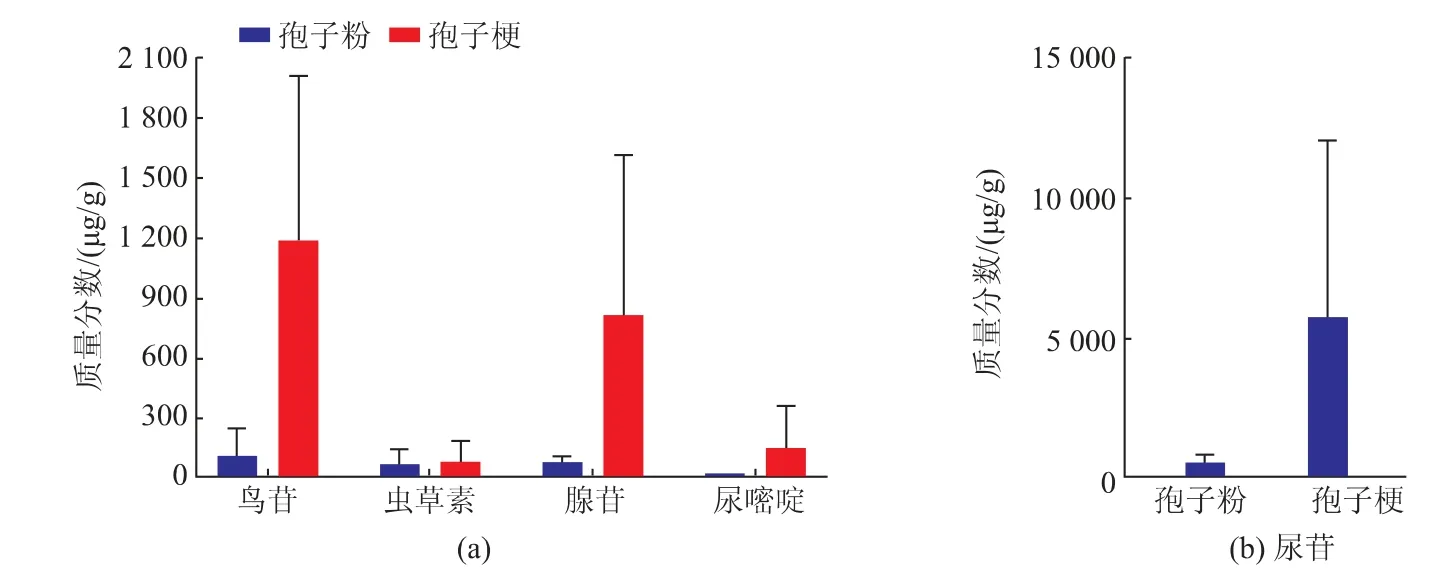
图5 蝉花不同部位中5种目标成分总质量分数的柱状图Fig.5 Histogram of total contents of five targeted components in different parts of Ic M
2.3 抑菌作用
蝉花不同部位对金黄色葡萄球菌的抑菌效果见表4。

表4 人工蝉花不同部位对金黄色葡萄球菌的抑制作用结果Table 4 Inhibitory results of Staphylococcus aureus from different parts of artificial cultivated Ic M
由表5可知,蝉花不同部位提取液对金黄色葡萄球菌均有抑制作用,空白组(pH 8的碳酸钠溶液)的抑菌圈直径<0.6 cm,基本认定无抑菌作用,而样品液在pH 8时抑菌效果良好,且同一批次的人工蝉花孢子粉部位的抑菌效果要优于蝉花孢子梗部位。
2.4 自由基清除能力对比
从图6可以看出,阳性对照组(维生素C)的自由基清除率可达86%~95%,人工蝉花清除自由基效果最高可达阳性对照的一半,孢子粉效果最佳。蝉花孢子梗和孢子粉部位对氧自由基均有一定清除能力,同一制备时间的人工蝉花孢子粉和孢子梗部位对氧自由基清除能力不同,均以孢子粉部位清除能力较好,其中2019.4.17批次孢子粉抗氧化最佳。从整体孢子梗各批次来看,2019.3.1和2019.4.3两个批次孢子梗抗氧化能力较好。

图6 蝉花不同部位DPPH清除率Fig.6 DPPH clearance rate in different parts of artificial cultivated Ic M
2.5 谱效分析
2.5.1 聚类分析 由图7可知,人工蝉花两个部位通过聚类分析法得到了良好的区分,其中孢子粉部位(S10-S18)被归为一类,共有峰的相对峰面积均值较为统一;孢子梗部位与孢子粉部位区别明显,可以较好地进行区别。在不同批次蝉花孢子梗中,不同制备时间带来成分上的差异较为明显,其中S1、S9、S4、S8、S5、S6、S2为一类,S3和S7为一类。此方法相较于蝉花相似度计算的结果更为直观,两种分析手段由此相互补充证实。
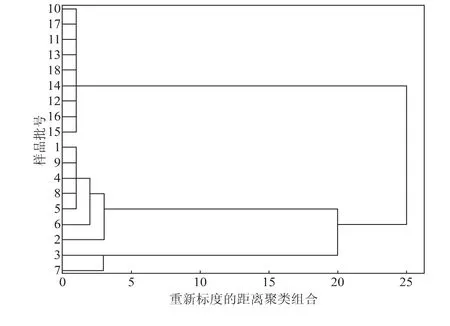
图7 人工蝉花不同部位聚类分析Fig.7 Cluster analysis of different parts of artificial cultivated Ic M
2.5.2 灰色关联度分析 将不同批次蝉花的两个部位的共有峰面积与相对应的蝉花样品液在pH 8条件下的抑菌圈直径以及不同批次DPPH值相关联,结果见表5。
由表5可以看出,一共得到了2组关联度结果。对蝉花抑菌作用贡献度较大的有2、5、11、19、23号峰(关联度均大于0.85),对抗氧化作用贡献度较大的有2、6、11、19、23号峰。综合来看2、11、19、23号峰对人工蝉花抑菌和抗氧化的贡献度都较大。
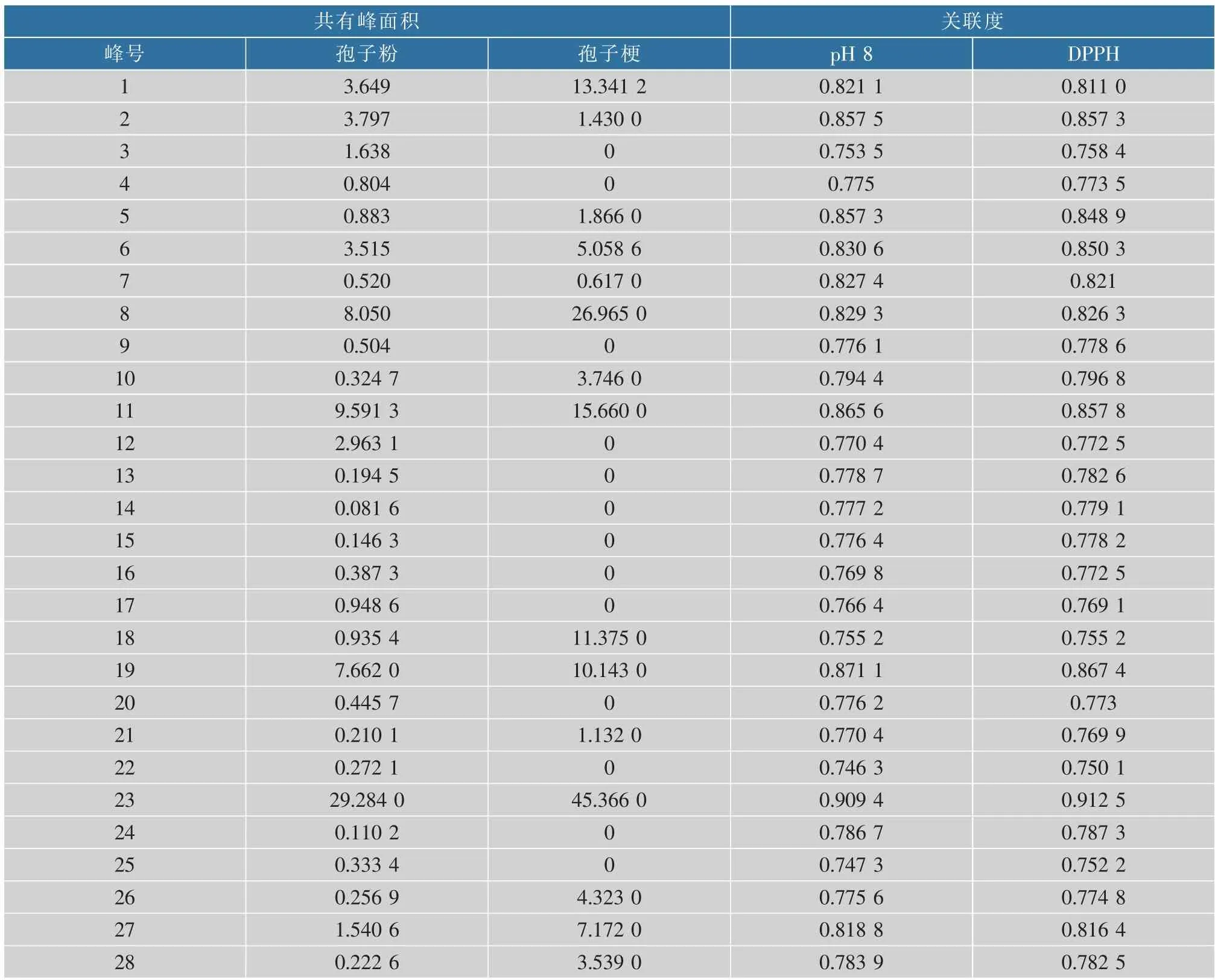
表5 人工蝉花不同部位共有峰数据与其药效相关性Table 5 Correlation between the common peak data of different parts of artificial cultivated Ic M and its pharmacodynamics
3 结 语
采用人工蝉花进行谱效分析,目的不在于对其进行溯源,也不是对药材的真假鉴别。一是目前有关蝉花的活性研究得到的有价值的活性成分信息很少,本研究的目的是想通过“谱”和“药效”的结合来筛选出人工蝉花对药效贡献度大的关键性成分,以便为今后探究人工蝉花不同部位关键性成分的含量及活性研究提供基础;其次也为了考察栽培蝉花质量的稳定性和一致性。结合指纹图谱与聚类分析结果可知,9批次蝉花孢子粉的相似度较高,均大于0.90,即孢子粉样品与批次相关性不大。但是蝉花和其他丝状菌一样,菌株在人工培养基上传代,由于菌落形态和生长速率的改变等生物学性状的变异,会导致产孢子梗能力和目标活性物质产量等生产性状的退化现象,从而影响人工蝉花不同批次孢子梗产品的产量和质量,这也是导致孢子梗中有部分批次差异度比较大,从而被单独聚类的原因之一。
前期研究发现,人工蝉花对肠道炎症有快速的治疗效果,但蝉花提取液并无明显的体外抑菌活性,当pH调至8,可以达到良好的抑菌效果,说明蝉花的抗菌活性与pH值有关。微碱性条件同机体肠道部位pH值相近,前期的研究也证实,作者所在实验室培养的人工蝉花对5-氟尿嘧啶造成的小鼠结肠黏膜损伤有快速修复作用,肠道黏膜损伤后会造成肠道炎症,而肠道黏膜损伤和自由基含量过多有较大关联。所以,在抗氧化指标方面,选用具有代表性的DPPH法来测定人工蝉花不同部位清除自由基的能力。作者所在实验室栽培的人工蝉花在产生抑菌效果的同时不会对机体产生不良影响,这一点同抗生素的抑菌作用有着较大的区别。抗生素的抑菌与pH值无关,多是微生物产生或化学合成的具有抑菌或者杀菌活性的物质,且容易对机体造成不良反应,如腹泻、恶心、头晕等。而本研究中人工栽培蝉花在抑菌的同时不会对肠道功能造成不良影响。基于这些原因,选择抑菌、抗氧化指标来对人工蝉花的药效活性进行探究。此外,从不同批次蝉花不同部位的质量分数来看,蝉花孢子梗中尿嘧啶、腺苷、鸟苷、尿苷、虫草素质量分数均值显著高于孢子粉,且各批次的质量分数均有区别。然而在药效实验中,孢子粉对金葡菌的抑制效果和自由基清除效果均优于孢子梗。结合灰色关联度结果可以推测,这5种活性成分需要合适的配比才能在蝉花抑菌和抗氧化中起到较为重要的作用,质量分数过高或者过低可能对药效均有较大影响,比如孢子粉部位中尿嘧啶质量分数最低,而孢子梗部位虫草素质量分数最低。
由灰色关联度结果可以看出,不同指标对同一个特征峰会表现出各自不同的关联度,这表明不同指标受到某一成分的调控作用有差异性。作者以2组关联度的均值作为综合关联度来判断共有峰对药效的贡献度,2、11、19、23号峰(关联度均大于0.85)代表的化学成分是对蝉花抑菌抗氧化作用贡献较大的成分,将孢子粉和孢子梗部位的上述共有峰的峰面积相加,占蝉花孢子粉部位峰面积的50%以上,表明这些峰所代表的化学成分在人工蝉花孢子粉中量较多,和药效试验部分的结果相符,即人工蝉花孢子粉部分表现出更好的抑菌抗氧化趋势。但对于上述共有峰,目前从液相色谱比对中只确定了8、11、19号,分别是尿苷、鸟苷、腺苷,其他关联度高的未知化学成分的结构有待后期研究。
另外,发现11、19、23号峰在蝉花孢子粉和孢子梗间、不同批次间峰面积减小时,2号峰面积增加,且2、11号峰增减最为明显,而与其临近的1、10号峰峰面积也相应变化。这几个共有峰对抑菌抗炎作用的贡献度都较大,推测这些配对峰在蝉花生长过程中,不同的部位可能发生了转化[18],比如从孢子萌发和菌落生长速度看,其最佳温为24~26℃。但孢梗束生长温度有明显偏低现象,24℃以上不能形成孢梗束[19]。
通过采用灰色关联度分析法分析了蝉花抑菌抗氧化的药效与化学成分之间的关联度,但此法不能反映出成分对不同药效的综合贡献度。所以在后期试验中将灰色关联度与主成分分析法结合使用,并对蝉花的体内药效进行探究,即完整的体内体外药效多重指标,以便客观地体现各成分的作用和影响,为后期蝉花药效物质研究提供思路。

