糖原作为新型基因载体的研究
邓淑豪,赖 莉,王志清,张慧杰,陈敬华
(江南大学 生命科学与健康工程学院,江苏 无锡214122)
基因治疗是指将外源正常基因导入靶细胞,以修复有缺陷的基因或补偿基因的缺失,从而达到疾病治疗的目的。目前,基因治疗在攻克肿瘤、糖尿病、遗传性疾病和自身免疫性疾病等方面显示出极大的潜力[1-2]。然而,未经修饰的目的基因不稳定,进入血液循环后极易被核酸酶降解。此外,目的基因在生理环境下一般带负电荷,导致其难以进入靶细胞[3-4]。这些弊端都极大地影响到基因治疗的效果。因此,构建安全高效的递送载体对于基因治疗至关重要。
常用的基因载体主要分为两大类:病毒载体和非病毒载体[5]。病毒载体具有较高的基因递送效率。然而,病毒载体制备过程复杂,同时,病毒载体存在免疫原性和潜在的安全性问题,这些因素严重制约了其临床应用[6-7]。相对而言,非病毒载体制备简单、免疫原性较低,同时载体结构设计丰富多样,可有效提高目的基因的细胞转染效率。非病毒载体主要以阳离子脂质体、阳离子聚合物为代表[8-11]。PEI 25k是目前研究最为广泛的聚阳离子非病毒载体。尽管PEI 25k可以显著提高目的基因的细胞转染效率,但其自身较高的毒性限制了其发展。近年来,随着纳米生物技术的发展,利用各种纳米材料、纳米结构等构建的基因递送系统受到了越来越多的关注。
糖原是由葡萄糖聚合而成的天然树状大分子多糖,是哺乳动物的贮备多糖,主要存在于哺乳动物的肝脏和骨骼肌中。作为内源性多糖,糖原无毒、无免疫原性。同时,糖原在体内可被淀粉酶和糖苷酶降解为葡萄糖[12]。糖原是天然的多糖纳米材料,其粒径大小约为20~150 nm[13-15]。糖原可溶于水,富含官能团,易通过化学修饰引入其他官能团[4]。糖原具有密集的支链,其树状大分子纳米结构可以实现对药物以及核酸等的高效负载。基于上述优异的性能,糖原在生物医学领域的应用逐渐成为研究热点[16-17]。
作者利用二乙烯三胺修饰糖原合成了氨基化的糖原衍生物(NH2-Gly),并对其作为基因载体的可行性和有效性进行了评估。利用动态光散射仪和红外光谱对NH2-Gly结构进行了表征。采用凝胶电泳实验分析其对pEGFP的负载和保护能力。通过MTT实验和溶血实验考察了NH2-Gly的生物相容性。最后,利用流式细胞术和激光共聚焦显微镜分析了NH2-Gly/pEGFP在NIH 3T3细胞内的转染效率。
1 材料与方法
1.1 材料与试剂
糖原(glycogen,相对分子质量100 000~110 000):上海源叶生物科技有限公司产品;二乙烯三胺(DETA):上海安耐吉化学有限公司产品;相对分子质量25 000聚乙烯亚胺:美国Sigma-Aldrich公司产品;绿色荧光蛋白质粒(pEGFP-N1):北京TIANDZ公司产品,在大肠杆菌DH5α中大量繁殖,使用质粒抽提试剂盒抽提并纯化;质粒抽提试剂盒:上海生工生物工程股份有限公司产品;DNase酶、质量分数4%多聚甲醛固定液:上海生工生物工程股份有限公司产品;小鼠胚胎成纤维细胞NIH 3T3:来自中国科学院上海细胞库;3-(4,5-二甲基噻唑-2)-2,5-二苯基四氮唑溴盐(MTT)、胰蛋白酶:碧云天生物技术公司产品;DMEM(Dulbecco's Modified Eagle Medium)培养基、胎牛血清:美国Gibco公司产品;TAE缓冲液:武汉博士德生物公司产品;所需其他化学试剂(均为分析纯):国药集团化学试剂有限公司产品。
1.2 仪器与设备
Zetasizer Nano ZS动态光散射粒度仪:英国Malvern公司;凝胶成像仪:美国BIO-RAD公司;TENSORⅡ型红外光谱仪:德国Bruker公司;AduanceⅢ型全数字化核磁共振波谱仪:德国Bruker公司;透射电子显微镜:日本JEOL公司;酶标仪:美国Bio-Rad公司;流式细胞仪:美国Beckman公司;Nanodrop One超微量紫外分光光度计:美国Thermo Fisher公司;高速离心机:德国Eppendorf公司;激光共聚焦显微镜:德国Leica公司。
1.3 研究方法
1.3.1 NH2-Gly的制备 首先按照质量比为1∶1~1∶10的比例分别称取相应质量的糖原和羰基二咪唑(CDI)。在惰性气体保护下,投入不同质量比的糖原与CDI,溶解于二甲基亚砜中;低温搅拌1~4 h后,随即加入一定质量的二乙烯三胺,持续反应12~36 h,得到氨基化糖原。随后将上述所得溶液用去离子水透析3~5 d以去除有机溶剂等杂质,透析后将溶液放入冰箱冷冻24 h,然后用冻干机进行干燥,即得到氨基化糖原衍生物(NH2-Gly)。为测定二乙烯三胺在糖原上的取代程度,对NH2-Gly进行酸碱滴定。首先用去离子水配制25 mL 1 mg/mL的NH2-Gly样品溶液,然后用酸碱滴定管进行滴定。先用HCl溶液(0.1 mol/L)滴定样品溶液至pH为2.0,随即用NaOH溶液(0.1 mol/L)滴定混合物,滴加的同时测量其pH,记录pH随滴定体积增加的变化情况,绘制滴定曲线,得到2个突变点。取代度根据公式(1)计算:
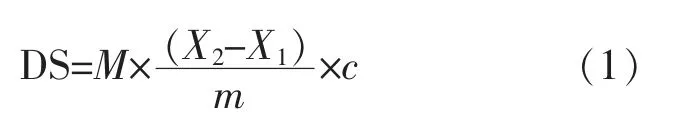
式中:DS为取代度;M为二乙烯三胺的相对分子质量;c为NaOH溶液的浓度,mol/L;m为NH2-Gly的质量,g;X1为第一个突变点的横坐标,mL;X2为第二个突变点的横坐标,mL。
1.3.2 NH2-Gly的pH缓冲能力测定 采用酸碱滴定法测定不同氨基化程度的NH2-Gly的pH缓冲能力及对照组PEI 25k在pH 2~11范围内的缓冲能力。样品溶液浓度为0.5 mg/mL,溶剂为NaCl溶液(0.1 mol/L),先用NaOH溶液(0.1 mol/L)滴定样品溶液pH至11左右,然后将HCl溶液(0.1 mol/L)连续滴入溶液中并充分混匀,记录pH的变化。
1.3.3 NH2-Gly的溶血性实验 研究不同质量浓度NH2-Gly的溶血性。取1 mL小鼠血液于8 000 r/min下离心10 min以分离红细胞,用pH 7.4的PBS洗涤5次至上清液澄清,用PBS稀释重悬红细胞。称取一定量NH2-Gly样品,并向不同样品中分别加入200μL红细胞悬液,其中NH2-Gly样品溶液取800 μL(12.5、25.0、50.0、100.0、200.0μg/mL)。另外,分别采用800μL PBS和水作为对照,PBS作为阴性对照(0%溶血),水作为阳性对照(100%溶血)。样品放入37℃水浴锅中孵育4 h后取出,2 000 r/min离心10 min,吸取100μL上清液加入96孔板中,用酶标仪检测540 nm处吸光度。溶血率根据公式(2)计算:

式中:A为聚合物与血红蛋白形成溶液的吸光度;A0为阴性对照溶液吸光度;A100为阳性对照溶液的吸光度。
1.3.4 NH2-Gly/pEGFP复合物的制备 取一定质量的NH2-Gly加入PBS中,搅拌使其充分溶解,得到相应质量浓度的NH2-Gly溶液。随即按NH2-Gly与pEGFP的质量比(1∶1、2∶1、5∶1、10∶1、20∶1)分别加入一定质量的pEGFP溶液,充分振荡混匀,于4℃保存。取样品溶液1 mL,采用动态光散射粒度仪测定NH2-Gly/pEGFP纳米粒子的粒径和表面电荷,测定温度均为25℃。
1.3.5 琼脂糖凝胶电泳阻滞实验 按NH2-Gly与pEGFP的质量比(1∶1、2∶1、5∶1、10∶1、20∶1)制备成NH2-Gly/pEGFP复合物,NH2-Gly/pEGFP含2.5μg质粒将所得复合物室温静置孵育1 h。吸取样品或pEGFP溶液4μL(1μg),加入上样缓冲液2μL,混匀。采用质量分数1%的琼脂糖凝胶进行电泳分析(100 V,30 min),用凝胶成像系统观察凝胶并拍照,考察NH2-Gly对pEGFP的负载能力。
1.3.6 NH2-Gly/pEGFP的抗酶解实验 按NH2-Gly与pEGFP质量比为5∶1和10∶1制备NH2-Gly/pEGFP复合物,复合物含5μg质粒。将所得复合物室温静置孵育1 h。按照DNase说明书进行操作,取5μL NH2-Gly/pEGFP或pEGFP溶液进行酶处理1 h,处理结束后将溶液低速离心,吸取底部溶液进行琼脂糖凝胶电泳,对照组为未使用DNase处理的pEGFP。
1.3.7 NH2-Gly/pEGFP的细胞相容性评价 采用MTT法对NH2-Gly及NH2-Gly/pEGFP的细胞毒性进行评价。将培养好的NIH 3T3细胞稀释至一定倍数,按每孔1×104个细胞取100μL接种于96孔板中,放入37℃培养箱中培养24 h使细胞贴壁。细胞贴壁后吸去旧培养基,加入100μL培养基。向96孔板中分别加入不同质量浓度的NH2-Gly、NH2-Gly/pEGFP及PEI,然后将96孔板放入37℃培养箱中培养24 h或48 h后吸出培养基,加入0.5 mg/mL MTT的培养基溶液,放入37℃培养箱培养4 h。接着吸出MTT的培养基溶液,每孔加入100μL DMSO,于37℃摇床上以100 r/min避光振摇10 min,用酶标仪检测490 nm处的吸光度。根据公式(3)计算细胞活力:
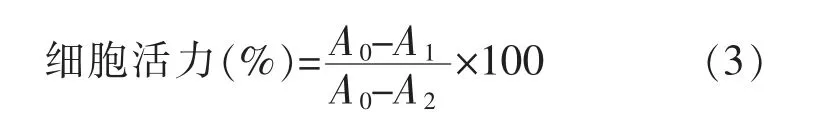
式中:A0为聚合物在加入MTT反应后形成溶液的吸光度;A1为阴性对照溶液的吸光度;A2为阳性对照溶液的吸光度。
1.3.8 NH2-Gly/pEGFP体外转染效率 将培养状态良好的NIH 3T3细胞稀释一定倍数,向12孔板及共聚焦小皿中接种1 mL,密度为每孔1×105个细胞,放入37℃培养箱中培养24 h使细胞贴壁。分别制备不同质量比的NH2-Gly/pEGFP复合物和PEI/pEGFP复合物,向12孔板的每个孔中加入50μL复合物,补加无血清DMEM培养基使每个孔体积达到300μL。放入37℃培养箱中培养,孵育4 h,转染完毕更换新鲜的含体积分数10%FBS的培养基,再继续培养12、24、48 h。然后处理样品,用PBS洗涤3次,再用胰酶消化,以1 000 r/min离心收集细胞,加入PBS重悬,用流式细胞仪测定转染效率。用PBS冲洗2~3次,随后将每个培养皿加入500μL质量分数4%的多聚甲醛固定液固定10 min,再用PBS冲洗2~3次后保存于500μL PBS中,采用激光共聚焦显微镜观察细胞转染效果。
1.3.9 统计学处理 统计学处理计数资料以平均值±标准差表示,运用SPSS 23.0进行t检验或方差分析。
2 结果与讨论
2.1 NH2-Gly的合成与表征
采用红外光谱分析不同氨基化程度的NH2-Gly结构。由图1可知,制备的NH2-Gly在1 699 cm-1处的强吸收峰不同于糖原,是酰胺的特征吸收峰,可以归结为—C=O伸缩振动。此外,1 457~1 532 cm-1和1 263~1 291 cm-1处的吸收峰分别为—NH—弯曲振动和C—N振动[6]。此外,NH2-Gly在1 457~1 532 cm-1处的吸收峰较糖原明显加强,且随着氨基化程度的提高而增强。这些结果表明,糖原已成功被二乙烯三胺寡氨残基修饰,得到了不同氨基化程度的NH2-Gly。

图1 氨基化糖原红外光谱图Fig.1 FTIR spectra of glycogen and NH2-Gly
粒径和所带电位很大程度上影响着基因载体的转染效率。采用动态光散射粒度仪测定了NH2-Gly的粒径和表面电位,结果见表1。所制备的NH2-Gly的水化粒径范围为50~90 nm。通过酸碱滴定可计算出不同物料比条件下制备的NH2-Gly的氨基取代度。由表1数据可知,氨基取代度随活化剂CDI与糖原质量比的增加而增加。反应物料质量比为2∶5∶5所合成的NH2-Gly的氨基取代度最高,可达到42.6%。同时,在此条件下得到的NH2-Gly电位最高,达37.1 mV。据此可判断物料质量比为2∶5∶5是合成NH2-Gly的较优条件。后续实验中所用到的NH2-Gly均在此质量比下合成。带有强正电荷的NH2-Gly具有较好的对目的基因进行压缩包裹的能力。图2为糖原和NH2-Gly的透射电镜图,可以看出,糖原和NH2-Gly为球形纳米粒子结构,粒径均在50 nm左右,且粒子分散均匀,几乎无团聚现象。

图2 透射电子显微镜图Fig.2 Transmission electron microscopy images
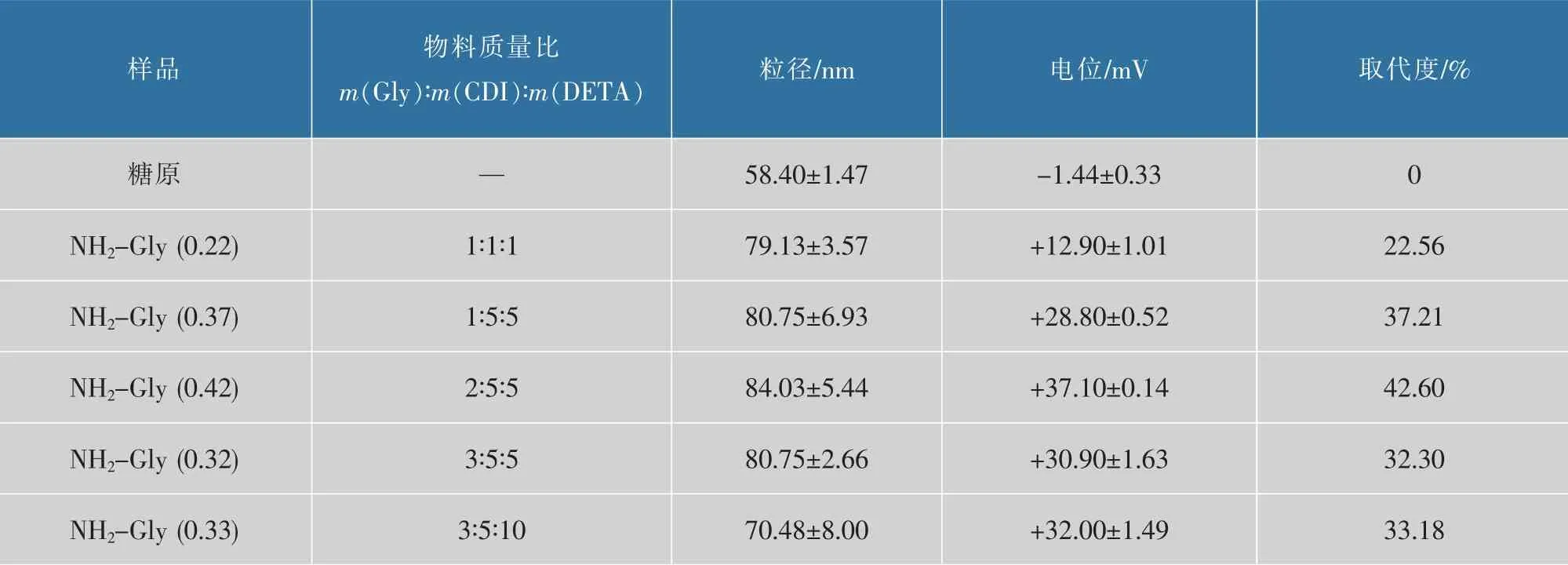
表1 糖原和氨基化糖原的粒径、电位、取代度Table 1 Size,zeta potential and degree of substitution of NH2-Gly
2.2 NH2-Gly的pH缓冲能力
阳离子聚合物的基因转染能力与其缓冲能力密切相关。PEI具有“质子海绵”效应,表现出较高的缓冲能力。PEI所具有的“质子海绵”效应能够使内吞小泡溶胀破裂,帮助PEI/基因复合物逃逸到细胞质中,从而具有较高的基因转染能力。不同氨基化程度的NH2-Gly在NaCl水溶液中的缓冲能力见图3。未修饰的糖原在pH突变时消耗HCl(0.1 mol/L)体积最少,缓冲性能较差,这是由于糖原自身游离的可供反应的基团较少所致。糖原被二乙烯三胺寡氨残基修饰后,pH突变时消耗HCl体积有所增加,缓冲性能得到明显改善。然而,由于NH2-Gly存在相对较少的氨基,其缓冲能力仍低于PEI 25k。随着NH2-Gly的氨基取代度提高,溶液的酸碱缓冲能力显著增强。NH2-Gly有望实现目的基因的有效转染。

图3 氨基化糖原和PEI 25k的pH缓冲能力Fig.3 Buffering capacity of NH2-Gly and PEI 25 k
2.3 NH2-Gly的血液相容性评价
将不同质量浓度的NH2-Gly与分离出的红细胞一起孵育后,通过观察不同质量浓度的NH2-Gly的溶血现象,评估NH2-Gly的血液相容性。如图4所示,在NH2-Gly质量浓度高达200μg/mL时,NH2-Gly的溶血率远远低于阳性对照组的溶血率,未达到阳性对照组的5%。结果表明,NH2-Gly不会对红细胞造成溶胀,NH2-Gly具有较好的血液相容性。

图4 氨基化糖原的溶血活性评价Fig.4 Hemolysis activity of NH2-Gly
2.4 NH2-Gly对pEGFP的压缩包载
载体能否对基因进行有效压缩包裹是实现基因递送的首要条件。采用琼脂糖凝胶电泳考察NH2-Gly对目的基因pEGFP的压缩包裹能力。图5为不同质量比的NH2-Gly/pEGFP复合物的琼脂糖凝胶电泳图。随着NH2-Gly/pEGFP复合物质量比的升高,电场作用下迁移的pEGFP越来越少。当NH2-Gly与pEGFP质量比为2∶1时,泳道中已观察不到迁移的pEGFP,pEGFP完全滞留在上样孔内,表明此时NH2-Gly可完全压缩包载pEGFP。NH2-Gly带有较强的正电荷,随着NH2-Gly与pEGFP质量比的增加,NH2-Gly与pEGFP之间的静电相互作用得到增强。此结果表明,该NH2-Gly对pEGFP具有较好的压缩包载能力,有望作为新型基因载体。

图5 pEGFP和不同质量比NH2-Gly/pEGFP复合物的琼脂糖凝胶电泳Fig.5 Agarose gel electrophoresis analysis of the pEGFP and NH2-Gly/pEGFP complex with different weight ratios
2.5 NH2-Gly/pEGFP复合物的表征
载体/基因复合物的粒径和电位是影响其转染效率的重要因素。研究表明,适度的正电荷和合适的粒径(50~200 nm)有利于载体/基因复合物的细胞摄取和胞内运输[19-20]。NH2-Gly带有较强的正电荷,可与pEGFP通过静电作用组装成纳米粒子。表2为不同制备条件下得到的NH2-Gly/pEGFP复合物的粒径与电位。当NH2-Gly与pEGFP质量比为1∶1时,复合物粒径约为100 nm,电位为负值,说明此条件下NH2-Gly未能将pEGFP完全包载。这个结果与图5中凝胶电泳结果一致。随着NH2-Gly比例的增加,NH2-Gly/pEGFP复合物粒径有所增大并保持相对稳定,多分散系数(PDI)在0.2左右,表明复合物粒径比较均一。同时,NH2-Gly/pEGFP复合物所带电荷也由负变正并保持稳定。以上结果表明,NH2-Gly/pEGFP复合物的粒径和电位有利于细胞转染。

表2 NH2-Gly/pEGFP的粒径和电位Table 2 Size and zeta potential of NH2-Gly/pEGFP complex
2.6 NH2-Gly/pEGFP抗核酸酶降解能力
基因在递送过程中易被血清中的核酸酶降解,导致基因治疗的失败。为了验证NH2-Gly对pEGFP的保护能力,将NH2-Gly/pEGFP复合物以及pEGFP与DNase共孵育,然后进行琼脂糖凝胶电泳实验。如图6所示,NH2-Gly/pEGFP复合物的条带清晰,表明其可以保护pEGFP免受核酸酶降解,而游离EGFP已经被DNase降解,无法看到条带。此结果说明NH2-Gly对pEGFP的高效包载提高了pEGFP在血清中的稳定性,是一个优良的基因载体。

图6 pEGFP和NH2-Gly/pEGFP复合物的稳定性Fig.6 Stability of the pEGFP and NH2-Gly/pEGFP complex
2.7 NH2-Gly/pEGFP的细胞毒性
阳离子基因载体的细胞毒性是影响其临床应用的主要障碍之一。选择PEI 25k作为对照,采用MTT法检测了NH2-Gly和NH2-Gly/pEGFP对于NIH 3T3细胞的毒性。如图7所示,培养24 h和48 h后,PEI和PEI/pEGFP在较低质量浓度下就已显现出高细胞毒性,细胞存活率低于50%。这主要是由PEI 25k所具有的较高的正电荷密度以及骨架的不可降解性所导致。相反,NH2-Gly没有抑制NIH 3T3的增殖,表现出良好的生物相容性。这主要归因于糖原较好的生物相容性、生物可降解性以及NH2-Gly相对较低的电荷密度。NH2-Gly/pEGFP与细胞培养48 h后没有表现出明显毒性现象,质量浓度为30μg/mL时相对细胞存活率为108%,50μg/mL时相对细胞存活率为100%,100μg/mL时存活率仍超过90%。因此,NH2-Gly细胞毒性较低,具有较好的安全性,有望作为新型基因载体。

图7 NH2-Gly和NH2-Gly/pEGFP对NIH 3T3细胞的毒性Fig.7 Cytotoxicity of NH2-Gly and NH2-Gly/pEGFP complex to NIH 3T3 cells
2.8 NH2-Gly/pEGFP体外转染效率
基因复合物能否被细胞摄取很大程度上影响着基因治疗的效果。首先利用共聚焦显微镜观察了NH2-Gly/pEGFP在NIH 3T3细胞内的转染情况。如图8所示,转染48 h后,NIH 3T3细胞的细胞质和细胞核中均可见表达的GFP的绿色荧光,且GFP荧光强度随着NH2-Gly与pEGFP质量比的增加而增加,说明NH2-Gly/pEGFP在NIH 3T3细胞中的转染效果明显。其中,质量比10∶1时,复合物转染的NIH 3T3细胞的GFP荧光强度最强,细胞形态正常且生长状态好。NH2-Gly的转染效果与PEI 25k相当。而PEI/pEGFP复合物转染的细胞生长状态欠佳,细胞少而分散且形态呈圆形,细胞生长状态较差,绿色荧光较暗。质量比为10∶1的复合物获得高转染效率的原因主要有以下两个方面:首先,NH2-Gly/pEGFP复合物细胞毒性小,高质量比易获得高转染效率,而PEI 25k的细胞毒性较大,提高转染比例后细胞易死亡,从而引起转染效率降低;其次,糖原可以被α-D-葡萄糖苷酶从非还原性末端降解,有利于DNA的释放,可以提高转染效率。

图8 NH2-Gly/pEGFP在成纤维细胞中的激光共聚焦显微镜图Fig.8 Confocal laser scanning microscopy images of the transfection of NH2-Gly/pEGFP in NIH 3T3 cells
随后用流式细胞仪定量考察了NH2-Gly/pEGFP及PEI/pEGFP复合物在NIH 3T3细胞中的转染效果。由图9可知,在24 h时,NH2-Gly与pEGFP质量比为5∶1的复合物转染效率要明显高于PEI/pEGFP复合物,说明其具有较快的转染效率。这主要因为NH2-Gly/pEGFP具有较好的生物相容性。转染48 h后,NH2-Gly与pEGFP质量比为10∶1的复合物转染效果与PEI/pEGFP复合物的转染效果相当。综上所述,NH2-Gly载体具有较好的细胞转染能力,其转染效果可接近或超过PEI。考虑到NH2-Gly载体良好的生物相容性,NH2-Gly有望作为载体用于基因治疗。

图9 NH2-Gly/pEGFP复合物在NIH 3T3中的流式分析图Fig.9 Flow cytometer of NH2-Gly/pEGFP complex in NIH 3T3 cells
3 结语
通过较为简便的方法合成了氨基化的糖原衍生物(NH2-Gly)。NH2-Gly表面带有较高的正电荷,同时具有良好的生物相容性和较好的缓冲能力。NH2-Gly可有效络合pEGFP并保护其免受核酸酶的降解。NH2-Gly大幅提高了pEGFP在NIH 3T3细胞中的转染效率,其转染效率几乎与PEI 25k相当。同时,与PEI相比,NH2-Gly的生物相容性更好。此外,溶酶体内含有大量的能够分解糖原的α-葡萄糖苷酶,NH2-Gly/基因复合物有望在溶酶体内被α-葡萄糖苷酶水解,释放出所包载的基因。同时,基于糖原易于功能化修饰的特点,未来还可以在NH2-Gly表面进一步修饰靶向基团,实现基因的靶向递送。综上,糖原有望作为安全高效的基因载体,在基因治疗领域具有广泛的应用前景。

