孙氏手术和升主动脉—右侧锁骨下动脉血管转流术治疗急性Stanford A 型TAAD合并迷走右锁骨下动脉5例
张勇,梁家立 ,任超,王惠,侯君
1 中国人民解放军第960医院心血管外科,济南 250031;2 中国人民解放军第960医院超声诊断科;3 中国人民解放军西部战区总医院药理科
迷走右锁骨下动脉(ARSA)是直接开口于左锁骨下动脉以远,且发自主动脉弓或降主动脉上部的一种先天性血管畸形,是由胚胎时期血管发育异常所致,向后向右上方走行食管前方/后方或气管前方,一般不出现症状,部分患者因为ARSA 压迫食管出现梗阻症状而就诊,大部分行主动脉增强CT 发现[1-2]。主动脉夹层指主动脉腔内的血液从主动脉内膜撕裂处进入主动脉中膜,使中膜分离,沿主动脉长轴方向扩展形成主动脉壁的真假两腔分离状态,根据手术的需要又根据Stanford 分型,分为A 型和B型,A 型破口位于升主动脉,适合急诊外科手术,B型夹层病变仅限于腹主动脉或髂动脉,可以先内科治疗,再开放手术或腔内治疗。孙氏手术是治疗Standford A 型主动脉夹层的标准术式。但Standford A 型主动脉夹层合并ARSA临床病例少见,治疗方式不统一。由于ARSA 位置较深,血管不易游离;即使游离出来进行吻合,术后一旦吻合口出血,止血非常困难。2012 年 8 月—2021 年 8 月,我们采用升主动脉—右侧锁骨下动脉血管转流术的方式重建ARSA 血流并联合孙氏手术治疗了5 例急性Standford A 型主动脉夹层合并ARSA 的患者,均取得了良好的临床效果。
1 资料与方法
1.1 临床资料 急性Standford A 型主动脉夹层合并ARSA患者5例,均经术前主动脉增强CT(见图1)或心脏彩超检查明确诊断,均为男性,年龄38~58(42.16±7.66)岁,体质量75~86(83.26± 8.16)kg。均为急诊发病,最长发病时间少于3 d,均行急诊手术。患者术前均合并高血压病,肾功能不全(血清肌酐值>115 μmol/L)2 例,下肢缺血 1 例,主动脉瓣关闭不全(轻—中度)2例。
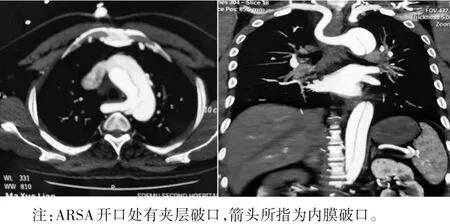
图1 StandfordA型主动脉夹层合并ARSA CT图像
1.2 一期实施孙氏手术和升主动脉—右侧锁骨下动脉血管转流术方法 先在右侧气管边游离出ARSA 并予以结扎,而后进行主动脉根部成形及孙氏手术,最后行升主动脉—右侧锁骨下动脉血管转流术。
全麻下气管插管,两侧桡动脉及一侧足背动脉置入动脉测压管,一侧股静脉插8 号鞘管进行自体血小板采集,右侧锁骨下切口游离右侧锁骨下动脉,开胸游离主动脉弓3 个分支,气管右后侧游离迷走ARSA。待血小板采集完成后,另外一侧腹股沟处游离股总动脉。对于术前一侧下肢缺血的1 例患者,股动脉插管选择在缺血侧。股动脉及右心房(上下腔)插管建立体外循环,右上肺静脉插左心吸引管,阻断升主动脉,左右冠状动脉开口直接灌注HTK 心肌保护液,降温期间完成主动脉根部手术(主动脉瓣悬吊、无冠窦成形,主动脉根部三明治成形),如果鼻咽温降至28 ℃,即使主动脉根部手术未完成,也先开始做远端手术。
主动脉根部处理时,术中如果有右无或者左无瓣膜交界撕脱,给予用5-0 prolen 双头针带垫片悬吊固定。近端主动脉断端行“三明治”加固,内衬垫人造血管条,外垫衬毛毡条,上端平血管残端,下面在瓣膜交界上方,沿着血管条下缘应用4-0 Prolene 线间断缝合。术中进行双侧脑灌注血液保护脑,根据脑血氧饱和度,灌注流量5~8 mL/kg,切开主动脉弓直至左侧锁骨下动脉开口,将术中支架放入降主动脉真腔内,而后完成四分支血管主体远端和术中支架的缝合。缝合时应当适当调整四分支血管的摆放位置,使主体血管吻合后四分支均位于前方,以便同其他血管吻合。远端吻合完毕后,将平常用于吻合无名动脉的10 mm 分支内插入灌注管(此分支血管最后用于在右侧锁骨下切口处吻合右侧锁骨下动脉),恢复下半身灌注,而后拔出股动脉插管(防止插管时间过长影响下肢血运)。血液充分氧合复温,期间将四分支血管中的3 个分支(直径分别为8 mm、8 mm、10 mm)分别同左侧锁骨下动脉、左颈总动脉、右颈总动脉进行吻合,而后再进行近端的手术吻合。停机后注鱼精蛋白中和肝素之前,将剩余10 mm 分支的人造血管穿过右侧胸腔,经右侧第二肋间至右侧锁骨下切口引出,同右侧锁骨下动脉端侧吻合(图2)。
2 结果
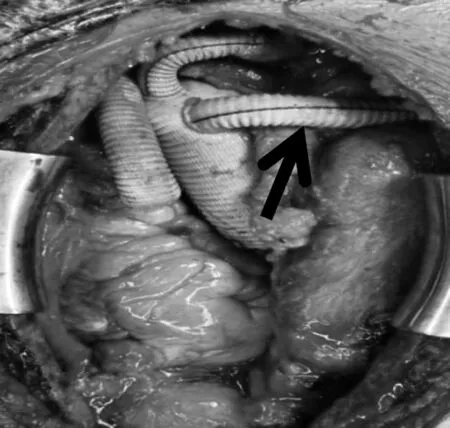
图2 升主动脉—右侧锁骨下动脉血管转流术联合孙氏手术结束后的手术视野图
5 例患者均成功完成手术。手术时间(8.96 ±1.60)h,体外循环时间(258.26 ± 36.56)min,主动脉阻断时间(156.36±26.33)min,双侧脑灌注时间(36.60 ± 6.12)min。 行主动脉根部三明治缝合加固5 例,无冠和右冠交界悬吊3 例。3 例术前超声诊断主动脉瓣轻—中度关闭不全的患者,术中发现夹层撕裂累积无冠和右冠交界,瓣膜本身活动良好,无增厚、钙化,给予行无冠和右冠交界悬吊后,测试瓣膜关闭良好。1 例术前一侧下肢缺血的患者在缺血侧股动脉插管灌注、孙氏手术后,缺血侧血运恢复,但因为肌红蛋白过高,最高达到36 000 μg/L,出现急性肾功能衰竭,考虑因为肌红蛋白过高阻塞肾小管所致,给予床边血液滤过治疗16 d 后,尿量恢复,出院肾功能恢复正常。另外1 例患者,术前肠系膜上动脉夹层累及,术前腹痛明显,无腹膜刺激征及便血,肠鸣音弱,术后禁食2周,肠鸣音恢复后进流食,半流食,普通饮食,未出现肠道症状,大便通畅。出院前复查主动脉增强CT 均无吻合口漏及迷走锁骨下动脉导致的Ⅱ型内漏。患者心脏彩超示主动脉瓣无明显反流。
患者均密切随访,随访时间6 个月~10 年。随访内容包括患者血压、心率(律)、肝肾功能、心脏彩超、主动脉增强CT(明确有无吻合口漏、迷走锁骨下动脉通畅情况、降主动脉真腔塑形情况)等。患者目前均存活,生命体征平稳。心脏彩超示心功能良好,主动脉瓣未见严重反流,右侧锁骨下血流通畅,降主动脉真腔塑形满意。术后2 年升主动脉到右侧锁骨下动脉转流的人工血管CT图像见图3。
3 讨论
ARSA 于1735 年在尸检中首次发现。ARSA 是由于胚胎发育时右侧第4 主动脉弓和背主动脉在第7 节间动脉头侧短缩所致[3-4],其直接开口于左锁骨下动脉以远的降主动脉,横穿食管和脊柱之间。ARSA 多无症状,约5%的患者有吞咽困难、呼吸困难、胸痛、右上肢乏力等临床表现[5-6]。
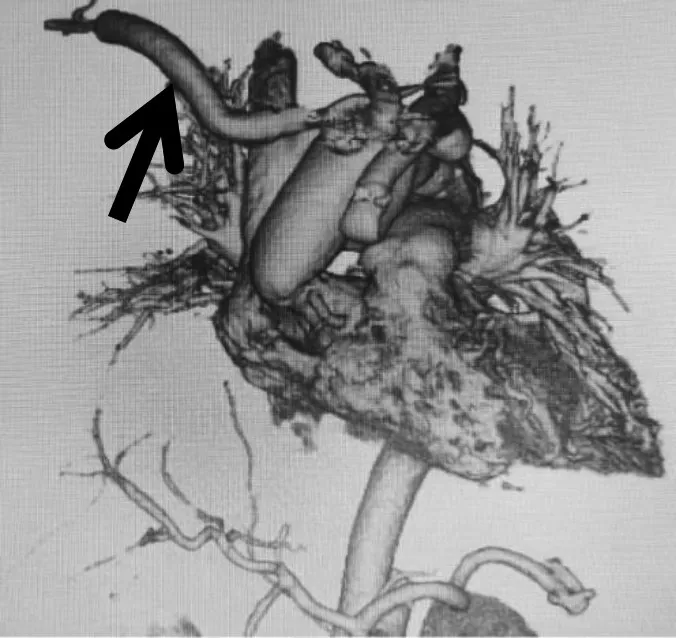
图3 术后2年升主动脉到右侧锁骨下动脉转流的人工血管CT图像
主动脉夹层合并ARSA 较少见。有研究认为,由于ARSA 起于左锁骨下动脉远端主动脉弓或降主动脉,其走行与主动脉弓形成锐角,使ARSA 开口处主动脉壁薄弱、动脉瘤形成,可导致主动脉夹层的发病风险增加[7-8]。原发破口位于ARSA开口的主动脉夹层病例报道并不少见[9-10]。本组病例中,图1 中所示ARSA 附近有破口,也进一步说明ARSA 开口附近有可能是主动脉夹层内膜撕裂的好发部位。
孙氏手术是Standford A 型主动脉夹层标准术氏[11-12]。对于 Standford A 型主动脉夹层合并 ARSA患者目前仍无统一治疗方案。Standford A 型主动脉夹层合并ARSA 患者中存在ARSA,体外循环动脉插管只能从股动脉或者左侧锁骨下动脉进入。由于股动脉解剖容易,因此绝大多数均从股动脉插管建立体外循环。通常认为,由于股动脉近端被夹层内膜堵塞从而导致下肢缺血,如果从股动脉插管灌注,只要股动脉插管位于真腔,可以恢复真腔的血液灌注;插管有侧孔,可以恢复股动脉远端灌注。但是如果灌注时发现升主动脉血压较低,要立刻停止灌注,重新调整股动脉插管位置。我们插管时为了保证插管远端股动脉血运,在股动脉表面行荷包缝合,从荷包中间插管,荷包线套管勒紧后同股动脉插管打结固定,不阻断股动脉插管上下端。另外在完成主动脉远端吻合后,尽早将股动脉插管拔除,转移到四分支血管10 mm 分支处进行腹部脏器及下肢灌注,减少了因为股动脉插管影响下肢缺血的时间。
本组病例中有1例患者术前存在1侧肢体缺血,我们采用进口16 号美敦力带侧孔的股动脉插管从缺血侧插动脉灌注管。手术后,缺血侧血运恢复。但是此例患者术后因为肌红蛋白过高,出现急性肾功能衰竭,考虑因为肌红蛋白过高阻塞肾小管所致,给予床边血滤16 d 后,尿量恢复,出院肾功能恢复正常。
ARSA 的存在增加了Standford A 型主动脉夹层手术治疗的难度和风险。急性Standford A型主动脉夹层合并ARSA 手术治疗的关键在于尽可能消除主动脉夹层破口,切除病变血管壁,重建升主动脉及主动脉弓,同时为了恢复右侧椎动脉及右侧锁骨下动脉血流以防止大脑后循环及右上肢缺血,需要对ARSA 血运进行重建[13-14]。另外,为了防止孙氏手术后降主动脉支架出现Ⅱ型内漏,对于ARSA 近端给予结扎阻断。
急性Standford A 型主动脉夹层合并ARSA 手术治疗中,国内大部分的医院在术中近端结扎迷走右侧锁骨下动脉,切断或者不切断迷走右侧锁骨下动脉。右锁骨下动脉远端与四分叉血管10 mm直径灌注分支行血管行端—端吻合或端—侧吻合[15]。此种方法好处是无右侧锁骨下切口,减少创伤。但是,由于ARSA 直接开口于左锁骨下动脉以远,发自主动脉弓或降主动脉上部,向后向右上方走行气管右后方,此处位置较深术中解剖不易;ARSA表面肌肉较多,如果将ARSA 游离足够的长度来进行吻合,必须将ARSA 表面肌肉全部离断,越往远端肌肉越厚,血管越不容易游离。另外,即使将ARSA 游离出来足够长度进行吻合,由于位置较深,一方面吻合不易;术后一旦吻合口出血,止血非常困难。针对以上情况,我们对于此类手术进行了改进。
手术中由于气管右侧ARSA 走形上方肌肉较厚,一般不能扪及右侧锁骨下动脉搏动。所以,对于A 型主动脉夹层合并ARSA 的患者,我们术前常规留置右侧桡动脉测压管,术中解剖ARSA 时,将ARSA 表面肌肉向后方椎体压迫,如果右侧桡动脉测压管显示为一条直线,则说明此处肌肉下方为ARSA,将此处肌肉解剖开,在肌肉下方即可显示ARSA。另外,由于不需要在此处吻合ARSA,所以不需要将肌肉离断较多,只需要局部离断肌肉,将ARSA 游离出来,原位套线结扎即可,这样减少了手术难度,避免行孙氏手术后在支架内发生Ⅱ型内漏。为了恢复右侧椎动脉及右侧锁骨下动脉血运,将四分支血管的一条10 mm血管引出至右侧锁骨下切口处,同右侧锁骨下动脉行端侧吻合。这样操作比较简便、且安全,术后患者未出现上肢缺血和偏瘫、肌张力减低、谵妄等脑部并发症。
Standford A 型主动脉夹层合并ARSA 的患者术前应明确诊断,这样可以采取合理的动脉灌注及脑保护方法,同时需要评估有无其他弓部畸形。ARSA 存在时,右腋动脉插管脑灌注是无效的,盲目采用腋动脉插管并行脑灌注将导致严重脑部并发症。此时,首选股动脉插管建立体外循环。当鼻咽温降低到28 ℃进行远端吻合时,脑保护采用双侧颈动脉插管行双侧脑灌注技术,插管采用逆行灌注管,一方面因为逆行灌注管软硬度合适,手术中不易打折影响灌注,另一方面逆行灌注管管径较细,插管较容易,而且逆行灌注管本身带球囊,在血管内容易固定,不易脱出。术中采用脑氧监测仪可以减少术后脑部并发症。
临床上发现,急性Standford A 型主动脉夹层向根部撕裂以无冠窦最重,严重者甚至到瓣环处,而右冠窦仅累及靠近无冠窦一部分,左冠窦累及较少,可能与左右冠状动脉开口位置有关[16-17]。对于左右冠状动脉开口周围内膜完整的患者,我们均采用牛心包片在无冠窦补片加血管壁“三明治”缝合的方法,如果夹层向下撕裂导致瓣膜交界撕脱,引起主动脉瓣关闭不全,术中可同时行主动脉瓣交界悬吊成形。如果夹层进一步向下撕裂,深入无冠窦底部,术中根据测定的无冠窦直径及高度,修剪牛心包或者人造血管片成舌头状深入无冠窦底部,覆盖无冠窦内膜,而后从无冠瓣根部左心室面进针间断缝合牛心包片,使整个无冠窦内膜均被牛心包片覆盖。近端主动脉断端行“三明治”加固,内衬人造血管,外面为毛毡条,上端对齐或者稍高于近端血管残端,下端沿着瓣膜交界上方4-0 Prolene 线间断缝合一圈。注意在主动脉根部成形结束后,一定要仔细检查血管条下方的内膜是否完整,而且修复完后要根部加压灌注4 ℃血液,明确是否有出血处。
总之,Standford A 型主动脉夹层合并ARSA 的患者通过一期孙氏手术和合理的ARSA 重建可获得满意的临床效果。但本研究病例较少,有待大样本研究探讨手术效果。

