腹腔镜手术治疗对盆腔炎性包块患者近期疗效、免疫功能、炎性指标及术后复发的影响
李 华,杜晓丽,徐 洪,张 丹,高建宏,郭雪娇,张东明,高金荣,贾西贝
随着病情进展,盆腔发生严重感染,会引起腹膜炎及输卵管、卵巢等粘连,形成炎性包块,进而出现持续性下腹部胀痛、坠痛等[1]。该病较顽固,疼痛症状易反复发作,严重影响患者身心健康及生活[2]。传统开腹手术治疗盆腔炎性包块切口大,患者术后恢复时间较长。腹腔镜手术具有微创、预后好等优点,在临床应用中得到广泛认可[3]。研究发现,盆腔炎性包块患者经腹腔镜手术后,机体炎症反应及应激反应较轻,对患者术后恢复有较大促进作用[4]。本文分析腹腔镜手术对盆腔炎性包块患者近期疗效、免疫功能、炎性指标及术后复发的影响。
1 资料与方法
1.1一般资料 选取2017年12月—2020年12月本院行手术治疗的女性盆腔炎性包块89例。纳入标准:符合盆腔炎性包块诊断标准[5];具有手术指征[6],入院后即行手术治疗。排除标准:患心、脑等重要脏器疾病者;患血液系统、免疫系统等疾病者;有影响免疫功能药物使用史者;合并其他炎症、妇科疾病者;手术禁忌证者。89例据手术方式差异分为观察组42例和对照组47例。2组一般资料比较差异无统计学意义(P>0.05),具有可比性。
1.2治疗方法 观察组采用腹腔镜手术治疗。患者全身麻醉,取头低臀高位。于脐下缘做一约10 mm横切口置入腹腔镜,建立CO2气腹,探查盆腔病灶及周围组织,于下腹部麦氏点及反麦氏点各做一约5 mm切口,置入套管及手术器械。盆腔粘连严重者行盆腔粘连松解术。若患者要求保留生育能力,采用输卵管造口术;若患者对生育无要求,则采用输卵管切除术。手术彻底清除盆腔内脓肿病灶后,使用电凝刀及电切刀剥除包块,常规冲洗盆腹腔。留置引流管后移除气腹针,退出手术器械后逐层缝合切口。术后常规静脉滴注抗生素治疗。对照组采用开腹手术治疗。患者行硬膜外麻醉,取标准盆腔手术体位。于脐耻间腹壁做一约12 cm切口,探查盆腔。合并脓肿者于卵巢与输卵管粘连处分离行输卵管造口术,观察包块大小、数量及毗邻结构,并在包块两侧各做一切口后剥离包块。留置盆腔引流管后逐层缝合关腹。操作及术后处理同观察组。
1.3观察指标 ①临床疗效[7]:术后1周评估疗效。②免疫球蛋白:2组术前1 d清晨空腹及术后12、24 h抽取静脉血5 ml,离心分离血清,采用免疫单扩散法检测免疫球蛋白G(IgG)、免疫球蛋白M(IgM)、免疫球蛋白A(IgA)。③炎性指标:2组术前1 d清晨空腹及术后12、24 h抽取静脉血5 ml,离心分离血清,采用酶联免疫吸附试验检测白细胞介素-10(IL-10)、白细胞介素-18(IL-18)。④淋巴细胞亚群:2组术前1 d清晨空腹及术后12、24 h抽取静脉血5 ml,离心分离血清,应用流式细胞仪检测CD4+、CD8+,并计算CD4+/CD8+值。⑤围术期指标:记录2组手术时间、术后体温恢复时间、术后肛门排气时间、术后血象恢复时间及住院时间。⑥复发情况:随访6个月,记录2组复发情况。

2 结果
2.1近期疗效 术后1周观察组显效23例,有效17例,无效2例,总有效率为95.24%;对照组显效21例,有效17例,无效9例,总有效率为80.85%。观察组总有效率显著高于对照组(P<0.01)。
2.2免疫指标比较 观察组术后12、24 h IgG、IgM、IgA均高于对照组(P<0.05);不同时间点IgG、IgM、IgA水平比较差异有统计学意义,且时间与组别存在交互作用,组间分析差异亦有统计学意义(P<0.05)。见表1。
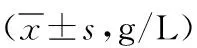
表1 2组盆腔炎性包块患者手术前后免疫指标比较
2.3炎性因子比较 观察组术后12、24 h IL-10水平低于对照组,IL-18水平高于对照组(P<0.05);不同时间点IL-10、IL-18水平比较差异有统计学意义,且时间与组别存在交互作用,组间分析差异亦有统计学意义(P<0.05)。见表2。

表2 2组盆腔炎性包块患者手术前后炎性因子比较
2.4淋巴细胞亚群比较 观察组术后12、24 h CD8+低于对照组,CD4+、CD4+/CD8+水平高于对照组(P<0.05);不同时间点CD4+、CD8+、CD4+/CD8+水平比较差异有统计学意义,且时间与组别存在交互作用,组间分析差异亦有统计学意义(P<0.05)。见表3。

表3 2组盆腔炎性包块患者手术前后淋巴细胞亚群比较
2.5围术期指标比较 观察组手术时间、术后体温恢复时间、术后肛门排气时间、术后血象恢复时间及住院时间均短于对照组(P<0.01),见表4。

表4 2组盆腔炎性包块患者术后恢复指标比较
2.6复发率比较 观察组术后6个月复发率为2.38%低于对照组的14.89%(P<0.05)。
3 讨论
盆腔炎性包块患者全身症状多不明显,有时仅有低热、疲乏感,部分患者可出现精神不振、周身不适或失眠等[8]。对于易反复急性发作且炎性包块较大的患者来说,药物治疗效果不佳[9]。手术是诊治盆腔炎性包块最直观、精确的方法。
本研究结果显示:观察组总有效率显著高于对照组,可见腹腔镜手术治疗盆腔炎性包块的临床效果更佳。IgG、IgM、IgA免疫指标在体内发挥激活补体、中和多种毒素的作用[10]。本研究显示:术后12 h 2组IgG、IgM、IgA水平均下降,但术后24 h观察组IgG、IgM、IgA水平已恢复到治疗前水平,对照组IgG、IgM、IgA水平显著低于观察组。可见腹腔镜手术更有利于患者术后免疫功能的恢复。腹腔镜手术视野广阔,可细致观察到粘连脏器间的关系,也有利于手术医师发现更隐匿的病灶,使得手术治疗更彻底[11]。盆腔炎性包块患者盆腔内纤维粘连索带中含有一定数量细菌,若术中清除不彻底,会导致盆腔炎症再次出现。本研究结果显示,观察组术后24 h IL-10、IL-18已恢复到术前水平,而对照组术后24 h IL-10水平高于观察组,IL-18水平低于观察组。IL-10、IL-18与辅助性T细胞关系密切,二者对微生物感染起调控作用。GONDWE等[12]报道,手术创伤会破坏患者机体T细胞平衡,会出现以Th2型细胞为优势的克隆转换,Th1型细胞分泌受抑制,引起免疫抑制。本研究发现,2组术后CD4+、CD8+、CD4+/CD8+均有变化,但观察组术后12、24 h CD8+均低于对照组,CD4+、CD4+/CD8+水平高于对照组,提示2种手术均会引起盆腔炎性包块患者免疫功能平衡失调。
本研究观察组手术时间、术后体温恢复时间、术后肛门排气时间、术后血象恢复时间及住院时间均短于对照组,是因为开腹手术术中切口直接与外界相通,组织暴露较为充分,加上术中易损伤周围脏器及组织,术后恢复较慢;而腹腔镜手术术中暴露面积小,手术安全性高,术中对盆腔局部脓液清洗彻底[13]。且观察组术后6个月复发率低于对照组,表明腹腔镜手术治疗预防术后复发更为理想。
综上,腹腔镜手术治疗盆腔炎性包块患者效果较理想,对改善患者免疫功能、炎性指标及预防术后复发有重要作用。

