基于PCR-CE技术的NFC橙汁与FC橙汁鉴别
孙瑞雪,邢冉冉,张九凯,葛毅强,张葳葳,陈 颖,
(1.中国农业大学食品科学与营养工程学院,北京 100083;2.中国检验检疫科学研究院,北京 100176;3.中国农村技术开发中心,北京 100045;4.中国农业大学理学院,北京 100083)
随着人们生活水平的提高以及健康意识的增强,纯果汁受到消费者的喜爱[1]。纯果汁分为复原果汁(from concentrate,FC)和非复原果汁(not from concentrate,NFC)两大类。GB/T 31121—2014《果蔬汁类及其饮料》[2]中指出,采用机械方法直接制成的可发酵但未发酵,未经浓缩的汁液制品为原榨果汁即非复原果汁;在浓缩果汁中加入其加工过程中除去的等量水分复原而成的为复原果汁。相比FC橙汁,NFC橙汁因其营养健康和纯天然的特征,更接近甜橙原果品的品质,消费者喜爱度更高,竞争优势日益显现,产业发展也较为迅速。据统计,2017—2018年间,欧盟果汁市场FC果汁销售量降低了2.6%,NFC果汁销售量增加了2.1%[3]。根据欧睿国际公布的2019中国果汁报告显示,2013—2018年间,国内市场NFC果汁的零售量由580万 升增长至4 600万 升,市场销售规模从3亿 元增长至25.7亿 元[4]。当前,NFC橙汁的价格约为FC橙汁价格的2~3 倍[5]。在经济利益的驱使下,不法商贩利用低价FC橙汁冒充高价NFC橙汁进行销售,极大地损害了消费者的利益[6]。因此,开展NFC橙汁与FC橙汁的真伪鉴别方法研究,对保护消费者利益,维护果汁市场秩序具有重要意义。
关于NFC果汁与FC果汁的真伪鉴别,近年来开始成为人们的关注热点,已有利用光谱、电子鼻、稳定同位素质谱、液相色谱-质谱等技术开展的相关研究。如Shen Fei等[7]针对鲜榨橙汁中掺入浓缩橙汁的问题,利用电子鼻和傅里叶变换近红外光谱技术,结合多元数据分析方法,建立了浓缩橙汁与鲜榨橙汁线性判别分析模型,鉴别准确率分别为91.7%和87.5%。Włodarska等[8]利用同步荧光光谱技术,比较分析了市售NFC苹果汁和FC苹果汁的荧光特性,发现非酶褐变产物的荧光信号是区分NFC苹果汁和FC苹果汁的关键因素,结合偏最小二乘判别分析模型,可区分两类苹果汁。此外,近年还有学者利用实时直接分析离子源结合四极杆飞行时间质谱对NFC橙汁和FC橙汁进行了鉴别,偏最小二乘判别分析模型预测集及验证集准确率分别为97%和95%[6]。上述方法在一定程度上实现了NFC果汁和FC果汁的鉴别,但是容易受到原料产地、生产条件、品种以及果汁加工方式、贮藏条件等因素的影响,且不同品牌、批次、地域橙汁差异较大,对方法的准确性造成影响[9]。与基于代谢产物进行分析的方法相比,基于核酸的分子生物学技术由于其判别产物是遗传物质,不受到上述因素的影响[10-11],能够保证判别结果的准确性,已应用于不同品种果汁的鉴别中。例如,柑橘与甜橙的叶绿体亮氨酸-tRNA合成酶-苯丙氨酸-tRNA合成酶间区基因(tRNA-Leu-tRNAPhe gene,TrnL-TrnF)存在8 bp碱基差异,基于该差异相关学者利用聚合酶链反应-限制性片段长度多态性(polymerase chain reaction-restriction fragment length polymorphism,PCR-RFLP)[12]、实时PCR[13-15]等技术为柑橘汁冒充橙汁的问题提供了鉴别方法。然而,由于NFC橙汁属于一种新型果汁,相关的标准出现较晚,尚需不断完善。目前采用分子生物学技术鉴别NFC橙汁与FC橙汁的研究鲜有报道,个别文献仅评价了加热对橙汁DNA完整性影响[16-17],但仍未解决如何鉴别FC橙汁冒充NFC橙汁的问题。
由于NFC橙汁与FC橙汁加工工艺不同,NFC橙汁加工条件往往相对温和,而FC橙汁需经过浓缩、复配、二次杀菌等工艺[18],导致2 类橙汁的DNA降解程度存在差异。因此本研究按照2 类橙汁的主流生产工艺[19-20],选取哈姆林、早金、特洛维塔3 种市场上常见适宜加工的甜橙品种[21],结合自制和市售的NFC橙汁、FC橙汁,通过研究关键加工单元操作对甜橙叶绿体成熟酶K蛋白基因(maturase K,matK)和烟酰胺腺嘌呤二核苷酸脱氢酶基因(nicotinamide adenine dinucleotide dehydrogenase,ndhF)的DNA降解规律的影响,挖掘NFC橙汁与FC橙汁DNA完整性的差异,建立两类橙汁的分子生物学定性鉴别方法,以期为果汁行业有序健康发展及有效监管提供技术支撑。
1 材料与方法
1.1 材料与试剂
特洛维塔、哈姆林、早金3 种甜橙(Citrus sinensisL.Osbeck)橙果由重庆派森百橙汁有限公司提供,产地为重庆忠县;15 种市售NFC橙汁(编号NFC1~NFC15)购自北京连锁超市。
DP320新型植物基因组提取试剂盒 天根生化科技有限公司;高保真Taq酶、高保真Taq酶缓冲液、三磷酸脱氧核糖核苷酸混合液 大连宝生物工程有限公司;无水乙醇 北京六合通公司;5067-1505 DNA 1000试剂盒美国安捷伦公司。
1.2 仪器与设备
Wahlei压榨机 德国Wahlei公司;WZB阿贝折光仪上海精密分析仪器厂;APV-2000均质机 德国APV公司;STEPHAN UM5破碎机 德国Stephan公司;JYZ-V911多功能原汁机 九阳股份有限公司;R308真空旋转蒸发仪 美国Senco公司;1083型恒温振荡水浴德国GFL公司;UHT杀菌机 上海锐元机械设备有限公司;5920R型冷冻高速离心机 德国艾本德公司;涡旋振荡器、MS3芯片混匀仪 德国IKA公司;Veriti 96-Well Thermal Cycler梯度PCR仪 美国应用生物系统公司;2100生物分析仪 美国安捷伦公司。
1.3 方法
1.3.1 样品制备
自制NFC橙汁:3 种不同品种的甜橙果实采摘后,运抵济南果品研究院中式车间。选取新鲜无霉变的橙果,流水冲洗橙皮表面污渍,去皮、切半、破碎后进行榨汁,纱布过滤后制得鲜榨橙汁;利用旋转蒸发仪在室温下进行脱气,再于20 MPa压力下均质得到均质橙汁;最后经巴氏杀菌(80 ℃、10 min)后迅速冷却灌装得到NFC橙汁。
自制FC橙汁:将NFC橙汁置于真空旋转蒸发仪,在60 ℃浓缩至(65±1)°Brix,再加入浓缩过程中去除的等量水分复原,经二次巴氏杀菌(80 ℃、10 min)后冷却灌装制得FC橙汁。
关键加工单元橙汁:收集榨汁、均质、巴氏杀菌(NFC橙汁)、浓缩、二次巴氏杀菌(FC橙汁)关键加工单元橙汁。
1.3.2 橙汁DNA提取及分析
按照天根新型植物基因组提取试剂盒(DP320)说明书提取橙汁样品DNA。使用NanoDrop核酸蛋白分析仪检测DNA的浓度,以A260/A280比值判断DNA纯度。
1.3.3 引物设计
基于甜橙叶绿体matK(GenBank No.AB762345.1)和ndhF(GenBank No.NC_008334)基因序列,采用Primer Premier5[22]软件自行设计了扩增不同长度目标条带的8对引物。采用植物通用扩增引物plant159F/R(来自RuBPCase基因)用以验证提取DNA的质量[23],扩增条带长度为159 bp。以上引物均由生工生物(上海)股份有限公司合成,具体引物序列信息见表1。
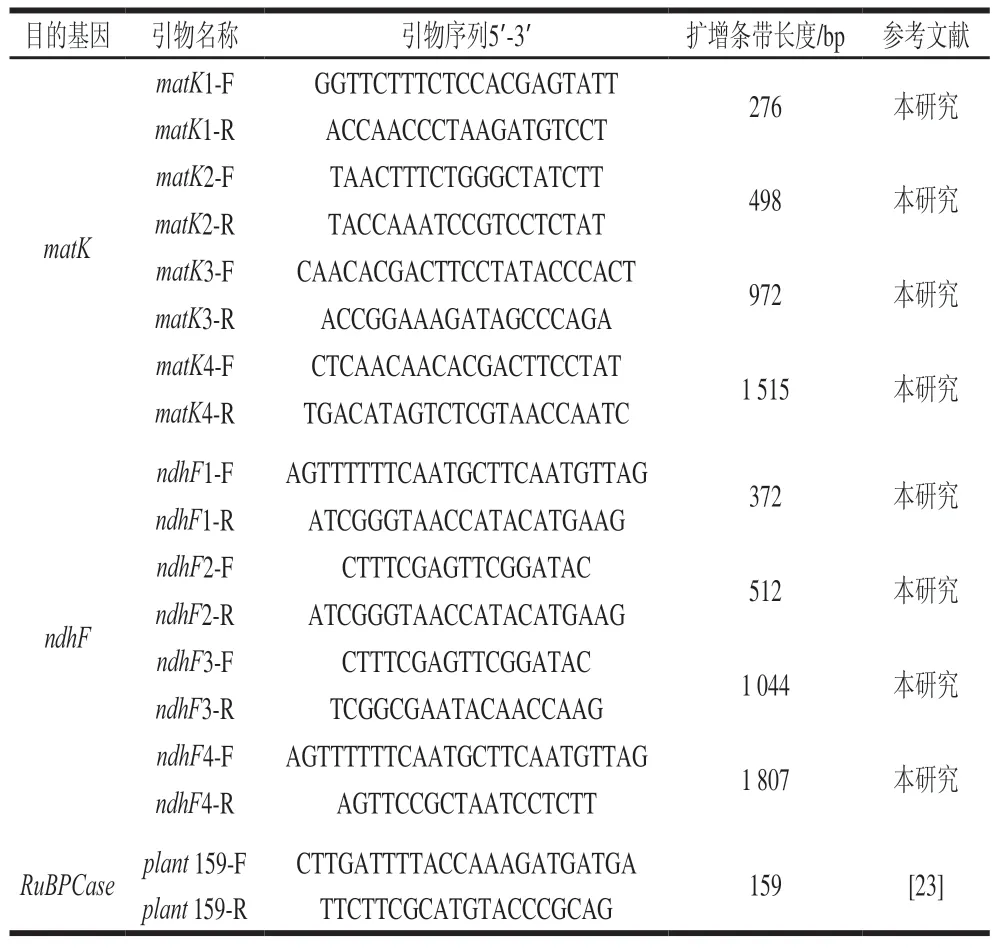
表1 引物序列信息Table 1 Primer sequences for PCR amplification
1.3.4 PCR扩增及产物毛细管电泳(capillary electrophoresis,CE)检测
PCR扩增均采用25 μL反应体系,包括:10×高保真Taq酶缓冲液2.5 μL,三磷酸脱氧核糖核苷酸混合液2 μL,高保真Taq酶0.2 μL,10 μmol/μL上下游引物各0.5 μL,1 ng/μL的DNA模板10 μL,加无菌去离子水至25 μL。matK1-F/R、matK2-F/R、matK3-F/R、matK4-F/R、ndhF1-F/R、ndhF2-F/R、ndhF3-F/R、ndhF4-F/R引物对的PCR扩增反应程序为95 ℃预变性5 min;95 ℃变性30 s,57 ℃退火50 s,72 ℃延伸1 min,共35 个循环;最后72 ℃延伸10 min。通用引物plant159F/R的PCR扩增反应程序为94 ℃预变性5 min;94 ℃变性30 s,55 ℃退火30 s,72 ℃延伸1 min,共40 个循环;最后72 ℃延伸5 min[23]。上述8 组自行设计的引物对分别进行PCR扩增反应后,将matK1-F/R、matK2-F/R、matK3-F/R、matK4-F/R引物对的PCR产物和ndhF1-F/R、ndhF2-F/R、ndhF3-F/R、ndhF4-F/R引物对的PCR扩增产物分别等量混合。使用生物分析仪对混合PCR扩增产物进行CE分析,流程如下:准备注胶平台,加入9 μL核酸凝胶染料制备芯片,在芯片样品孔中各加入5 μL指示条带混合液,分子质量标准孔中加入1 μL DNA分子质量标准溶液,相应标记的样品孔中加入4 μL混合PCR扩增产物。利用芯片混匀仪涡旋混匀1 min后上样分析。
1.4 数据分析
利用SPSS 26.0统计学软件对DNA浓度和纯度进行单因素方差分析,结果表示为,方差分析采用LSD法[24],P<0.05,为有效统计学差异。
2 结果与分析
2.1 目标基因的确定和特征差异性片段组合的筛选
获得高质量DNA是建立NFC橙汁和FC橙汁PCR-CE鉴别方法的基础。本研究中,鲜榨、均质、巴氏杀菌、浓缩、二次杀菌前后关键加工单元橙汁提取的DNAA260/A280值在1.1~1.5之间,质量浓度在4.6~9.17 ng/μL之间(表2)。基于植物通用引物plant159F/R均可扩增出长度为159 bp的目标条带,表明本研究提取的各关键加工工艺中橙汁DNA(表2),适用于后续PCR鉴别方法的研究。
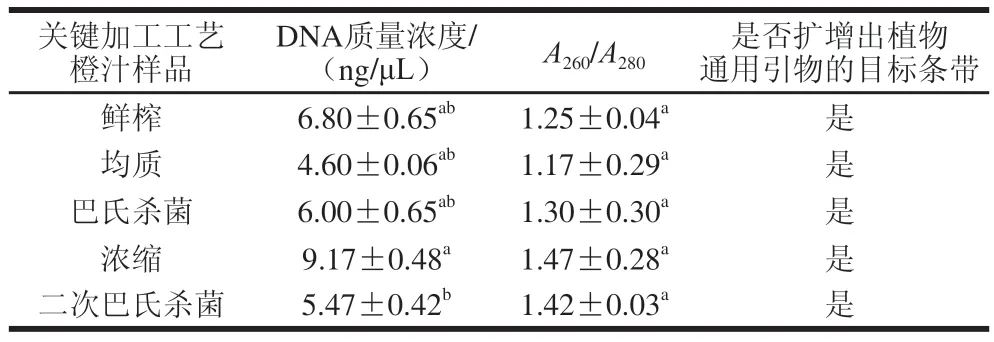
表2 关键加工单元中橙汁提取DNA的浓度和纯度Table 2 Concentration and purity of DNA extracted from orange juice from key processing units
由于NFC橙汁与FC橙汁加工工艺不同,因此会造成DNA降解程度的不同。研究分析橙汁关键加工工艺对DNA降解的影响,阐明NFC橙汁和FC橙汁DNA降解变化情况,能够为从DNA层面实现二者的区分提供依据和方法。本研究以特洛维塔甜橙为研究对象,选取NFC橙汁和FC橙汁加工过程中的榨汁、均质、巴氏杀菌、真空蒸发浓缩、二次巴氏杀菌作为关键加工工艺,采用8 组引物对,对上述关键加工工艺处收集的橙汁样品DNA分别进行不同长度目标条带的扩增,研究不同加工工艺条件对橙汁matK和ndhF基因的DNA降解影响。扩增结果表明,特洛维塔甜橙经榨汁和均质处理得到的橙汁样品DNA,经8 组引物对PCR扩增后,均能得到目标条带(图1),说明榨汁和均质的机械力作用对橙汁matK和ndhF基因的DNA降解影响较小。橙汁经巴氏杀菌处理后,DNA发生降解,无法扩增出matK基因中长度为1 515 bp和ndhF基因中长度为1 807、1 044 bp的目标条带,只能扩增出长度相对短的(972、498、276、512、372 bp)5 条目标条带。说明巴氏杀菌可造成橙汁matK和ndhF基因的DNA降解。橙汁经浓缩处理后,与巴氏杀菌工艺相比较发现,扩增结果基本一致,说明浓缩处理对橙汁matK和ndhF基因的DNA降解影响较小。FC橙汁经二次巴氏杀菌处理后,与巴氏杀菌和浓缩处理比较而言,最大的差别在于长度为972 bp的matK基因目标条带降解至无法检出。由此说明,榨汁、均质及浓缩处理对橙汁matK和ndhF基因的DNA降解影响较小,巴氏杀菌对橙汁2 个基因的DNA降解影响较大,二次巴氏杀菌处理对橙汁matK基因的DNA降解影响较大。本研究结果表明加热会显著影响目的基因的DNA降解,这与文献报道一致,Chen Ying等[25]发现豆乳加工过程中的热处理是导致豆乳DNA降解的关键步骤之一,而均质处理未引起目标DNA条带长度的显著性变化。此外,该现象在其他食品基质中也有发现,研究表明大豆、玉米焙烤及阿胶加工过程中的热处理均会造成其DNA明显程度的降解[26-28]。相比豆乳、玉米等食品基质,橙汁的pH值(3.5~3.8)较低[29],在加热状态下可加速酸催化反应,加剧了DNA的降解程度。
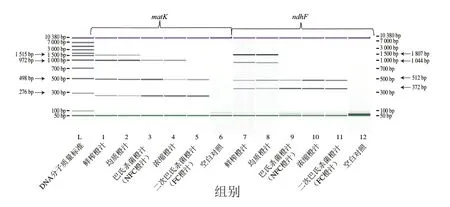
图1 橙汁加工过程中叶绿体基因matK和ndhF不同片段的PCR-CE扩增结果Fig.1 PCR-CE results obtained for different fragments of chloroplast genes matK and ndhF during orange juice processing
在本研究中,ndhF2-F/R和matK3-F/R引物对分别可扩增长度为1 044 bp和972 bp的目标条带。经巴氏杀菌后,长度略短且GC含量较高的matK3-F/R引物对扩增的目标条带仍可检出,而长度略长且GC含量较低的ndhF3-F/R引物对扩增的目标条带无法检出。以往研究结果表明,食品加工过程中,较短DNA片段稳定性大于长的DNA片段[28]。除受目标条带长度影响外,GC含量也是引起DNA降解的重要因素。当DNA片段长度接近时,经高温处理后,GC含量高的片段的稳定性要高于GC含量低的片段。Xing Fuguo等[30]的研究发现,在米饭经过蒸煮之后,GC含量为51.4%的Cry1Ab片段(142 bp)的稳定性明显高于GC含量为50.6%、48.6%的SPS片段(160 bp)和Pubi片段(142 bp)。此外,机械力作用也是引起食品DNA降解的关键因素[31]。本研究中橙汁榨汁和均质处理的机械力强度不大,因此未对橙汁DNA降解产生显著影响[25]。
综上,由于NFC橙汁与FC橙汁经ndhF1-F/R、ndhF2-F/R、ndhF3-F/R、ndhF4-F/R引物对扩增后,均可扩增出ndhF基因中长度为372 bp和512 bp的目标条带,扩增结果一致。而NFC橙汁可分别由matK1-F/R、matK2-F/R和matK3-F/R引物对扩增出甜橙叶绿体matK基因中长度为276、498 bp和972 bp的目标条带,FC橙汁仅可扩增出长度为276 bp和498 bp的目标条带。因此,本研究选取matK基因为目标基因,将matK1-F/R、matK2-F/R、matK3-F/R引物组扩增的长度为276、498、972 bp目标条带作为鉴别NFC橙汁与FC橙汁的特征差异性基因片段组。
2.2 货架期内NFC橙汁与FC橙汁特征差异性片段组稳定性分析
市售NFC橙汁的货架期一般为28 d。在贮藏过程中,乳酸菌发酵引起的pH值降低以及微生物菌落数量增加引起的核酸酶作用增强,会加快DNA的降解速度[31-33]。因此,为研究matK1-F/R、matK2-F/R、matK3-F/R引物组扩增的目标条带能否在保质期内的NFC橙汁中稳定存在,本研究将特洛维塔NFC橙汁与FC橙汁置于4 ℃条件下进行市售NFC橙汁贮藏模拟实验,并分别于0、7、14、21、28 d取橙汁提取DNA后进行PCR扩增。如图2所示,特洛维塔NFC橙汁4 ℃贮藏0~28 d后,其DNA仍可扩增出长度为276、498 bp和972 bp的目标条带,FC橙汁的DNA可扩增出长度为276 bp和498 bp的目标条带。说明在橙汁保质期内,用于区分NFC橙汁和FC橙汁的特征差异性基因片段组可稳定存在,从而避免假阴性结果的产生。
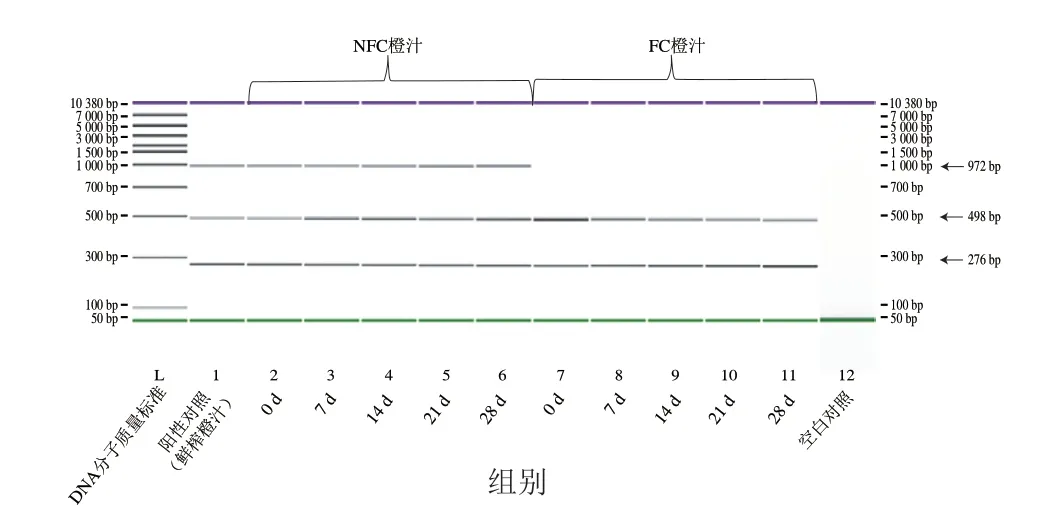
图2 matK1-F/R、matK2-F/R、matK3-F/R引物组对货架期内的特洛维塔NFC橙汁与FC橙汁的PCR-CE扩增结果Fig.2 PCR-CE results obtained for Trovita NFC orange juice and FC orange juice within shelf life with matK1-F/R,matK2-F/R and matK3-F/R
2.3 方法适用性分析
为验证matK1-F/R、matK2-F/R、matK3-F/R引物组扩增的长度为276、498 bp和972 bp目标条带组在鉴别NFC橙汁和FC橙汁中的适用性,本研究选取由特洛维塔、早金及哈姆林3 种甜橙自制的NFC橙汁和FC橙汁,提取DNA后进行PCR扩增。扩增结果显示,阳性对照(鲜榨橙汁)和3 种NFC橙汁均可扩增出长度为276、498 bp和972 bp的目标条带,3 种FC橙汁仅可扩增出长度为276 bp和498 bp的目标条带(图3),说明matK1-F/R、matK2-F/R、matK3-F/R引物组扩增的目标条带组可适用于NFC橙汁和FC橙汁的鉴别。

图3 matK1-F/R、matK2-F/R、matK3-F/R引物对自制NFC橙汁与FC橙汁PCR-CE扩增结果Fig.3 PCR-CE results obtained for NFC orange juice and FC orange juice manufactured in laboratory with matK1-F/R,matK2-F/R and matK3-F/R primers
2.4 市售NFC橙汁样品的检测
采用建立的PCR-CE方法对15 份市售NFC橙汁进行鉴定,结果如表3所示。市售NFC橙汁NFC1~NFC13样品可扩增出276、498 bp和972 bp的目标条带,说明该橙汁样品中检出可表征NFC橙汁存在的特征差异性基因片段组,进而表明NFC1~NFC13样品中存在NFC橙汁成分。而市售NFC橙汁NFC14和NFC15样品仅可扩增出276 bp的目标条带,说明这2 个橙汁样品中无法检出可表征NFC橙汁存在的特征差异性基因片段组,进而表明样品中不含NFC橙汁成分,存在标签不符合的现象。
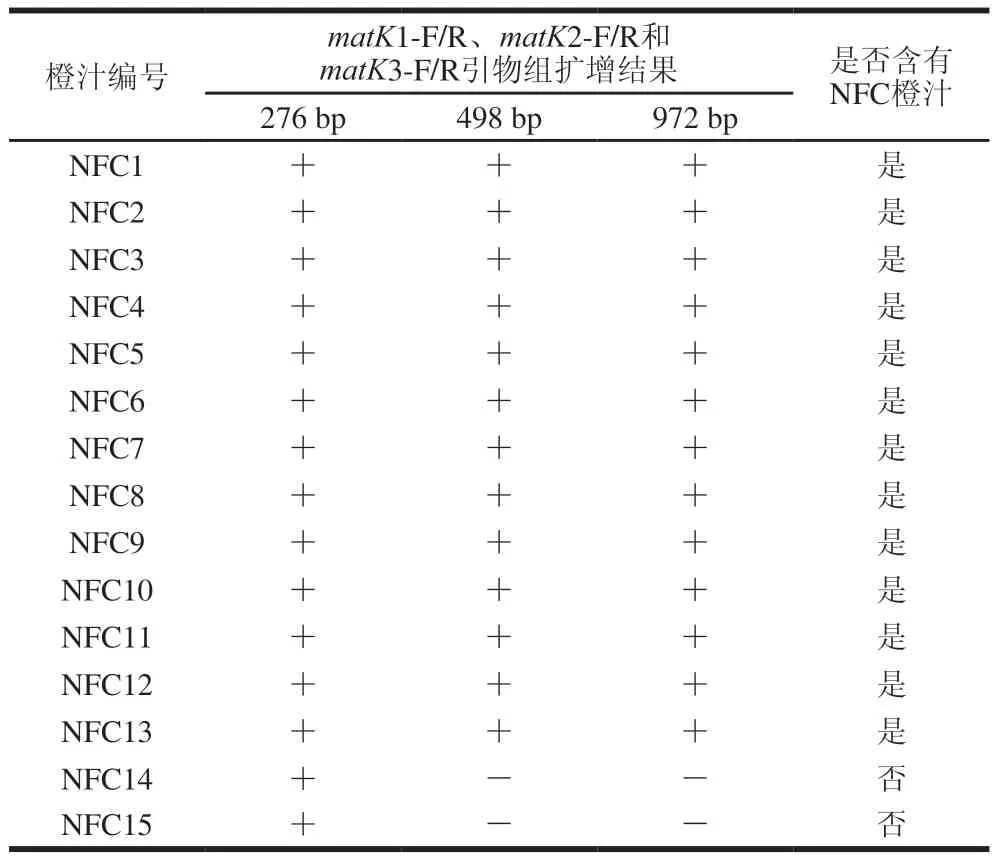
表3 市售NFC橙汁与FC橙汁鉴别结果Table 3 Results of identification of commercial NFC orange juice and FC orange juice
3 结论
以NFC橙汁和FC橙汁为对象,以常规PCR技术为基础,利用不同加工工艺橙汁中叶绿体matK基因的DNA降解程度的差异,建立一种基于PCR-CE技术的NFC橙汁与FC橙汁定性鉴别方法。并对方法的稳定性和适用性进行分析。此外,基于建立的PCR-CE方法对市售NFC橙汁样品进行鉴定,结果发现部分市售NFC橙汁存在标签错误的问题。本研究可为FC橙汁、橙汁饮料完全冒充NFC橙汁等掺假问题的评判提供解决方案,为NFC橙汁的品质评价和真伪鉴别提供技术支撑。后续可将新型热杀菌和非热杀菌等不同杀菌方式均纳入研究范围,并开展NFC橙汁含量定量检测研究,以进一步完善NFC橙汁真伪检测方法,为有效监控NFC橙汁质量提供科学依据。

