仙人掌多糖提取、纯化、结构表征及生物活性研究进展
杨 艳 周 欣,2 陈华国,2
(1. 贵州师范大学贵州省山地环境信息系统与生态环境保护重点实验室,贵州 贵阳 550001;2. 贵州师范大学贵州省药物质量控制及评价技术工程实验室,贵州 贵阳 550001)
仙人掌(OpuntiadilleniiHaw.)是仙人掌科缩刺仙人掌的变种,具有行气活血、清热解毒、消肿止痛、健脾止泻、安神利尿等功效,是一种药食两用植物[1-2]。仙人掌含有多种化学物质,如生物碱、黄酮类、多糖、酚类、微元素等[3],其中多糖作为仙人掌的主要活性成分之一,可从仙人掌茎和果实中获取。根据提取方法不同,仙人掌多糖得率会有差异。近年来,仙人掌多糖因具有免疫调节、抗氧化、抗炎、保肝、抗肿瘤、降血脂血糖等生物活性备受科技工作者的关注。文章拟对仙人掌多糖提取、纯化、结构表征及生物活性等方面的研究情况进行综述,以期为其深度开发与利用提供依据。
1 仙人掌多糖的提取与分离纯化
多糖是一类大分子物质,具有良好的生物活性,且无明显毒副作用,因而具备良好的开发利用潜质,是新型保健食品和医药产品的潜在优质原料源[4]。仙人掌多糖提取方法主要有热水法[5]、酸法[6]、酶法[7]、超声波法[8]、微波辅助法[9]、微生物法[10]等,各类提取方法的得率和优缺点见表1。热水法与酸法的提取原理相似,通过热水或者酸性溶液使细胞壁破裂,释放多糖[14]。焦伟艳等[15]采用热水法浸提野生仙人掌多糖成分,冷冻干燥后多糖得率为6.61%。酶法、超声波法及微波辅助法分别是通过酶破环细胞壁和细胞膜、超声波破壁及微波加热破壁的原理提取仙人掌多糖[16]。
通过表1中方法提取的仙人掌粗多糖中常含蛋白质、色素及小分子物质等杂质,需对其分别除去。仙人掌粗多糖中的蛋白常用Sevag法(氯仿—正丁醇)、三氯乙酸法、酶法、等电点法等除去[17]。三氯乙酸法是仙人掌粗多糖中最常用的提取方法,具有效率高、用量少等优点,但高浓度的三氯乙酸会加快多糖的降解,破坏其结构,因此一般选择质量浓度为3%~5%比较合适。当使用3%的三氯乙酸时,多糖损失率仅为5.98%;Sevag法虽成本低、适用范围广,但需要重复多次才能除去多糖中的蛋白质,随着次数的增加多糖损失率也随之增加,处理7次多糖损失率高达36.92%,此时蛋白仅除去了58.30%,且氯仿有毒,溶剂残留物可能会造成多糖活性的下降;与前两种方法相比,等电点法反应条件较温和,当pH 3.5时多糖损失率仅为1.67%,但仙人掌多糖的抗氧化活性却不及Sevag法和三氯乙酸法[18]。相较其他3种方法,酶法虽然耗时,但其作用条件温和,不易破环多糖活性,无有机试剂造成的危害,且随着酶浓度的增加,多糖损失变化不大[19],是一种较为理想的脱蛋白手段。仙人掌粗多糖脱色素一般可用双氧水脱色法和树脂脱色法,而不用活性炭,因为活性炭不仅吸附色素也会吸附多糖[20];石油醚一般用于脱脂,但也可除去部分色素;利用树脂可以除去仙人掌粗多糖中的色素,主要是因为其具有较强的吸附力,且多糖损失较少[21]。
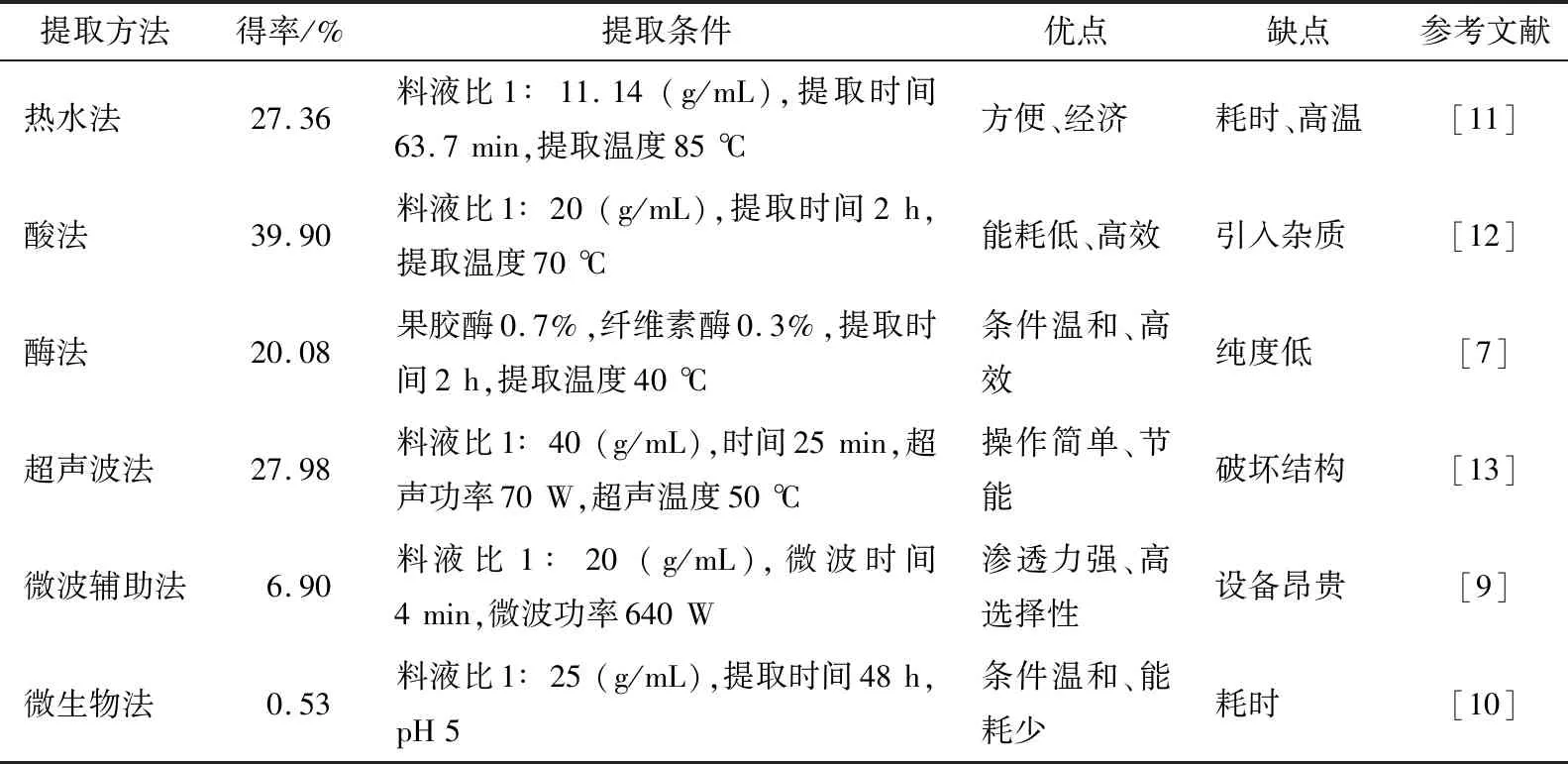
表1 仙人掌多糖不同提取方法及其优缺点Table 1 Different extraction methods of Opuntia dillenii Haw.polysaccharides and their advantages and disadvantages
为了能够更准确分析仙人掌多糖的分子量、单糖组成及糖苷键构型等信息,在上述纯化的基础上需对仙人掌粗多糖进一步分离纯化,以获得均一多糖。通常情况下,仙人掌多糖可用离子交换层析法和凝胶层析分离法获取均一多糖。离子交换层析法主要是以DEAE-52、DEAE-Sepharose Fast Flow、DEAE-Sepharose A-25等为固定相,NaOH溶液或者NaCl溶液为流动相,按1 mL/min的流速进行洗脱,使仙人掌多糖溶液中残留的蛋白、色素等杂质与多糖溶液分离,获得纯度较高的仙人掌多糖[22];凝胶层析分离法是以SephadexG-75、SephadexG-100、SephadexG-200、Sephadex S-400等为固定相,NaOH溶液或者NaCl溶液为流动相,18 mL/h进行洗脱,使多糖大分子与无机盐等小分子进行分离,得到纯度更高的仙人掌多糖。朱苗[17]采用水提法获得野生仙人掌粗多糖,通过DEAE-Sepharose Fast Flow(2.5 cm×30 cm)的离子交换层析柱,利用NaCl溶液进行连续梯度洗脱和分布洗脱的方式,得到多糖纯度高的仙人掌多糖溶液,浓缩,醇沉,沉淀冷冻干燥,得到多糖组分ODP-Ⅱ;ODP-Ⅱ溶液通过Sephadex S-400(1.6 cm×100 cm)凝胶层析柱,0.05 mol/L NaCl溶液分步洗脱后,得到分子量均一的多糖。林爱琴等[23]将已脱蛋白的多糖溶液过DEAE-Sepharose A-25柱(1.5 cm×30 cm),采用0.1 mol/L NaCl溶液等度洗脱后再进行梯度洗脱,得到OPA、OPB两个级分,将其透析、醇沉后,沉淀经过无水乙醇和丙酮洗涤,干燥,得到纯度为92.20%和86.91%的OPA、OPB两个多糖组分。陶美华等[24]将仙人掌粗多糖溶液先经过离子交换柱分离后,又利用SephadexG-75、SephadexG-200凝胶滤过柱再次分离,得到ODP1、ODP2、ODP3、ODP4、ODP5 5个多糖组分,通过醋酸纤维薄膜电泳法对其进行鉴定,发现电泳结果均为单一区带。仙人掌多糖提取与分离纯化的基本思路与流程图见图1。

图1 仙人掌多糖的提取纯化Figure 1 Extraction and purification of Opuntia dillenii Haw.polysaccharides
2 仙人掌多糖的结构表征
多糖结构分为初级结构和高级结构,初级结构主要关注主链和支链的组成,而高级结构则涉及主链间的构象及多糖间非共价键作用[25-26]等。目前,由于受分析手段与技术的限制,仙人掌多糖结构表征主要是从初级结构方面开展相关研究,即从总糖含量、杂质测定、分子量大小及分布、单糖组成及摩尔比、糖苷键类型等角度展开。涉及的方法和技术主要包括红外光谱(IR)、核磁共振波谱(NMR)、高效液相色谱(HPLC)、气相色谱(GC)、气相色谱—质谱(GC-MS)、甲基化分析、完全酸水解、部分酸水解和Smith降解[27-28]等。高级结构主要涉及超分子结构、在溶液中构象、网状结构等方面,测定方法主要有X射线衍射法、荧光相关光谱、分子模型的构建、原子力显微镜法[29-30]等。目前,关于仙人掌多糖高级结构的研究鲜有报道,为了更好、更全面地发挥仙人掌多糖的潜在价值,后续可对其进一步深入探讨。
2.1 含量测定
目前,多糖含量测定方法主要有蒽酮—硫酸法、苯酚—硫酸法、比色量法、原子吸收法、HPLC法、酶法、DNS(还原)法、离子交换色谱法[31]等。苯酚—硫酸法和蒽酮—硫酸法具有操作简单、检测速度快等特点,被广泛应用于各种研究中[32-33]。何火聪等[34]研究表明,苯酚—硫酸法的稳定性、精密度及回收率均高于蒽酮—硫酸法,是测定仙人掌多糖含量的理想方法,但苯酚易氧化,操作时应快速且避光保存。赵龙岩等[8]采用双酶法提取仙人掌多糖,苯酚—硫酸法测定多糖含量,为83.02%。Wu等[35]对热水法提取的仙人掌多糖除蛋白后,利用5 000 Da 滤膜对仙人掌粗多糖进行过滤,苯酚—硫酸法测得其总糖含量为91.46%。
2.2 杂质测定
仙人掌多糖常含有蛋白质、多酚、氨基酸、多肽、低聚糖、色素、生物碱、核酸等杂质,不仅对其质量和纯度有影响,还会影响后续的纯化、结构测定及生物活性。多糖中蛋白质含量一般可采用考马斯亮蓝G-250法和紫外检测法进行定量和定性测定,朱苗[17]采用离子柱层析法除去仙人掌粗多糖中蛋白质后,经SephacrylS-400凝胶柱后,得到分子量均一的ODP-Ⅱa和ODP-Ⅱb两个多糖组分,且260,280 nm处均无特征峰出现,说明不含氨基酸、蛋白质、多肽等杂质。多酚作为仙人掌的主要活性成分之一,常采用溶剂提取法获得,仙人掌多糖提取过程中,石油醚脱脂时可除去大部分色素和多酚类物质,剩余部分多酚类物质可用分光光度法对其测定;严赞开[36]采用分光光度法测得仙人掌中多酚含量为71 mg/kg,目前,有关仙人掌多糖中多酚含量的测定尚未见报道;张郁松[37]利用活性炭、Sevag法、透析对仙人掌粗多糖中的色素、蛋白质及小分子物质进行处理,经淀粉试验、双缩脲试验、茚三酮试验后发现,该样品中不含淀粉、多肽、氨基酸等杂质,含少量蛋白质,通过生物碱鉴定和甾体化合物鉴定后,发现不含生物碱和甾体化合物。陶美华等[38]对仙人掌粗多糖进行杂质定性和定量测定,其蛋白质含量为9.86%,核酸含量为7.35%。
2.3 分子量测定
目前,测定多糖分子量的方法主要有HPLC、高效凝胶色谱法(HPGPC)、高效凝胶过滤色谱法(HPGFC)、聚丙烯酰胺凝胶电泳法、超滤截留法[39]等。金鑫等[40]利用SephacrylS-400柱对水提仙人掌粗多糖进行纯化后,通过HPGPC测定其相对分子量为1.25×105Da;郭燕娇等[41]采用DEAE-纤维素离子交换层析柱对水提醇沉的多糖溶液进行分离纯化,得到OPS-1、OPS-2、OPS-3 3个多糖组分,经HPGFC检测到分子量分别为1.25×105,1.98×105,4.31×104Da;林爱琴等[23]通过DEAE-SephadexA-25分离得到两个级分OPA、OPB,经高效液相色谱和聚丙烯酰胺凝胶电泳发现两个级分均为单一组分,且分子量分别为3.64×105,1.68×105Da;Cai等[42]利用离子交换层析柱和凝胶层析柱分离纯化得到3个多糖组分,经HPGFC检测到WSP-1、WSP-2a、WSP-3重均分子量分别为2.32×106,1.24×106,7.92×106Da。
2.4 单糖组成及摩尔比
单糖组成常用的测定方法有HPLC、GC、毛细管电泳法等;其中GC和HPLC是确定单糖组成和含量最有效的方法[43]。仙人掌多糖主要由阿拉伯糖、木糖、甘露糖、果糖、葡萄糖、糖醛酸及鼠李糖等聚合而成[42,44]。郭燕娇等[41]通过DEAE-纤维素柱分离仙人掌粉末得到OPS-1、OPS-2、OPS-3 3个多糖组分,其中OPS-1主要由葡萄糖、木糖、阿拉伯糖组成,其比例为1.5∶12.9∶1.0;OPS-2由甘露糖、鼠李糖、葡糖糖醛酸、半乳糖醛酸、木糖、阿拉伯糖、葡糖糖组成,比例为1.0∶15.6∶1.0∶2.4∶8.2∶41.6∶36.3;OPS-3由葡糖糖、鼠李糖、木糖、阿拉伯糖组成,比例为1.0∶2.4∶1.4∶1.4。赵倩[45]通过热水浸提法提取梨果仙人掌茎粗多糖,经HPLC发现梨果仙人掌多糖主要由葡糖糖、阿拉伯糖、半乳糖、鼠李糖、半乳糖醛酸、岩藻糖、甘露糖、葡糖糖醛酸、核糖、甘露糖醛酸、氨基葡糖糖、半乳糖胺、木糖组成。
2.5 结构测定
与其他植物多糖的测定类似,仙人掌多糖水解衍生化后,可利用HPLC、UV、IR、GC-MS、1H-NMR、原子力显微镜(AFM)等现代科学技术[46],对其单糖组成、糖苷键构型及连接方式等结构进行表征。郭燕娇等[41]发现仙人掌多糖的单糖组成和分子量受产地、提取方法以及纯化柱料影响,但通过PMP柱前衍生化HPLC法后,不同组分的仙人掌多糖中均含有葡萄糖、木糖、阿拉伯糖3种单糖。朱苗[17]将分离纯化后的仙人掌多糖-Ⅱa进行碘—碘化钾反应,发现仙人掌多糖中分支少且侧链较短,刚果红试验表明,仙人掌多糖-Ⅱa不具有三螺旋结构。Xlsabc等[30]通过IR、NMR及GC-MS等仪器分析,得到WSP2a的糖苷键构型主要是b型,单糖中以1→2或1→4键的糖基较多,鼠李糖则以1→3糖基存在,通过AFM观察到仙人掌粗多糖呈聚焦状态,部分呈丝网状,且具有良好的成膜性能。目前,针对仙人掌多糖结构表征的相关研究不多,但整体而言,多糖结构的测定仍处于探索阶段,手段还不够成熟,存在诸多不足,如多糖自身分子量较大,紫外吸收困难,纯化后缺乏定性定量分析的对照品等,这在一定程度上限制了仙人掌多糖的开发与利用。
3 仙人掌多糖的生物活性
近年来,多糖在食品、医药、农业和化妆品行业的发展中有着重要的应用前景。仙人掌作为一种可食用和药用的植物,其多糖成分具有多种重要的药用和食用价值。目前,对其关注的焦点主要在免疫调节[47-48]、抗氧化[11,49]、降血糖[50]、降血脂[51]、抗肿瘤[52]、抑菌[10]、抗炎[53]及保肝[54]等方面。由于受当前提取技术的限制,仙人掌多糖纯度不高,即使是通过不同技术手段纯化后仍有少量杂质存在,这类杂质的存在是否影响仙人掌多糖的生物活性尚不明确。仙人掌多糖生物活性及其作用机制见图2。
3.1 免疫调节作用
仙人掌多糖可以通过提高胸腺指数、脾脏指数和淋巴细胞转化率来增强免疫功能[47],李恒等[48]以RAW264.7细胞为研究对象,对TLR4-My88信号通路进行研究发现,仙人掌多糖可以促进TLR4高表达,活化TRAF6、IKKb、MyD88蛋白因子的表达,从而增强机体免疫力。张松莲等[55]通过对糖尿病小鼠灌胃野生仙人掌多糖发现,野生仙人掌多糖能够通过减少小鼠血清NO含量,提高IgM、IgG含量和促进T、B淋巴细胞增殖,避免胰岛b细胞损伤,使CD4+/CD8+T细胞恢复正常比值,从而提高糖尿病小鼠免疫力。Schepetkin等[56]发现,多刺仙人掌多糖不仅无细胞毒性,还能激活巨噬细胞,将多刺仙人掌多糖作用于小鼠和人单核/巨噬细胞后,细胞活化产生的TNF-α和iNOS可进一步激活NF-κB通路,通过激活NO、活性氧及NF-κB,从而增强免疫能力。
Zhao等[57]通过免疫抑制小鼠模型发现仙人掌多糖是一种良好的免疫调节剂,可以促进IgM、IgG的生成和降低CD4+/CD8+的比值,使T、B淋巴细胞增殖能力恢复正常,增强小鼠的特异性免疫能力。
3.2 抗氧化作用
生物体代谢过程中会产生各种氧自由基,过多的氧自由基及其诱导的氧化反应会损害各个组织器官,诱导糖尿病、阿尔茨海默病和心脏病等疾病产生[58-59]。目前,大部分抗氧化剂都是合成的,具有潜在的副作用,仙人掌多糖作为一种天然抗氧剂,毒副作用小,深受研究者的欢迎。Yang等[11]利用DPPH法评价不同纯度仙人掌多糖的抗氧化能力,随着多糖纯度从27.36%增加到90.12%,其IC50值显著下降,说明仙人掌多糖具有显著的抗DPPH自由基能力。Li等[49]证实了仙人掌多糖不仅可以显著清除DPPH自由基,对超氧阴离子自由基和羟自由基的清除效果也非常显著,且呈剂量关系。徐丛玥等[60]对酶提取法、热水提取法及超声波提取法得到的仙人掌多糖进行体外抗氧化试验发现,不同提取方法间抗氧化能力差异较大,其中酶提取法的粗多糖得率为10.14%,是超声波提取法和热水提取法的5倍;其抗肝组织自发性脂质过氧化能力、清除羟基自由基能力、清除超氧阴离子能力、清除DPPH自由基能力、总还原能力、总抗氧化能力均高于后两种方法,可能是不同提取方法获得的仙人掌多糖的单糖组成和结构存在差异性,导致多糖结构发生变化,进而影响其活性作用。
3.3 降血糖作用
糖尿病是现代社会最常见的代谢性疾病之一。中国糖尿病的预防及控制状况仍较为严峻[61],用于治疗糖尿病的药物不仅昂贵还有潜在的副作用。近年来,许多天然植物源药物由于毒副作用小被广泛用于糖尿病的治疗中[62]。马东升等[50]以2型糖尿病大鼠为试验对象,灌胃仙人掌多糖后,大鼠摄食量和饮水量显著减少,随着多糖浓度增加,其体重与其他组存在显著性差异,通过对肝脏系数测定后发现,大鼠肝糖原分解代谢增加,肝脏系数相对减低,说明仙人掌多糖可能通过改善肠道的菌落生态环境,延迟肠道对碳水化合物的吸收和利用,从而显著降低糖尿病大鼠的血糖。Gao等[63]利用链脲佐菌素(STZ)诱导糖尿病小鼠,仙人掌多糖干预后,活性氧清除能力和抗氧化酶活性显著提高,保护肝组织免受过氧化损伤,显著控制小鼠的血糖和血脂水平。Li等[64]发现仙人掌多糖可以通过上调Nrf2及其下游蛋白的表达,降低氧化应激,使INS-1细胞活力和SOD、GSH活性显著恢复,乳酸脱氢酶(LDH)释放量和活性氧(ROS)、NO、MDA水平显著降低,阻止了b细胞凋亡,有效预防与糖尿病相关的氧化应激。综上,仙人掌多糖是一种潜在的预防和治疗高血糖的天然药物源和功能食品。
3.4 降血脂作用
高血脂是人体内脂质代谢失常,血浆中某些脂质成分异常升高的一种疾病,严重可引起高血压、冠心病、脑血管病等[65]。目前,西药已成为治疗高血脂疾病的常用药物,这些药物短时间内会有良好的治疗效果,但长期服用会出现抗药性、毒副作用等。而传统中草药却很少存在这样的问题,且在治疗高血脂症方面已有一定成就。Zhao等[51]对高血脂大鼠灌胃不同剂量的仙人掌多糖,当剂量为400 mg/kg时,抗氧化酶的活性显著提高,MDA含量显著降低,可调节胆固醇酰基转移酶(LCAT)和HMG-CoA还原酶活性使胆固醇降低,大鼠肝脏总胆固醇(TC)和甘油三酯(TG)水平显著降低,推测仙人掌多糖降低大鼠血脂主要是通过提高抗氧化酶和还原酶的作用实现的。李莉梅等[43]发现仙人掌多糖降血脂的机制可能是通过抑制3-羟基-3-甲基戊二酸单酰辅酶A还原酶(HMG-COA还原酶)活性,减少机体对脂类的吸收和脂质过氧化,从而达到降血脂作用。目前,针对仙人掌多糖降血脂的作用机制处于试验阶段,随着对仙人掌多糖结构的深入研究,可更深入研究其降血脂机理,拓展其应用领域。
3.5 抗肿瘤作用
目前,癌症的治疗主要通过手术和放射性治疗两种手段,这严重损害人体健康。天然药物因毒副作用小成为治疗肿瘤的研究热点,不同种类科属植物的抗肿瘤机制具有多面性,不同种属之间无显著差异[66]。仙人掌作为天然药物历史悠久,其多糖对肿瘤具有较好的活性。殷姿等[52]将仙人掌多糖对卵巢癌大鼠进行干预后,Bcl-2、PI3K、Akt、PTEN、p-Akt、mTOR表达明显受到调控,当多糖剂量升至60 mg/kg时,可显著促进卵巢癌组织细胞凋亡,阻滞癌组织周期。车加祥等[67]将仙人掌多糖作用于人肺癌A549细胞,测定IC50值和生长曲线发现,癌细胞凋亡数目有明显变化,当多糖质量浓度为597.549 μg/mL时,抑制A549细胞作用最强,能够显著诱导其发生细胞凋亡。孙超等[68]发现仙人掌多糖还可以显著抑制胃癌SGC-7901细胞和大肠癌Lovo细胞增殖,当仙人掌多糖质量浓度为20 μg/mL时对其生长抑制率最高。李涛等[69]通过MTT法测定仙人掌多糖对人乳腺癌MCF-7细胞增殖的抑制率,随着仙人掌多糖浓度增加,抑制率随之提高,当质量浓度为40 mg/L时,抑制率达78.7%。吴迪等[70]发现仙人掌多糖对SK-MES-1肺磷癌细胞具有一定的抑制作用。仙人掌多糖对SK-MES-1肺磷癌细胞抑制效率不高,可能与仙人掌多糖纯度、作用机制及细胞性质有关。大量研究表明,植物多糖对癌症患者具有较好的治疗效果,是目前较为理想的一种抗癌药物,与其他植物多糖相比,仙人掌拥有较长的药用历史,且其多糖成分对肺癌[67,70]、胃癌[68]、乳腺癌[69]等癌细胞凋亡具有显著促进作用。
3.6 抑菌、抗炎作用
在民间,仙人掌常被用于外服消炎,而《本草纲目拾遗》中也有记载,其具有消肿止痛的功效。袁海娜[71]采用水提醇沉法制备仙人掌多糖,通过管蝶法和混合涂布法发现,仙人掌多糖对食品中常见的大肠杆菌(E.coli)、金黄色葡萄球菌(S.aureus)、酿酒酵母(S.cerevisiae)、青霉(P.frequentans)具有抑制作用,受仙人掌形态的影响,抑制效果无差异。整体而言,仙人掌多糖可显著抑制S.aureus和S.cerevisiae的生长和发展,但对E.coli效果不明显。郭庆启等[10]利用微波辅助提取仙人掌多糖发现,其对E.coli具有明显的抑制作用。不同的提取方式可能会使仙人掌多糖组成和结构存在差异,导致多糖抑菌机制不同,故出现了两者试验结果相反的情况,具体抑菌机制还需进一步阐明。戴小华等[72]通过小鼠耳肿胀法和大鼠足肿胀法发现,仙人掌粗多糖可以显著抑制炎症反应,且高剂量的作用效果更加明显。程秀峰等[53]将梨果仙人掌茎多糖作用于炎症小鼠,通过对小鼠足肿胀及血浆中炎症因子含量的测定发现,随着多糖剂量从100 mg/kg升至400 mg/kg,IL-1β、IFN-γ、TNF-α炎症因子的表达水平降低,说明梨果茎多糖能有效抑制炎症发展,且呈一定的量效关系。
3.7 保肝作用
肝脏对机体尤为重要,长期的肝损伤可导致肝纤维化、肝癌,甚至肝功能衰竭。目前,治疗肝损伤的药物主要是核苷类、护肝降酶药等化学药物,患者服用后容易形成依赖且存在一定的副作用[73]。因此,寻找一种安全、无毒副作用的药物成为目前治疗肝损伤的重点和难点。喻宁华等[54]对CCl4造成的急性肝损伤小鼠灌胃仙人掌多糖,通过血清和肝组织病理学检测,小鼠血清中ALT和AST活性显著降低,可减轻肝组织的病理变化;肝匀浆后,仙人掌多糖可以提高 GR、GST、GSH-Px等酶活性,维持细胞膜的正常结构,阻止脂质过氧化反应,从而有效发挥护肝作用。目前虽有报道称仙人掌多糖有显著的护肝功效[74],但其作用机制不够成熟,后续可以增加肝损伤的其他模型,从多方面、多角度对仙人掌多糖进行研究,发展仙人掌多糖潜在的药理和功能食品的价值。
3.8 其他作用
仙人掌多糖除了具有免疫调节、抗氧化、抗肿瘤等作用外,在保护神经组织和DNA损伤领域也发挥重要作用。王海涛等[75]通过血红细胞(RBC)溶血试验及彗星试验对细胞膜和DNA损伤度进行测定,米邦塔仙人掌多糖干预后,抑制十二烷基硫酸钠(SOD)致损细胞膜和DNA损伤的作用与剂量呈明显的量效关系。杨钧勇等[76]发现米帮塔仙人掌多糖对小鼠认知功能损伤有一定的改善作用,通过不同剂量的仙人掌多糖作用于小鼠慢性应激组,随着浓度增加,小鼠认知功能明显改善,同时BDNF蛋白的表达也明显增加,说明仙人掌多糖干预后,通过上调BDNF蛋白的表达可改善认知功能损伤。唐焜等[77]对缺血—再灌注损伤的大鼠模型灌注仙人掌多糖,当仙人掌多糖剂量为200 mg/kg 时,大鼠脑梗死体积减少,海马神经元丢失显著减少,减轻脑组织的形态学损伤,从而发挥神经保护作用。陈扬[78]建立了整体脑缺血复灌模型和离体原代培养神经元氧糖剥夺(OGD)模型,仙人掌多糖干预后,对ODG引起的神经元损伤有一定的减轻作用;经神经行为学和组织学评价发现小鼠学习障碍得到改善,且NMDAR2B、NMDAR1和BDNF蛋白表达水平提高,从而对缺血性脑损伤起到保护作用。
4 结论及展望
近年来,仙人掌被国内外研究者日益重视,其多糖成分的许多生物活性及功能也逐渐进入大众视野。随着对仙人掌多糖的提取、分离纯化、结构表征及生物活性的深入研究,取得了很大的进展,同时也存在很多亟待解决的问题:① 目前仙人掌多糖的提取技术形式单一,不同提取方法得到的多糖分子量及单糖组成差异明显。② 仙人掌多糖的空间结构与其生物活性密切相关,其多糖结构与生物活性的构效关系尚需揭示。③ 尽管仙人掌多糖在体内、体外研究模型中表现出免疫调节、抗氧化、抗肿瘤、降血糖、血脂、保肝等多种生理功能,但其作用的量效关系及作用机制仍需深入研究。

