硼掺杂管状g-C3N4的制备及其光催化性能
王禹程,蔡天凤,赵 华,李会鹏,刘泽田
(辽宁石油化工大学 石油化工学院,辽宁 抚顺 113001)
氮化碳基光催化剂制备简单、催化性能好、成本低廉[1-2],成为光催化研究的主流方向之一[3]。石墨相氮化碳(g-C3N4)的光响应范围很宽[4]、无毒无害[5],且具有多方面的应用,如制取氢气[6]、降解有机物[7]。传统的光催化剂多为贵金属催化剂,成本较高[8],而碳氮两种元素在地球上储量丰富,降低了制备成本。这使得氮化碳基光催化剂的发展潜力很大[9]。但传统方法制备的g-C3N4存在光生载流子复合率高[10]、活性位点少[11]、制备时间长等缺点,因此对g-C3N4基催化剂改性成为重中之重。
对g-C3N4改性的方法有很多,包括元素掺杂[12]、构建异质结[13]、形貌调控等[14]。元素掺杂是一种简单易操作的改性方法,非金属元素硼可以被引入到g-C3N4的结构框架中,并减小g-C3N4的带隙,进而吸收更多的可见光[15]。同时,作为典型的缺电子元素,硼元素掺杂提高了对电荷的结合力,进而降低了电子空穴对的复合率。而形貌调控可以获得具有更好空间结构和更多活性位点的光催化剂,如具有特殊空间结构的纳米片、纳米管、空心球等[16]。形貌调控可以在合成阶段介入,一方面改良了合成路径,缩短了合成时间,优化了合成步骤;另一方面可以从根源上有目的地改善g-C3N4基催化剂的性能。
本工作制备了具有纳米管状形貌的掺杂硼元素的g-C3N4催化剂,以罗丹明B(RhB)溶液模拟有机污染物,考察了催化剂在可见光照射下降解有机污染物的能力。
1 实验部分
1.1 试剂与仪器
所用试剂均为分析纯,购于希恩思化学试剂有限公司;去离子水:实验室自制。
XRD-7000型X射线衍射仪:日本岛津公司;Thermo ESCALAB 250型光电子能谱仪:赛默飞世尔科技有限公司;SU-8010型扫描电子显微镜:日本日立公司;ASAP2010型物理吸附仪:美国Micrometrics公司;Agilent Cary 50000型紫外-可见漫反射光谱仪、Cary Eclipse型荧光分光光度计:美国安捷伦公司。
1.2 催化剂的制备
块状g-C3N4(BCN)的制备:取1.6 g三聚氰胺,充分研磨30 min后加入到陶瓷坩埚中,在马弗炉内以5 ℃/min的升温速率升温至550 ℃,煅烧4 h,产物研磨后即得到黄色固体产物,命名为BCN。
硼掺杂管状g-C3N4的制备:取1.6 g三聚氰胺,加入75 mL去离子水,在80 ℃水浴下搅拌30 min至三聚氰胺完全溶解,加入0.78 g的硼酸,继续加热搅拌30 min,直到溶液变得澄清。将制得的澄清溶液转移到水热釜中,在180 ℃下水热反应10 h,即可得到硼掺杂管状g-C3N4前体,将该前体用去离子水和乙醇充分洗涤几次,直到pH接近7,放入烘箱内待前体完全干燥后,将其转移到坩埚中,在马弗炉中以5 ℃/min的升温速率升温至550 ℃并煅烧2 h,即得到深黄色的硼掺杂管状g-C3N4,此时原料中硼酸与三聚氰胺的摩尔比为1∶1,记为BG1。改变硼酸的加入量,分别为1.57,2.35 g,制得了不同硼掺杂量的管状g-C3N4,依次记为BG2,BG3。
1.3 光催化性能测试
RhB光催化降解反应在杭州聚同有限公司JTGHX-BC型光化学反应仪上进行,以500 W氙灯(配420 nm滤光片)为可见光光源对催化剂进行活性评价。将25 mg催化剂分散在50 mL的RhB水溶液(10 mg/L)中并搅拌30 min达到吸附平衡,之后打开光源,每30 min取1次样,离心后取上层清液,在554 nm波长下测定吸光度。计算光催化剂对RhB的降解率。
RhB降解率(η)的计算公式见式(1)。

式中,c0为RhB初始质量浓度,mg/L;c为各取样时间点RhB的质量浓度,mg/L。
2 结果与讨论
2.1 XRD表征结果
图1为催化剂的XRD谱图。从图1可看出,BG和BCN类似,都有两个衍射峰,其中,在2θ=13.1°处有一个较弱的衍射峰,对应(100)晶面,是典型的氮化碳的面内堆积结构导致的。而另一个衍射峰在2θ=27.4°附近,是典型的氮化碳晶体结构[17]。相对于BCN,BG2的峰强度较低,这说明硼元素的掺杂使改性后的催化剂结晶度降低,但并没有改变氮化碳的主体结构。

图1 催化剂的XRD谱图Fig.1 XRD patterns of the catalysts.BG1,BG2,BG3:tubular g-C3N4 with melamine 1.6 g and boric acid addition amounts 0.78,1.57,2.35 g,respectively;BCN:bulk g-C3N4.
2.2 XPS表征结果
图2为BG2的XPS谱图。从图2a可看出,硼元素确实掺杂到了氮化碳内;由图2b可知,结合能为284.6,286.2,288.2 eV处存在三个峰,分别对应石墨碳、C—N结构和sp2杂化的碳键,其中,sp2杂化是因为碳在三嗪环中与N形成了N—C=N的结构[18]。由图2c可看出,位于399.0 eV处的主峰对应双配位的氮(C=N—C),稍弱一些的位于400.4 eV处的峰对应C—N(—C)—C或者C—N(H)—C结构中sp2杂化的氮原子,401.6 eV处的峰则归因于末端氨基官能团N—H2和N—H[19]。图2d中位于192.1 eV处的峰,类似于四苯硼酸钾,表明硼与三嗪环上的碳形成了单键结合在三嗪环上。

图2 BG2的XPS谱图Fig.2 XPS spectra of BG2.
2.3 SEM分析结果
BCN,BG1,BG2,BG3催化剂及其前体的SEM照片见图3。从图3可看出,BCN为大的无孔块状结构,而管状g-C3N4则表现为管状的棱柱形结构,这是因为硼酸水热处理后的前体也出现了柱形结构。BG1中的微管团聚情况严重,且管的长度较短,管状结构较细,这导致了BG1比表面积较小。BG2前体的管较BG1前体长,团聚现象不明显,因此在煅烧后BG2仍保留了均匀的管状结构。BG3前体是不规则的柱状形貌,可能是硼酸加入过多,酸性过大所导致。当前体在高温条件下发生分解后,BG3的形貌呈现出一种破碎的管状形貌。

图3 催化剂及其前体的SEM照片Fig.3 SEM images of the catalyst and its precursor.a BCN;b BG1;c BG2;d BG3;e Precursor of BG1;f Precursor of BG2;g Precursor of BG3
2.4 比表面积和孔径分布
催化剂的N2吸附-脱附等温线及孔径分布见图4。从图4a可知,等温线为Ⅳ型结构,表明催化剂中均存在中孔和大孔结构。虽然试样在中压段到高压段都存在吸附回滞环,但形成原因不同。BCN形成的回滞环是由于BCN粒子聚集导致的;而BG2出现回滞环是由于存在狭缝形的介孔和大孔结构。BCN,BG1,BG2,BG3的比表面积分别为20.37,56.14,98.21,64.27 m2/g,其 中,BG2的比表面积几乎是BCN的5倍。改性后BG2的比表面积大大增加,这使得BG2可以在反应中暴露出更多的活性位点从而提高反应能力。从图4b可看出,催化剂的孔径主要分布在2~10 nm,这与催化剂特殊的管状形貌及堆叠产生的间隙有关。
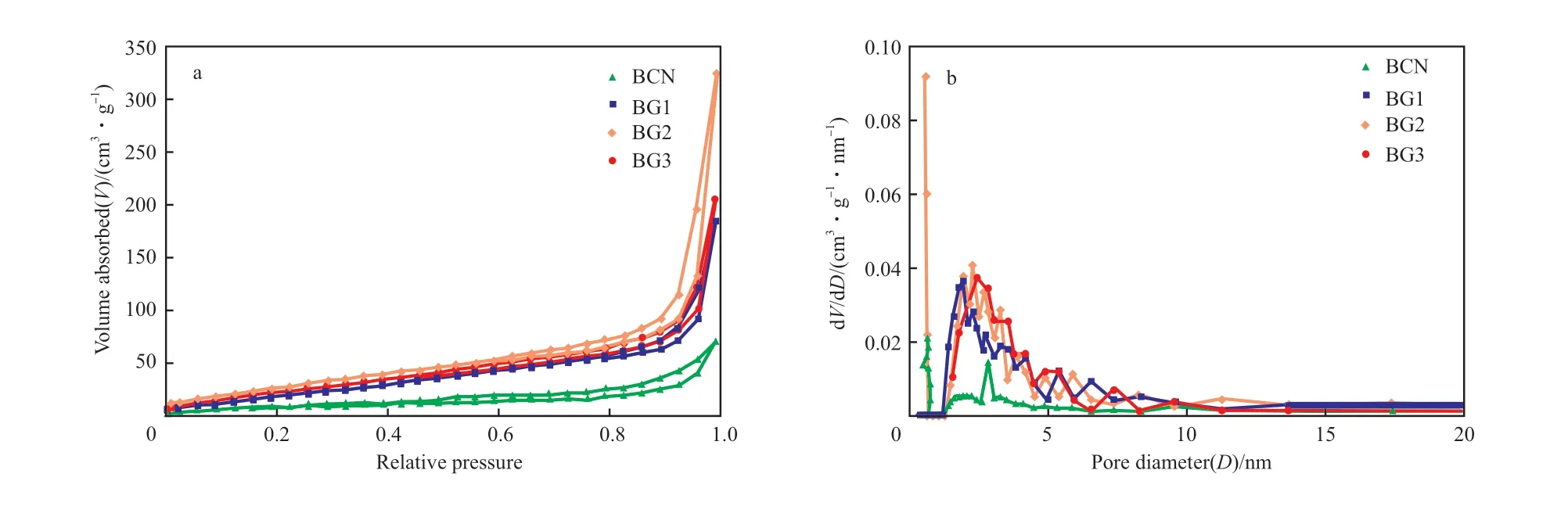
图4 催化剂的N2吸附-脱附等温线(a)和孔径分布(b)Fig.4 N2 adsorption-desorption isotherms(a) and pore size distributions(b) of catalysts.
2.5 能带结构和PL分析结果
图5为催化剂的UV-Vis谱图和能带谱图。
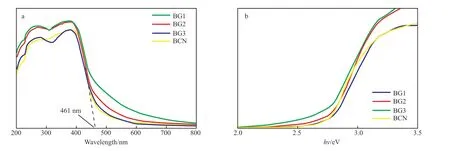
图5 催化剂的UV-Vis谱图(a)和能带谱图(b)Fig.5 UV-Vis spectra(a) and band gap values(b) of the catalysts.
从图5a可看出,硼掺杂管状g-C3N4试样表现出与BCN相似的光吸收,但光吸收带边发生红移,对可见光的吸收范围增大[20]。根据UV-Vis谱图的数据,通过Kubelka-Munk方程计算了带隙能,由图5b可看出,BCN,BG1,BG2,BG3的禁带宽度分别为2.74,2.69,2.64,2.62 eV,表明随硼掺杂量的增加,改性后催化剂的带隙能降低,较低的带隙能有利于催化剂提高对可见光的利用率,且提高催化剂在可见光照射下的光催化能力[21]。
光生电子与空穴的复合情况可以通过PL光谱表征,结果见图6。从图6可知,随硼掺杂量的增加,改性后试样的PL强度明显低于BCN,表明经过硼掺杂处理改性后催化剂的光生载流子重组效率远低于BCN,进而提高了催化剂的光催化能力。
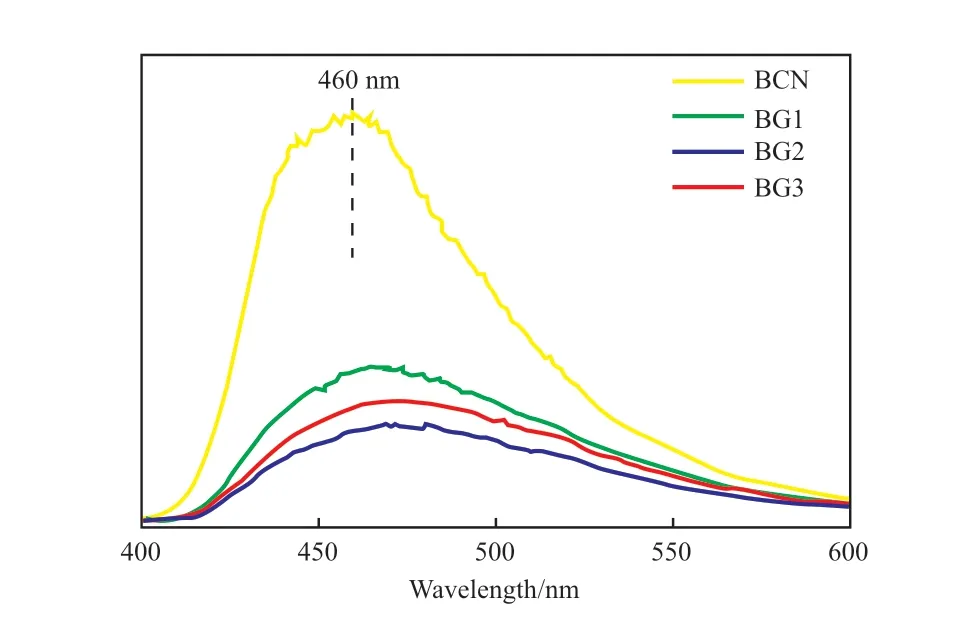
图6 催化剂的PL谱图Fig.6 PL spectra of the catalysts.
2.6 光催化降解性能评价结果
在500 W的氙灯照射下考察了催化剂降解RhB溶液的效果,结果见图7。RhB溶液是一种性质比较稳定的溶液,不会在氙灯的照射下自行分解。首先在黑暗条件下进行30 min的暗反应,使催化剂对溶液中的溶质进行吸附并达到吸附-脱附平衡。根据图7和降解率公式计算可知,BG2的降解率最高,达87.3%。而BG1和BG3的降解效果也都高于BCN。说明使用硼酸进行改性确实起到了加强催化能力的作用。BG2表现出最佳的光催化活性,这是因为BG2从形貌特征上,拥有最大的比表面积,且呈现出松散的管状结构,没有发生明显的团聚现象,这有利于催化剂暴露出更多的活性位;从电子结构上看,结合PL和UV-Vis表征结果可知,BG2的禁带宽度明显降低,这大大提高了对可见光的利用效率,较低的PL强度则有利于提供更多的活性物质,防止光生载流子重组。

图7 催化剂光催化降解性能Fig.7 Photocatalytic degradation performances of catalysts.c0:initial mass concentration of Rhodamine B(RhB);c:mass concentration of RhB at each sampling time point.
催化剂光催化降解RhB的一级动力学曲线见图8。由图8可知,催化剂的反应动力学常数大小顺序为:BG2>BG3>BG1>BCN,表明经硼酸改性处理后的催化剂均拥有较高的催化性能。其中,BG2的动力学常数最大,催化活性最高。
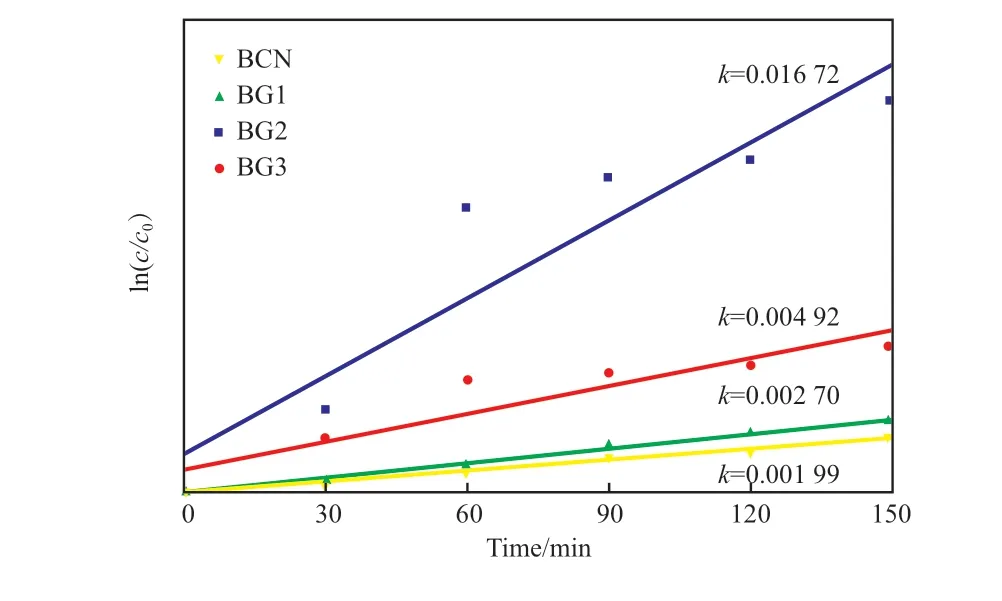
图8 催化剂光催化降解RhB的一级动力学曲线Fig.8 First-order kinetics curves of RhB degradation.
采用BG2进行循环实验,考察了催化剂的稳定性,结果见图9。从图9可看出,在3次循环实验中,前两次催化剂的活性几乎没有变化,由降解率公式计算可知,反应2 h后,降解率分别为87.3%和87.0%,而后两次的降解率略有降低,经过2 h反应后,降解率分别为85.6%和83.1%,这可能是因为回收清洗催化剂时损失了部分催化剂导致的。因此,在循环使用过程中BG2的催化活性没有明显下降,表明BG2光催化降解RhB具有较好的稳定性。
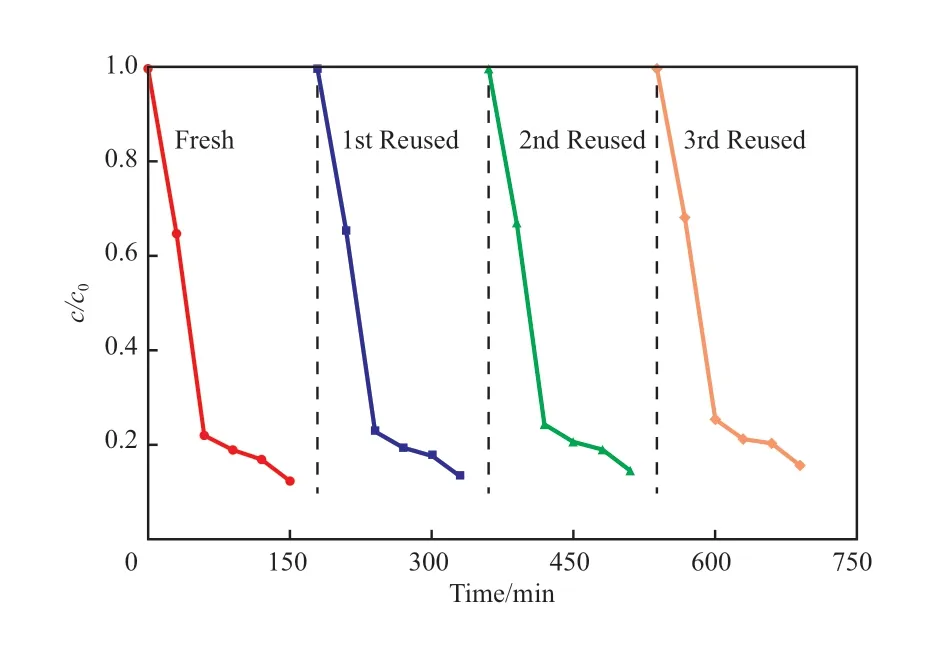
图9 BG2的稳定性Fig.8 The catalytic stability of BG2.
3 结论
1)使用硼酸改性处理的三聚氰胺为前体,采用水热法制备了硼掺杂管状g-C3N4光催化剂,管状形貌的构建有效提高了催化剂的比表面积,产生了大量的介孔结构,BG2具有较高的比表面积(98.21 m2/g),为降解RhB提供了更多的反应活性位点。
2)硼元素的引入调节了催化剂的能带结构,BG2具有2.64 eV的禁带宽度,提升了催化剂的光吸收能力,且光致发光谱显示,BG2具有最佳的光生电子与空穴分离效率。
3)光催化降解RhB的性能显示,BG2的降解率最高,达87.3%,且具有优良的稳定性。

