洗心汤对T2D合并AD小鼠模型中JAK2/STAT3通路和IDE蛋白表达的影响
周源 第五永长 王郁金 侯杰军 陈连吉 王楠 王亚丽 张琪



〔摘要〕 目的 探究洗心湯对2型糖尿病(type 2 diabetes mellitus, T2D)合并阿尔茨海默病(Alzheimer’s disease, AD)小鼠模型中JAK2/STAT3通路和胰岛素降解酶(insulin degrading enzyme, IDE)蛋白表达的影响,阐明其缓解AD相关症状的分子机制。方法 通过对APP/PS1小鼠腹腔注射链脲佐菌素(streptozotocin, STZ)构建T2D-AD小鼠模型,然后分别给予安理申和洗心汤灌胃治疗。共分为4组:对照组、T2D-AD组、安理申组和洗心汤组。通过定位航行实验和空间探索实验考察小鼠的空间记忆能力;通过qRT-PCR检测IDE mRNA的表达水平;ELISA检测各组小鼠脑组织中炎症因子(TNF-α、IL-6、IL-8)的水平;Western blot检测各组小鼠脑组织中JAK2、STAT3、IDE和β淀粉样蛋白(amyloid-β peptides, Aβ)的表达水平。结果 与对照组相比,T2D-AD组小鼠的逃避潜伏期显著增加(P<0.05),目标平台象限滞留时间与穿越平台次数均显著减少(P<0.05);与T2D-AD组相比,安理申组和洗心汤组小鼠逃避潜伏期均显著缩短(P<0.05),小鼠目标平台象限滞留时间与穿越平台次数均显著增加(P<0.05)。与对照组相比,T2D-AD组小鼠脑组织中炎症因子(TNF-α、IL-6、IL-8)的水平显著升高(P<0.05);与T2D-AD组相比,安理申组和洗心汤组小鼠脑组织中炎症因子(TNF-α、IL-6、IL-8)的水平显著降低(P<0.05)。与对照组相比,T2D-AD组小鼠脑组织中磷酸化JAK2和STAT3水平显著升高(P<0.05);洗心汤组小鼠脑组织中磷酸化JAK2和STAT3水平显著低于T2D-AD组(P<0.05)。与对照组相比,T2D-AD组小鼠脑组织中IDE mRNA和蛋白水平显著降低(P<0.05),Aβ蛋白表达显著升高(P<0.05);与T2D-AD组比较,洗心汤组小鼠脑组织中IDE mRNA和蛋白水平显著升高(P<0.05),Aβ蛋白表达显著降低(P<0.05)。结论 洗心汤能够通过抑制T2D-AD小鼠模型中JAK2/STAT3通路的激活缓解小鼠大脑中的炎症反应,并促进IDE蛋白表达,促进Aβ蛋白的降解。
〔关键词〕 洗心汤;阿尔茨海默病;2型糖尿病;胰岛素降解酶;JAK2/STAT3通路;β淀粉样蛋白
〔中图分类号〕R285.5 〔文献标志码〕A 〔文章编号〕doi:10.3969/j.issn.1674-070X.2022.05.006
Effect of Xixin Decoction on JAK2/STAT3 pathway and IDE protein expression in
T2D combined AD mouse model
ZHOU Yuan DIWU Yongchang WANG Yujin HOU Jiejun CHEN Lianji WANG Nan WANG Yali ZHANG Qi
(1. Department of Anatomy, Basic Medical College, Shaanxi University of Chinese Medicine, Xianyang, Shaanxi 712046, China; 2. Shaanxi Key Laboratory of Chinese Medicine Encephalopathy, Shaanxi University of Chinese Medicine, Xianyang, Shaanxi 712046, China; 3. Discipline Innovation Team of Shaanxi University of Chinese Medicine, Xianyang, Shaanxi 712046, China;
4. Department of Clinical Medicine, The Second Clinical Medical College, Shaanxi University of Chinese Medicine, Xianyang, Shaanxi 712046, China; 5. Department of TCM Diagnosis, Basic Medical College, Shaanxi University of Chinese Medicine, Xianyang, Shaanxi 712046, China; 6. Affiliated Hospital of Shaanxi University of Chinese Medicine, Xianyang, Shaanxi 712046, China)
〔Abstract〕 Objective To investigate the effect of Xixin Decoction on JAK2/STAT3 pathway and insulin degrading enzyme (IDE) protein expression in mice with type 2 diabetes mellitus (T2D) combined with Alzheimer's disease (AD), and to elucidate the molecular mechanism of its reduction of AD-related symptoms. Methods T2D-AD mouse model was established by intraperitoneal injection of streptozotocin (STZ) to APP/PS1 mice, and then aricept and Xixin Decoction were given by intragastric administration. They were divided into four groups: control group, T2D-AD group, aricept group and Xixin Decoction group. The spatial memory ability of mice was investigated by navigation experiment and space exploration experiment. The expression level of IDE mRNA was detected by qRT-PCR. The inflammatory factor levels (TNF-α, IL-6 and IL-8) were detected in the brain tissues of each group by ELISA. Western blot was used to detect the protein expression levels of JAK2, STAT3, IDE and Aβ in the brain tissues of mice in each group. Results Compared with the control group, the escape latency of mice in T2D-AD group was significantly increased (P<0.05), and the retention time of target platform quadrant and the times of crossing platform were significantly decreased (P<0.05); compared with T2D-AD group, the escape latency of mice in aricept group and Xixin Decoction group was significantly shortened (P<0.05), and the retention time of mice in target platform quadrant and times of crossing platform were significantly increased (P<0.05). Compared with control group, the inflammatory factor levels (TNF-α, IL-6 and IL-8) were significantly increased in brain tissues of T2D-AD group (P<0.05); compared with T2D-AD group, the inflammatory factor levels (TNF-α, IL-6 and IL-8) were significantly decreased in aricept group and Xixin Decoction group (P<0.05). Compared with the control group, the levels of phosphorylated JAK2 and STAT3 in brain tissues of mice in T2D-AD group were significantly increased (P<0.05); the levels of phosphorylated JAK2 and STAT3 in the brain tissues of mice in Xixin Decoction group were significantly lower than those in T2D-AD group (P<0.05). Compared with control group, IDE mRNA and protein levels in T2D-AD group were significantly decreased (P<0.05), and Aβ protein level was significantly increased (P<0.05); compared with T2D-AD group, the mRNA and protein levels of IDE in Xixin Decoction group were significantly increased (P<0.05), and the protein level of Aβ was significantly decreased (P<0.05). Conclusion Xixin Decoction can inhibit the activation of JAK2/STAT3 pathway in T2D-AD mouse model, alleviate the inflammatory response in mouse brain, promote the expression of IDE protein and the degradation of Aβ protein.
〔Keywords〕 Xixin Decoction; Alzheimer's disease; type 2 diabetes mellitus; insulin degrading enzyme; JAK2/STAT3 pathway; amyloid-β peptides
阿尔茨海默病(Alzheimer’s disease, AD)是一种慢性神经退行性疾病,是常见的老年期痴呆的一种,占所有病例的70%~90%[1-2]。它主要是由大脑神经元内β淀粉样蛋白(amyloid-β peptides, Aβ)的沉积引起的[3-4]。随着人口老龄化的加劇,世界上的AD患病率正在迅速增加,AD已成为一个公共卫生问题,其预防和治疗越来越迫切。目前,药物治疗只能缓解AD相关的认知障碍,治疗效果有限,不能从根本上控制或逆转AD发病机制[5]。越来越多的研究表明,2型糖尿病(type 2 diabetes mellitus, T2D)在AD发展过程中发挥着重要作用[6-7]。一项研究表明,改善T2D代谢控制可以延迟或预防AD病理学[8]。胰岛素降解酶(insulin degrading enzyme, IDE)是一种负责胰岛素降解的金属蛋白酶[9],同时在体外和体内的Aβ降解中也起到非常关键的作用[10]。然而,目前关于IDE在T2D合并AD中的作用机制还未见报道,其中的重要分子机制有待进一步研究。中医传统名方洗心汤是AD治疗的代表方。最近的研究表明,洗心汤能够有效缓解AD症状,增强AD大鼠的空间学习能力,改善神经元损伤[11-14]。本研究通过构建T2D合并AD小鼠模型,初步探究了洗心汤在T2D合并AD中调控IDE表达,缓解AD相关症状的分子机制,为洗心汤治疗AD的应用提供更多的理论基础。
1 材料与方法
1.1 药物及试剂
洗心汤:人参、茯神、半夏、酸枣仁、附子、石菖蒲、陈皮、甘草,由999企业集团医药股份有限公司提供中药配方颗粒(批号:0908032);链脲佐菌素(streptozotocin, STZ)(上海麦克林生化科技有限公司,批号:S6089);安理申[卫材(中国)药业有限公司生产,商品编号:HST008522)。Lipofectamine 3000和qRT-PCR相关试剂盒均购自美国Thermo Fisher Scientific公司;RNA引物由生工生物工程(上海)有限公司合成;本实验所用抗体均购自美国Cell Signaling Technology公司。TNF-α、IL-6、IL-8的ELISA试剂盒均购自Abcam公司(批号分别为ab100747、ab222503、ab214030)。
1.2 动物及分组
24只12周龄SPF级APP/PS1小鼠(商品化的AD模型小鼠),雄性,体质量(22±3) g;8只12周龄雄性C57BL/6J小鼠,体质量(21±4) g,均购于南京君科生物工程有限公司。8只C57BL/6J小鼠作为对照组,APP/PS1小鼠随机分为T2D-AD组、安理申组和洗心汤组,每组8只。所有动物饲养于SPF级实验动物房中(20~25 ℃,12 h光照/12 h黑暗循环),给予充足的水和食物。所有动物实验均经陕西中医药大学附属医院动物伦理委员会SUCMDC20210310036批准,并符合相关操作规程。
1.3 给药方法
对照组小鼠给予T2D-AD组等量药物的生理盐水,所有小鼠按0.1 mL/10 g的量给药。持续灌胃给药6个月后进行行为学测试。洗心汤组采用研钵把药物颗粒研成粉末,用生理盐水溶解,按1.8 g/(kg·d)剂量灌胃给药,每天1次;安理申组用生理盐水溶解定理申,按0.015 mg/(kg·d)剂量灌胃给药,每天1次。所有药用剂量根据患者临床用量的等效剂量和动物体表面积计算所得。给药剂量参照以往的相关研究[11]。
1.4 T2D合并AD小鼠模型
为建立T2D-AD小鼠模型,APP/PS1小鼠禁食过夜,12~14 h后接受单次腹腔注射链脲佐菌素(streptozocin, STZ) (50 mg/kg) 5 d[15],STZ广泛用于T2D小鼠模型的诱导[16]。将STZ溶解在0.1 mmol/L柠檬酸盐缓冲液(pH 5.5)中,并进行无菌过滤来制备STZ溶液。通过尾静脉收集血样并进行代谢测量,空腹血糖水平高于12 mmol/L的小鼠被视为T2D小鼠。而后,对小鼠进行为学测试和识别任务。最后,小鼠被麻醉并杀死,收集脑组织进行后续分析检测。
1.5 行为学测试方法
采用Morris水迷宫试验法测试小鼠学习记忆能力。(1)定位航行实验:即分别以4个象限池壁的中点作为入水点,将动物面向池壁放入水中,记录动物寻找并爬上平台所需时间即逃避潜伏期及游泳距离,各组小鼠每天训练2次,共训练5 d。经60 s未找到平台者,将其引领至平台,放置30 s引导其学习记忆。(2)空间搜索实验:第6天撤除平台,从第一象限中心将动物放入水中,记录60 s内小鼠在原目标平台象限的滞留时间和穿越平台的次数。
1.6 RNA提取、逆转录、qRT-PCR
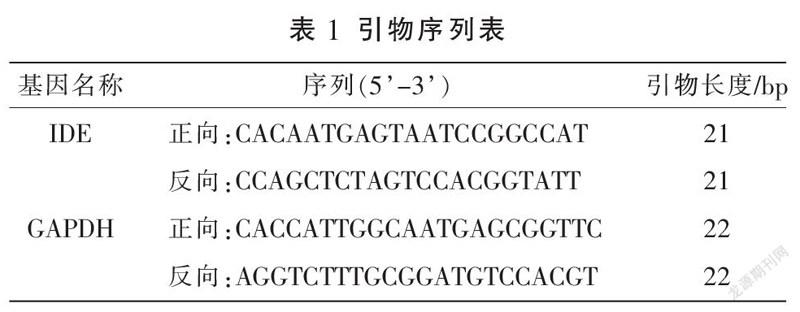
Trizol一步法提取小鼠脑组织中的RNA,抽提的RNA用40 μL的无核酸酶水溶解后-80 ℃保存。取0.5 μg总RNA,用逆转录试剂盒合成cDNA,再行PCR扩增目标基因。加入相应引物,将所得cDNA加至PCR反应体系中扩增目标片段。待测样品分别加入1 μL模板、1 μL正向引物、1 μL反向引物、5 μL SYBR探针和3 μL DEPC水避光混匀后,上机检测相关分子水平表达。设定PCR反应程序为:95 ℃预变性15 min后,94 ℃变性30 s,55 ℃退火30 s,72 ℃延伸30 s,40个循环。GAPDH作为内参,根据2方法计算相对的基因表达。引物序列见表1。
1.7 总蛋白提取与Western blot检测
将各组小鼠断头后分离脑组织,-80 ℃冰箱冻存备用。取适量脑组织冰上匀浆,用RIPA裂解液裂解30 min,分离提取样本中的全蛋白,接着用BCA试剂盒检测蛋白浓度。将蛋白进行SDS-聚丙烯酰胺凝胶电泳,然后转至PVDF膜上,并浸入含5%脱脂奶粉的TBST(封闭液)中,摇床封闭2 h(室温)。加入JAK2、STAT3、IDE一抗(1∶1000)4 ℃孵育过夜。而后PBS洗涤3次,加入相应二抗(1∶5000),震荡孵育2 h。洗膜后,加入化学发光试剂(ECL)显色、胶片曝光。最后使用凝胶成像分析系统拍照,通过ImageJ分析并计算出蛋白灰度值。
1.8 ELISA分析检测
取适量脑组织加入预冷的PBS并于冰上匀浆,取适量匀浆在4 ℃下,5000×g离心5~10 min,取上清。然后根据ELISA试剂盒制造商说明,分别使用洗涤缓冲液洗涤,抗体孵育,加入相应的反应溶液等,最后置于酶联免疫检测仪进行检测各组小鼠脑组织中TNF-α、IL-6、IL-8的水平。
1.9 统计学方法
数据处理采用SPSS 18.0统计软件,计量资料以“x±s”表示,比较采用单因素方差分析或重复测量设计的方差分析,两两比较用LSD-t检验,以P<0.05为差异有统计学意义。
2 结果
2.1 洗心汤对T2D-AD小鼠模型空间记忆能力的影响
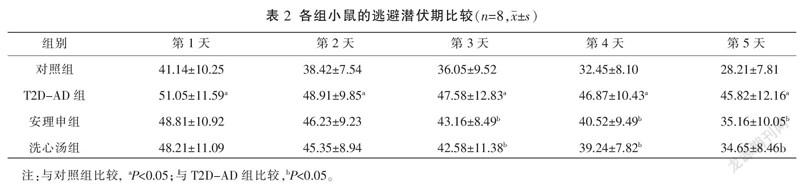
与对照组相比,T2D-AD组小鼠2、3、4、5 d的逃避潜伏期显著增加(P<0.05);而与T2D-AD组小鼠相比,安理申组和洗心汤组3、4、5 d小鼠逃避潜伏期均显著缩短(P<0.05);安理申组和洗心汤组小鼠逃避潜伏期之间进行比较,差异无统计学意义(P>0.05)。详见表2。
与对照组相比,T2D-AD组小鼠目标平台象限滞留时间与穿越平台次数均显著减少(P<0.05);与T2D-AD组相比,安理申组和洗心汤组小鼠目标平台象限滞留时间与穿越平台次数均显著增加(P<0.05);安理申组和洗心汤组小鼠目标平台象限滞留时间与穿越平台次数之间进行比较差异无统计学意义(P>0.05)。详见表3。
2.2 洗心汤对T2D-AD小鼠模型大脑炎症的影响
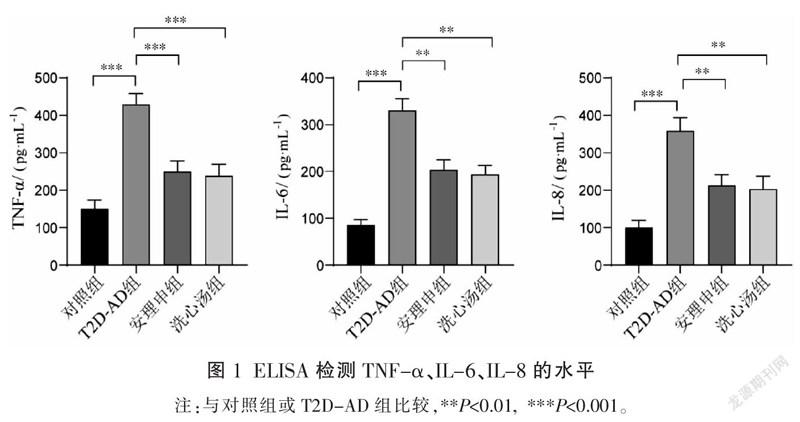
与对照组相比,T2D-AD组小鼠脑组织中炎症因子(TNF-α、IL-6、IL-8)的水平均显著升高(P<0.05);与T2D-AD组相比,安理申组和洗心汤组小鼠脑组织中炎症因子(TNF-α、IL-6、IL-8)的水平均显著降低(P<0.05);安理申组和洗心汤组小鼠脑组织中炎症因子(TNF-α、IL-6、IL-8)的水平进行比较差异无统计学意义(P>0.05)。详见图1。
2.3 洗心汤对T2D-AD小鼠模型中JAK2/STAT3通路的影响
与对照组相比,T2D-AD组小鼠脑组织中磷酸化JAK2和STAT3水平显著升高(P<0.05);与T2D-AD组相比,安理申组小鼠脑组织中磷酸化JAK2和STAT3水平差异无统计学意义(P>0.05),但洗心汤组小鼠脑组织中磷酸化JAK2和STAT3水平显著低于T2D-AD组(P<0.05)。详见图2。
2.4 洗心汤对T2D-AD小鼠模型中IDE的表达和Aβ蛋白降解的影响
与对照组相比,T2D-AD组小鼠脑组织中IDE mRNA和蛋白水平显著降低(P<0.05),Aβ蛋白表达显著升高(P<0.05);与T2D-AD组相比,安理申组小鼠脑组织中IDE mRNA和蛋白水平差异无统计学意义(P>0.05),Aβ蛋白表达差异无统计学意义(P>0.05);但洗心汤组小鼠脑组织中IDE mRNA和蛋白水平显著高于T2D-AD组(P<0.05),Aβ蛋白表达显著降低(P<0.05)。详见图3。
3 讨论
人口老龄化的加剧导致全世界的AD患病率迅速增加,尤其我国老龄化日益严重,AD的预防和治疗也越来越被人们所关注,并且生活条件的改善也进一步增加了糖尿病的患病率[17]。AD患者往往也会患有不同程度的糖尿病,相关研究表明T2D参与了AD的发生发展,二者存在一定的相关性,糖尿病可能增加AD的患病风险[18-19]。然而,目前对于糖尿病合并AD的发病机制的研究不充分,对其预防以及治疗尚缺乏有效策略。因此,本研究通过对APP/PS1小鼠腹腔注射STZ成功构建T2D-AD小鼠模型,以进一步研究T2D-AD进展的具体机制,探究治疗策略。
洗心汤是清代名医陈士铎所创,用于治疗痴呆症的中医名方,被现代中医专著收录。该药方通过补益脾胃之气,化痰开窍,益气通阳,安神降浊,具有升發阳气、祛逐阴邪、平衡阴阳之功效。已有相关研究表明洗心汤能够有效缓解AD动物模型的症状,恢复空间记忆和学习能力,改善神经元损伤,增强海马神经元突出活性,并调控相关蛋白的表达水平[20-21]。我们的研究同样发现,在T2D-AD小鼠模型中,安理申和洗心汤治疗后均能够显著缩短小鼠逃避潜伏期,并增加小鼠目标平台象限滞留时间和穿越平台次数。这表明洗心汤在糖尿病合并AD的治疗中仍具有很好的效力。
目前的研究表明,AD的发病机制主要是由于大脑内Aβ肽异常沉积聚集和tau蛋白的过度磷酸化造成的,这导致神经元细胞活力降低,使患者空间认知能力和记忆学习功能出现障碍[22]。而对于Aβ肽异常的沉积,细胞内存在多种降解酶以清除Aβ蛋白,主要包括脑啡肽酶和IDE[23-25]。胰岛素降解酶除了负责胰岛素的降解外,还参与了体外和体内的Aβ降解[10]。有报道称AD和T2D小鼠中IDE表达水平显著降低[26],IDE在内的多种Aβ降解酶的低表达,导致Aβ降解缓慢引起Aβ异常沉积,从而诱发AD。然而,目前关于IDE在T2D合并AD中的作用机制还未见报道,尤其是洗心汤对其表达和功能的影响尚未有相关研究。本研究结果表明,与对照组相比,T2D-AD组小鼠脑组织中IDE mRNA和蛋白水平显著降低,Aβ蛋白表达显著升高;洗心汤治疗后小鼠脑组织中IDE mRNA和蛋白水平显著高于T2D-AD组,Aβ蛋白表达显著降低。这表明洗心汤可能上调IDE蛋白水平,进而促进IDE对Aβ蛋白的降解,缓解Aβ蛋白沉积诱导的AD。这与先前研究报道中IDE能够参与体内外Aβ的降解[10],增加IDE表达能够降低AD中Aβ蛋白积累[26]的结果是一致的。并且洗心汤可显著降低小鼠脑组织中JAK2和STAT3磷酸化水平,抑制TNF-α、IL-6、IL-8炎症因子的水平,有效降低小鼠大脑组织炎症反应。这一结果与先前的报道抑制JAK2和STAT3磷酸化水平能够缓解AD神经炎症结果相一致[27],并且本研究表明,抑制JAK2和STAT3磷酸化水平显著上调了IDE蛋白的表达,进而降解Aβ蛋白。Aβ蛋白在AD发病过程中会诱导神经炎症,对其降解能够缓解细胞炎症反应[28]。本研究表明洗心汤通过上调IDE蛋白降解Aβ来缓解AD小鼠大脑组织中的炎症反应,以减轻AD症状。另外,虽然安理申也能够抑制TNF-α、IL-6、IL-8炎症因子表达,缓解小鼠大脑组织炎症,但是并没有影响小鼠脑组织中JAK2和STAT3磷酸化水平和IDE mRNA和蛋白水平。这表明安理申对于AD的治疗与洗心汤存在不同的途径。
总之,本实验研究表明洗心汤能够通过抑制JAK2和STAT3磷酸化水平,促进IDE mRNA和蛋白表达,进而降解T2D-AD小鼠模型大脑组织中的Aβ肽缓解AD症状。这为洗心汤在AD治疗机制的探索中提供了新思路,然而目前研究欠深入,对于IDE表达是直接被洗心汤影响,还是被JAK2和STAT3磷酸化影响,亦或其他通路所调控还需要进一步的探索。
参考文献
[1] BREIJYEH Z, KARAMAN R. Comprehensive review on Alzheimer's disease: Causes and treatment[J]. Molecules, 2020, 25(24): E5789.
[2] MA N N, TIE C R, YU B, et al. Identifying lncRNA-miRNA-mRNA networks to investigate Alzheimer's disease pathogenesis and therapy strategy[J]. Aging, 2020, 12(3): 2897-2920.
[3] SORIA LOPEZ J A, GONZáLEZ H M, LéGER G C. Alzheimer's disease[J]. Handbook of Clinical Neurology, 2019, 167: 231-255.
[4] BUSCHE M A, HYMAN B T. Synergy between amyloid-β and tau in Alzheimer's disease[J]. Nature Neuroscience, 2020, 23(10): 1183-1193.
[5] REVI M. Alzheimer's disease therapeutic approaches[J]. Advances in Experimental Medicine and Biology, 2020, 1195: 105-116.
[6] DE SOUSA R A L, HARMER A R, FREITAS D A, et al. An update on potential links between type 2 diabetes mellitus and Alzheimer's disease[J]. Molecular Biology Reports, 2020, 47(8): 6347-6356.
[7] ROWLES J E, KEANE K N, GOMES HECK T, et al. Are heat shock proteins an important link between type 2 diabetes and alzheimer disease?[J]. International Journal of Molecular Sciences, 2020, 21(21): E8204.
[8] RAMOS-RODRIGUEZ J J, JIMENEZ-PALOMARES M, MURILLO-CARRETERO M I, et al. Central vascular disease and exacerbated pathology in a mixed model of type 2 diabetes and Alzheimer's disease[J]. Psychoneuroendocrinology, 2015, 62: 69-79.
[9] KUROCHKIN I V, GUARNERA E, BEREZOVSKY I N. Insulin-degrading enzyme in the fight against Alzheimer's disease[J]. Trends in Pharmacological Sciences, 2018, 39(1): 49-58.
[10] ZHANG H F, LIU D, HUANG H H, et al. Characteristics of insulin-degrading enzyme in Alzheimer's disease: A meta-analysis[J]. Current Alzheimer Research, 2018, 15(7): 610-617.
[11] 高彥斌,第五永长,唐学成,等.洗心汤对APP/PS1双转基因小鼠突触功能相关蛋白及受体表达的影响[J].中国中西医结合杂志,2018,38(6):699-706.
[12] 陈 璐,第五永长,温晓强,等.补益脾胃元气方药含药脑脊液对大鼠海马神经干细胞活力与迁移的影响[J].中草药,2018,49(23): 5580-5587.
[13] 邵怡然,第五永长,曾 健,等.洗心汤对Aβ1-42诱导的海马神经元线粒体功能的影响[J].辽宁中医杂志,2018,45(6):1281-1284, 1344.
[14] 第五永长,田金洲,时 晶.洗心汤对SAD大鼠脑内tau蛋白O-GlcNAc糖基化修饰相关酶的影响[J].南方医科大学学报,2013, 33(10):1442-1447.
[15] HE C, LU X W, YANG F, et al. LncRNA UCA1 acts as a sponge of miR-204 to up-regulate CXCR4 expression and promote prostate cancer progression[J]. Bioscience Reports, 2019, 39(5): BSR20181465.
[16] KAMALAKKANNAN N, STANELY MAINZEN PRINCE P. Rutin improves the antioxidant status in streptozotocin-induced diabetic rat tissues[J]. Molecular and Cellular Biochemistry, 2006, 293(1/2): 211-219.
[17] LI Y Z, TENG D, SHI X G, et al. Prevalence of diabetes recorded in mainland China using 2018 diagnostic criteria from the American Diabetes Association: National cross sectional study[J]. BMJ, 2020, 369: m997.
[18] 刘艳丽,钱 晓,张 艳.糖尿病与阿尔茨海默病发病机制的相关性[J].中国老年学杂志,2021,41(17):3885-3887.
[19] 赵 燕,李 妍,陈志花,等.糖尿病与阿尔茨海默病的双向相互作用[J].中国老年学杂志,2021,41(17):3876-3879.
[20] 王登坤,第五永长,苟于瑞,等.洗心汤对阿尔茨海默病模型大鼠海马BDNF、TrkB蛋白表达及肠道菌群多样性的影响[J].中医杂志,2021,62(15):1362-1369.
[21] 雷筱菁,第五永长,屈夏夏,等.补益脾胃元气方药对SAMP8小鼠海马突触活性带蛋白cplx1/2及stx1表达的影响[J].中华中医药杂志,2020,35(11):5811-5815.
[22] ATRI A. The Alzheimer's disease clinical spectrum: Diagnosis and management[J]. The Medical Clinics of North America, 2019, 103(2): 263-293.
[23] NALIVAEVA N N, ZHURAVIN I A, TURNER A J. Neprilysin expression and functions in development, ageing and disease[J]. Mechanisms of Ageing and Development, 2020, 192: 111363.
[24] IZADPANAH M, DARGAHI L, AI J, et al. Extracellular vesicles as a neprilysin delivery system memory improvement in Alzheimer's disease[J]. Iranian Journal of Pharmaceutical Research, 2020, 19(2): 45-60.
[25] LI H J, WU J, ZHU L F, et al. Insulin degrading enzyme contributes to the pathology in a mixed model of Type 2 diabetes and Alzheimer's disease: Possible mechanisms of IDE in T2D and AD[J]. Bioscience Reports, 2018, 38(1): BSR20170862.
[26] LI H J, YANG S, WU J, et al. cAMP/PKA signaling pathway contributes to neuronal apoptosis via regulating IDE expression in a mixed model of type 2 diabetes and Alzheimer's disease[J]. Journal of Cellular Biochemistry, 2018, 119(2): 1616-1626.
[27] LONG Q H, WU Y G, HE L L, et al. Suan-Zao-Ren Decoction ameliorates synaptic plasticity through inhibition of the Aβ deposition and JAK2/STAT3 signaling pathway in AD model of APP/PS1 transgenic mice[J]. Chinese Medicine, 2021, 16(1): 14.
[28] ZHANG J J, WANG R. Deregulated lncRNA MAGI2-AS3 in Alzheimer's disease attenuates amyloid-β induced neurotoxicity and neuroinflammation by sponging miR-374b-5p[J]. Experimental Gerontology, 2021, 144: 111180.
(本文編辑 苏 维)

