非转移性黑色素瘤糖蛋白B对脑缺血再灌注小鼠的神经保护作用▲
卢晓微 周智鹏 张辉阳 曾阳东 成 戈 蒋 宇 苏梦瑶
(桂林医学院附属医院放射科,广西桂林市 541001,电子邮箱:lxwsally@163.com)
近年来,我国脑血管疾病的发病率逐渐上升,其中以缺血性脑血管病多见,缺血性脑血管病具有发病率高、病死率高的特点,严重危害人类健康[1]。脑缺血损伤的发生机制复杂,治疗时间窗短,目前临床治疗效果不佳,脑缺血后神经保护相关药物的研究和开发一直是脑缺血研究领域的热点和难点。近年来,随着医学、药学以及相关学科的不断发展,对脑缺血性疾病大规模的研究使得相关的治疗方案和治疗药物不断涌现,不过从目前的研究结果来看,很多药物在动物实验中有效,但是在临床试验中却不成功[2-4]。寻找新的作用靶点和药物对脑缺血的临床治疗有重要意义。非转移性黑色素瘤糖蛋白B(glycoprotein nonmetastatic melanoma protein B,GPNMB)在恶性黑色素瘤细胞等多种肿瘤细胞中表达,属于一种肿瘤生长因子。有学者发现,脑缺血后小鼠的神经细胞和胶质细胞分泌的GPNMB增多,该蛋白可能具有减少神经细胞凋亡、保护神经细胞的作用[5]。本研究进一步探讨GPNMB对脑缺血再灌注小鼠的神经保护作用。
1 材料与方法
1.1 实验动物 雄性C57小鼠20只,由桂林医学院动物饲养中心提供(SYXK桂2020-0005),体重200~250 g,采用普通小鼠饲料喂养,自由饮水,饲养环境为屏障级动物实验室。
1.2 药剂与仪器 主要药物有:异丙酚(AstraZeneca公司,批号:CL738)、磷酸缓冲盐溶液(phosphate buffered saline,PBS;北京生物制品研究所,国药准字S10850002)。主要仪器和设备有:美国Intramedic公司PE-50管,Phillip公司INTEGRIS CV型数字血管造影系统。
1.3 动物分组与模型建立 按照随机数字表法将20只小鼠分成PBS组和GPNMB组,每组10只。两组小鼠均于术前24 h禁食,适量食水。使用10%的水合氯醛(350 mg/kg)进行腹腔麻醉后,送入介入手术间,将小鼠仰卧位固定在手术台上,鼻饲给氧,给予常规心电、呼吸和血压监护,使用微量泵静脉注射异丙酚0.13 mL/h维持麻醉状态。于麻醉状态下建立大脑中动脉栓塞模型:常规消毒颈部皮肤、备皮,切开皮肤,分离皮下组织和肌肉,暴露颈总动脉。结扎颈总动脉和颈外动脉,动脉夹夹闭颈内动脉,将准备好的7-0尼龙线从颈外动脉切口插入颈内动脉,松开动脉夹,将丝线头端进一步插至大脑中动脉开口处,建立大脑中动脉阻塞模型。恢复灌注后,行大脑中动脉正侧位造影确认栓塞成功,造影剂为优维显,浓度为300 mg/mL,购自拜尔医药保健公司,经颈外动脉注入。术前、术中和术后24 h监测小鼠的呼吸、体温、血压和血气等生理指标。
1.4 干预方法 栓塞成功2 h后撤出尼龙线进行再灌注2 h,GPNMB组经栓塞侧颈内动脉注射4 μL的GPNMB(浓度为50 ng/μL),PBS组经栓塞侧颈动脉注射等量的PBS后拔管、缝合包扎,再灌注24 h。
1.5 观察指标
1.5.1 梗死体积:给药干预再灌注24 h后,按照随机数字表法每组取5只小鼠,处死小鼠后取脑组织行冠状位切片,每片厚度为2 cm。然后行2,3,5-氯化三苯基四氮唑(2,3,5-triphenyltetrazolium chloride,TTC)染色。将4 g TTC(美国,Sigma公司)粉末溶于200 mL的PBS溶液,染色15 min,翻面再染10~15 min,甲醛溶液固定后测量梗死面积。正常脑组织呈红色,梗死组织呈苍白,通过病理图文分析系统进行图像分析,测量每张切片的总面积和梗死面积,每层梗死体积为该层梗死面积和层厚的乘积,各层的梗死体积之和为总的梗死体积。计算梗死体积和对侧正常脑组织的体积,其比值即为梗死率。
1.5.2 行为学观察:取每组剩下的5只小鼠,进行行为学观察。分别于栓塞成功2 h后撤出尼龙线进行再灌注2 h时与给药干预再灌注24 h时,对小鼠进行行为学缺陷评分。评价标准参考相关文献[6-7],评分为5分制,0分为无功能障碍,1分为不能伸展前肢,2分为向一侧旋转,3分为向一侧倾倒,4分为无自主活动伴意识抑制,5分为死亡。
1.6 统计学分析 采用SPSS 18.0软件进行统计学分析。计量资料以(x±s)表示,组间比较采用t检验。以P<0.05为差异具有统计学意义。
2 结 果
2.1 两组小鼠脑梗死体积的比较 干预再灌注24 h后,PBS组的脑梗死体积为(116.2±32.5 )mm3,脑梗死率为37.98%,GPNMB组的脑梗死体积为(67.3±21.3)mm3,梗死率为16.97%,GPNMB组的脑梗死体积小于PBS组(t=2.471,P=0.025)。见图1。
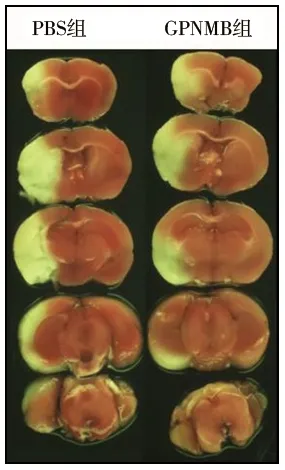
图1 两组小鼠脑梗死体积的比较(TTC染色,×5)
2.2 两组小鼠行为学缺陷评分的比较 栓塞再灌注后2 h与给药干预再灌注后24 h时,PBS组的行为学缺陷评分均高于GPNMB组(均P<0.05)。见表1。

表1 两组小鼠行为学缺陷评分的比较(x±s,分)
3 讨 论
急性缺血性脑卒中是一种因局限性脑缺血而突发的神经功能障碍性疾病,以脑组织缺血及缺血性损伤症状为主要临床表现,是全球人类致残的首要病因,也是全球第二大死因,现已成为我国首要死因[1]。
GPNMB是一种由572个氨基酸组成的Ⅰ型跨膜蛋白,是一种肿瘤生长因子,又被称为骨活素、树突细胞肝素整合素配体、造血干细胞生长因子诱导神经肽Ⅰ型[8],在多种细胞中都有表达,如皮肤基底层细胞、免疫细胞、成骨细胞、视网膜色素上皮细胞、神经细胞和胶质细胞[9-10]。GPNMB具有多种作用,其在肿瘤细胞中表达,可以调节肿瘤的侵犯和转移能力,抑制免疫系统,减少细胞凋亡,并有诱导血管再生,增强细胞黏附等作用,从而参与黑色素瘤、胶质瘤、乳腺癌、肝癌等多种恶性肿瘤的生长[5,11-13]。外源性的重组GPNMB可以增加小鼠成纤维细胞中基质金属蛋白酶3的表达,其机制可能是激活了细胞外信号调节激酶途径,参与细胞保护和炎症调节[14]。有学者发现,正常小鼠尿液中GPNMB表达水平极低,但肾缺血模型小鼠尿液中GPNMB的表达水平升高,且主要表达于巨噬细胞和上皮细胞内,参与细胞吞噬和炎症反应[15]。还有研究表明,GPNMB阳性表达的巨噬细胞具有更强的吞噬作用,以及清除坏死细胞碎片的能力,同时还分泌一些组织因子,对坏死组织的再生有明显促进作用[16-17]。以上研究表明,GPNMB可以通过参与炎症反应的调控、减少细胞死亡,参与肾缺血后的细胞保护机制。
Huang等[18]研究发现,GPNMB除了存在于胶质瘤细胞外,在正常神经系统的细胞内也有表达,其主要由小胶质细胞和巨噬细胞合成和分泌,可通过激活T淋巴细胞、促进其增殖;GPNMB可促进巨噬细胞浸润和吞噬细胞碎片,从而促进细胞的自噬参与免疫与炎症反应;GPNMB可能是神经系统疾病一个新的治疗靶点。还有研究结果显示,GPNMB可以刺激巨噬细胞表达炎症相关基因,发挥抗炎作用,从而起到神经保护作用,由此可以推测GPNMB可作为神经保护药物的作用靶点[13,15,18-20]。Murata等[21]研究发现,GPNMB基因携带小鼠的记忆力优于非携带小鼠,而且其海马区域的离子型谷氨酸受体水平升高,这提示GPNMB可以促进海马区离子型谷氨酸受体的表达,达到增强记忆的作用,故其认为GPNMB与神经细胞代谢及脑功能有关。还有研究结果显示,GPNMB在运动神经元和胶质细胞中均有表达,在肌萎缩性侧索硬化症患者脑脊液中的表达增高,高水平的GPNMB可以减轻运动神经元的变性和萎缩,其作用机制与磷脂酰肌醇3-激酶/蛋白激酶和丝裂原活化蛋白激酶/细胞外信号调节蛋白激酶(extracellular signal-regulated protein kinase,ERK)信号通路的激活有关,而该信号通路可以抑制神经细胞凋亡,保护神经细胞[22]。Nakano等[5]研究发现,脑缺血后,小鼠神经细胞和胶质细胞分泌的GPNMB增多,GPNMB可以激活ERK1/2和蛋白激酶B信号通路,从而减少神经细胞凋亡、保护神经细胞,缩小缺血后的脑梗死体积,这提示GPNMB可以作为脑缺血治疗的新靶点。
本研究结果显示,GPNMB组小鼠脑梗死体积小于PBS组,且栓塞再灌注后2 h、给药干预再灌注后24 h时小鼠的行为学缺陷评分均低于PBS组(均P<0.05),这提示GPNMB可以改善脑缺血再灌注小鼠的神经功能缺血的症状。这一结果为GPNMB应用于脑缺血治疗提供更多的理论基础,但GPNMB神经保护作用机制如何,其通过哪些信号通路发挥作用,还有待进一步研究。
综上所述,GPNMB可以缩小脑缺血再灌注小鼠的脑梗死体积,并改善其梗死后行为学缺陷,但其具体的作用机制还有待进一步研究。

