欧李高效再生体系的建立
杨文静,王占军,甘晓燕,何建龙,张 丽
(1宁夏农林科学院农业生物技术研究中心,银川 750002;2宁夏农林科学院荒漠化治理研究所,银川 750002)
0 引言
欧李(Cerasus humilis)是蔷薇科樱属矮生樱亚属灌木,是中国特有的古老野生树种。植株高0.4~1.5 m,花叶同开,花期4—5月,果期6—10月。产于黑龙江、吉林、辽宁、内蒙古等地[1]。抗干旱、耐瘠薄、适应能力强,可在沙漠、荒山、盐碱地栽植[2];集果、仁、叶、花等综合利用于一身,在医药、保健、食品、防风固沙、美化环境等多方面具有显著的生态、保健、药用、观赏价值,是将生态效益与经济效益有效结合的典范[3-4]。欧李果实香气浓郁,口味独特,不仅含有丰富的糖、蛋白质、维生素C等活性物质,还因其钙含量高而被称为“钙果”[5-8]。果仁中含有大量具有镇痛止咳和抗炎作用的苦杏仁甙而作为一种常用中药[9]。欧李生长势旺,茎叶柔软,叶量大,茎叶均无刺,富含糖、蛋白质等营养物质,可作为牛羊优质饲料的来源[10-11]。其根系发达,具抗旱、耐贫瘠的特性,是防风固沙、保持水土的优良树种[12-13]。所以,欧李全株可开发,具有很高的综合开发利用价值和良好的发展前景。
植物组织培养技术具有繁殖率高、生长周期短、管理便捷以及保持母本优良性状等优点,已广泛应用于各大花卉生产基地及科学研究领域。欧李通常以异花授粉为主,种子育苗变异系数非常大,扦插会受到季节和温度的影响,所以,组织培养是有效实现商业化生产的最佳路径。1994年钱国珍等[14]就以嫩茎和叶诱导愈伤组织,愈伤组织再分化诱导不定芽开始了欧李组培繁殖的研究,并分别筛选了叶和茎段诱导愈伤组织的最适培养基,认为叶愈伤组织诱导以MS+1.2 mg/L NAA+0.16 mg/L BA效果最好;茎段愈伤组织诱导以MS+0.4 mg/L 2,4-D+0.08 mg/L ZT效果最好;诱导不定芽的最适培养基是1/4MS+2 mg/L ZT。其后,越来越多的研究者对不同品种欧李组织培养体系进行优化。杜国荣[15]以叶片为外植体、李劲等[16]以茎叶为外植体经愈伤组织诱导、焦淑华等[17]以绿枝为外植体、王正德等[18]以幼茎为外植体,研究了不同外植体的再生效率,目前认为,新生带有腋芽的幼嫩茎段作为外植体能够获得较好的再生效率。贾海燕等[19]以‘京欧1号’、‘京欧2号’为材料的研究认为,诱导最适培养基为MS+0.5 mg/L 6-BA+0.2 mg/L NAA;最适继代扩繁培养基‘京欧1号’为MS+0.5 mg/L6-BA+0.1 mg/LNAA,‘京欧2号’为MS+0.1 mg/L6-BA+0.1 mg/LNAA;较适宜生根培养基‘京欧1号’为1/2MS+0.2 mg/L NAA+0.5 mg/L IAA,‘京欧2号’为1/2MS+0.1 mg/L NAA+1.0 mg/L IAA。孙晓丽[20]以‘欧李2号’增殖培养阶段试管苗为试材,筛选认为最适增殖培养基为MS+0.2 mg/L NAA+0.5 mg/L 6-BA+6 g/L琼脂+40 g/L蔗糖。刘天牧等[21]以欧李‘大磨盘’为材料的研究认为,适宜启动培养的生长素为IBA,并筛选得到最佳丛生芽培养基为MS+1.0 mg/L 6-BA+0.01 mg/L NAA+0.2 mg/L IBA,最佳分化培养基是MS+0.5 mg/L 6-BA+0.01 mg/L NAA+0.2 mg/L IBA,最佳生根培养基是1/2MS+0.5 mg/L IBA+0.1 mg/L NAA。这些研究都表明,在欧李分化和增殖阶段6-BA是关键的激素。其中,刘天牧等[22]筛选的扩繁培养基将欧李繁育速度提高了20倍,并申报科技成果,为欧李推广应用奠定基础。本研究针对目前欧李种苗品种混杂、质量良莠不齐等现状,人工繁育存在再生频率低、生根难、移栽成活率低等技术瓶颈,通过外植体的处理、分化、生根等阶段的培养,筛选最适基本培养基、激素配比和浓度,确定欧李3个品种(系)的再生体系,以期为欧李高效快速规模化繁殖提供技术性支持。
1 材料与方法
1.1 材料
宁夏农林科学院枸杞所田间种植的3个欧李优良种质资源SN6、SN7、YC24。
1.2 方法
1.2.1 材料表面消毒和接种 田间剪取欧李苗木上部嫩枝,流水冲洗10 min,置于无菌操作台,75%乙醇浸泡30 s后,立刻用无菌水漂洗3~4次;0.1%升汞浸泡8 min,再用无菌水漂洗5~6次;接着用无菌滤纸吸干嫩枝多余水分,剪成含有2个腋芽以上的茎段(茎段长为2~5 cm),最后接种到培养基上,在贯流组培箱培养。
1.2.2 培养条件及培养基制备 培养温度为(25±2)℃,光照条件16 h黑暗/8 h光照,光照强度2000 lx。
(1)分化培养基。4.42 g/LMS、30 g/L蔗糖、4.5 g/L琼脂,添加4种植物生长调节剂构成4种不同分化培养基,如表1,调节pH 5.8左右。每个处理重复3次,40天后观察分化情况并统计分化率[式(1)]和分化系数[式(2)]。

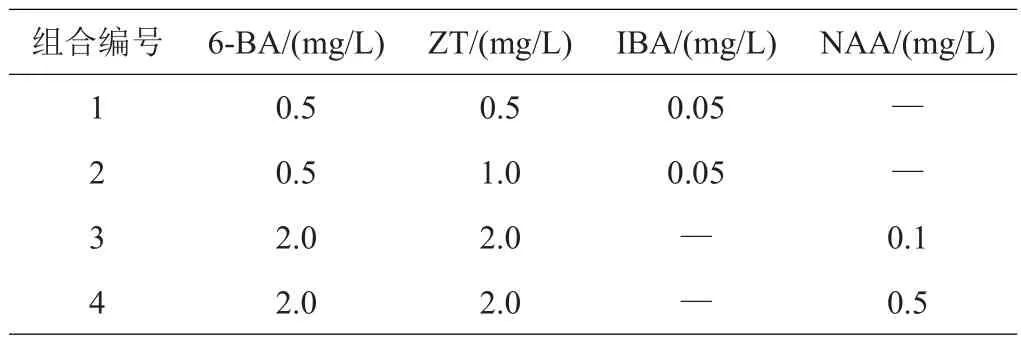
表1 分化培养基激素组合
(2)生根培养基。4.42 g/L1/2MS、30 g/L蔗糖、4.5 g/L琼脂,添加3种不同的植物生长调节剂和1种附加物,配制11种生根培养基,如表2,调节pH 5.8左右。每个处理重复3次,40天后观察生根情况并统计生根率[式(3)]。

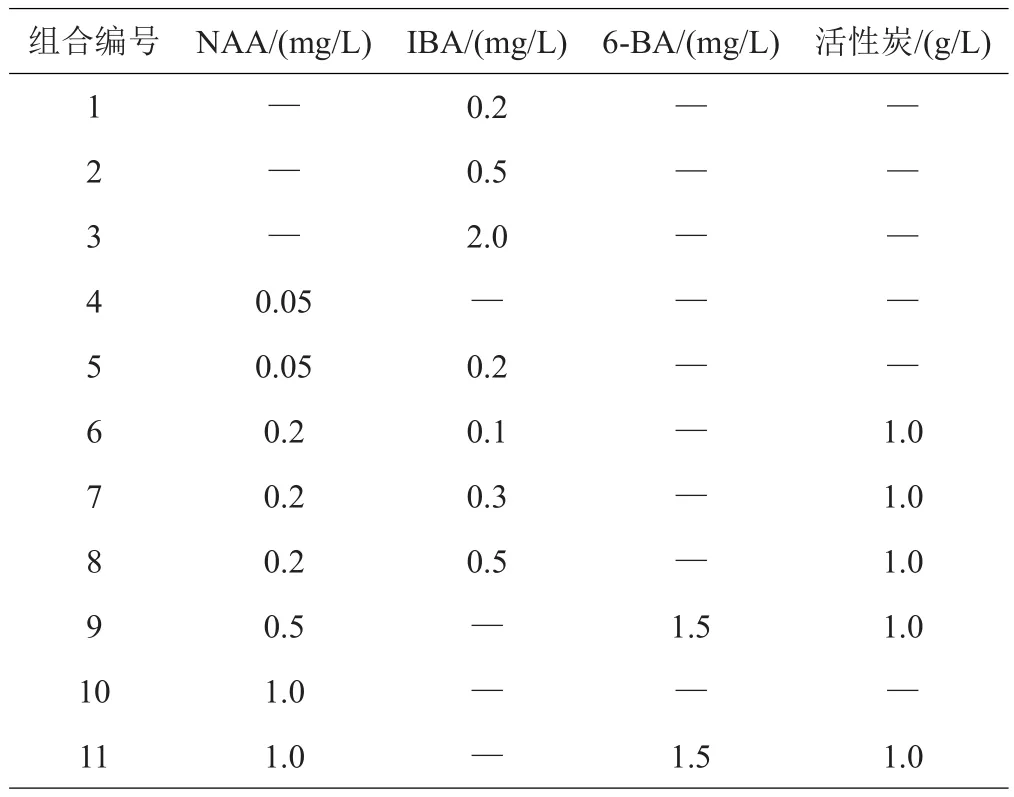
表2 生根培养基激素组合
1.2.3 数据统计与分析 选用SPSS 13.0 One-Way ANOVE程序完成数据采集,用Duncan检验进行显著性分析。
2 结果与分析
2.1 抗生素浓度对欧李外植体内生菌的影响
植物组织培养中,内生菌造成的污染是影响植物再生体系建立的重要限制因素。为有效消除欧李外植体内生菌,提高成活率,减少污染率,在培养基中添加4种不同浓度的头孢霉素。如表3,随着头孢霉素浓度的提高,外植体的污染率逐渐降低,成活率显著提高。头孢霉素浓度为100 mg/L时,外植体成活率最高,污染率最低。
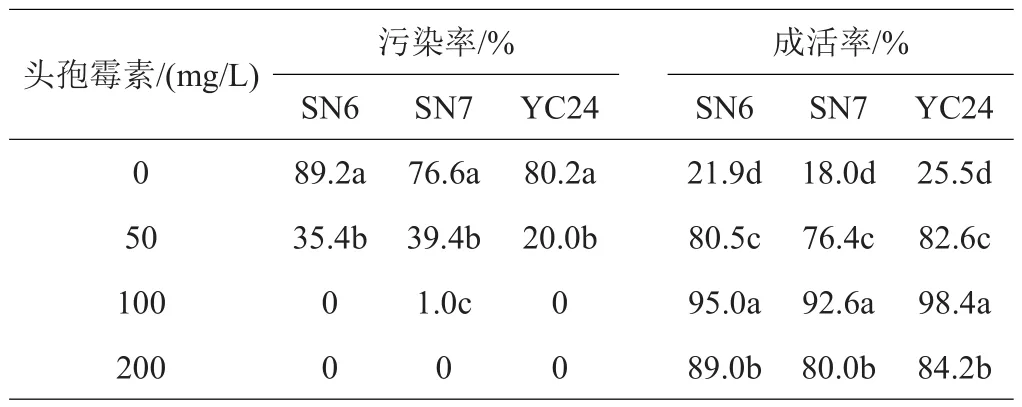
表3 头孢霉素浓度对欧李外植体内生菌的影响
2.2 欧李的分化培养
将消毒灭菌后的茎段外植体接种于不同激素组合的培养基中分化培养。10天后腋芽部形成幼小再生株系,40天后形成丛生芽(图1)。统计不同品种在不同激素组合上的分化率,结果如图2。激素组合1和2在3个品种中的分化率都较好,其中2号组合表现最佳。就品种而言,YC24的分化率最高,SN6次之,SN7最低。根据结果,认为2号激素组合是适宜本地种植的3个优良种质的最佳分化培养基。

图1 分化培养过程
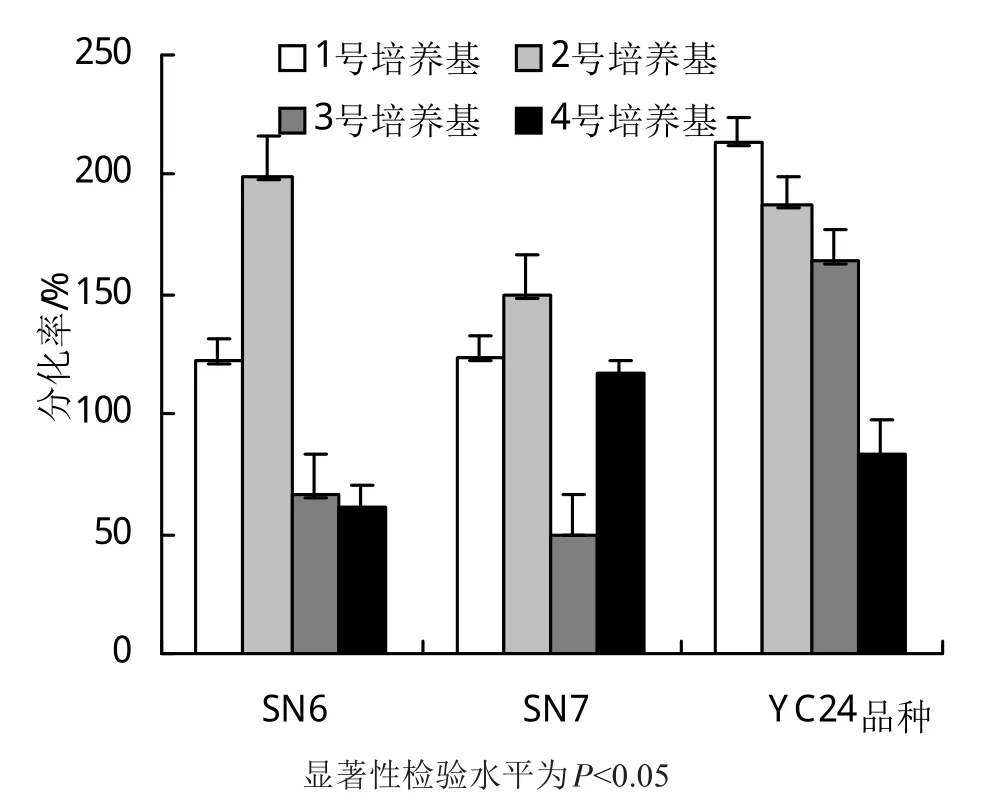
图2 3个欧李品种在不同激素组合培养基上的分化情况
2.3 分化周期对欧李增殖的影响
将欧李继代培养于筛选出的分化培养基中,培养时间设置为20、25、30、35、40、45天,各处理连续继代5次,观察统计继代周期对欧李增殖分化影响。结果(图3)表明,随着继代周期的延长,丛生芽苗的生长势增强,继代周期为30~35天的芽苗的生长分化速度最快。继代超过40天,芽的生长速度明显减慢。因此,确定芽苗在增殖过程中继代周期以30~35天为宜。
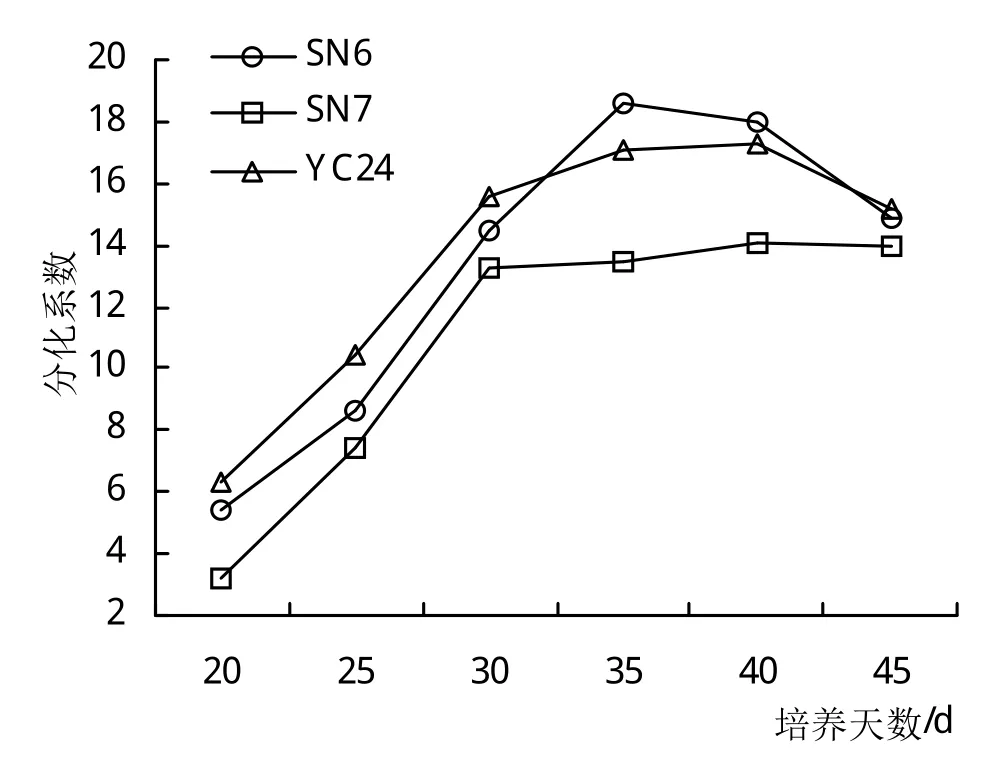
图3 不同继代周期对增殖培养影响
2.4 欧李的生根培养
将分化培养所得的组培苗接种于生根培养基中培养,10天左右可观察到白色不定根,40天左右根系较发达、分支多(图4)。各培养基的生根率如表4,激素组合6号和7号在3个品种中的生根率较其他组合有显著差异。其中SN6的最高生根率可达67.0%,SN7和YC24最高生根率为33.1%、30.0%。因此,认为3号激素组合培养基是SN6的最适生根培养基,但SN7和YC24生根效果不理想。

图4 生根培养过程
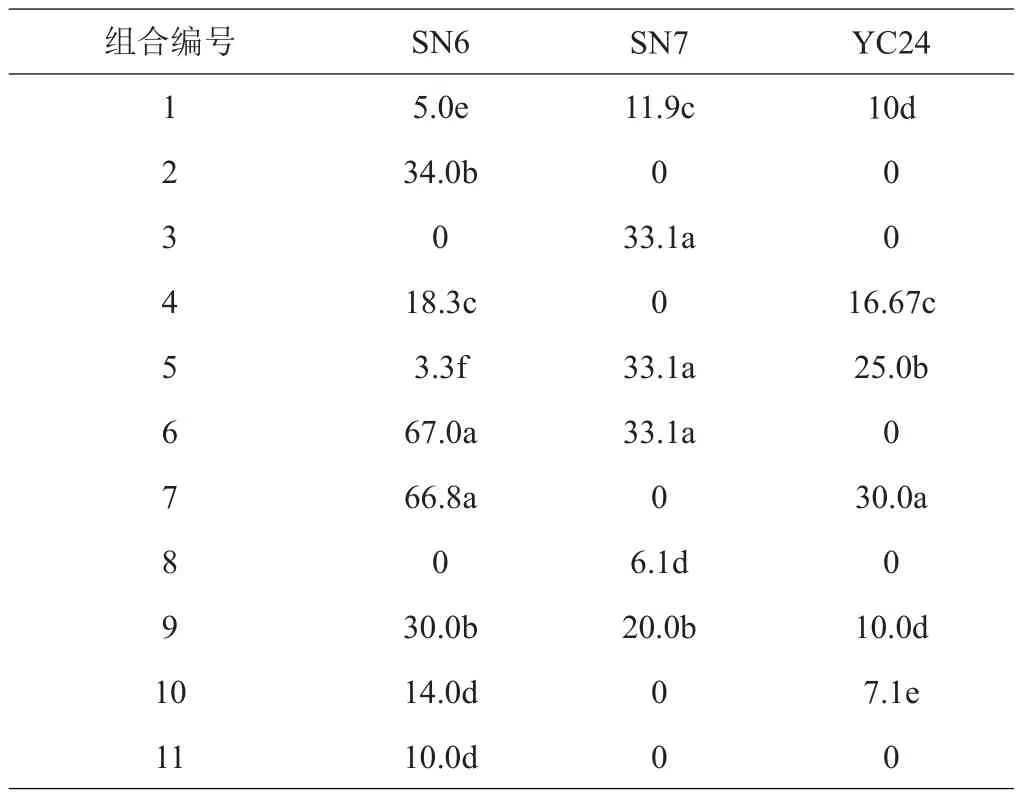
表4 3个欧李品种在不同激素组合培养基上的生根率 %
2.5 矮壮素对欧李生长的影响
针对优良品系SN7和YC24组培过程中生根速度慢、生根率低、苗细弱等问题,以生根率较高的6号激素组合生根培养基为对照,设计添加3种不同浓度的矮壮素(CCC)处理,30天后观察统计不同处理对优良品种(系)生根情况。结果表明,添加CCC后,欧李株高显著降低,茎秆表现较未加CCC粗壮,叶片显著增大(图5);随着CCC浓度的增加,生根率呈现先提高后降低的趋势,当CCC浓度达到15 mg/L时,对欧李生根具有显著的促进作用,YC24、SN7生根率分别达到53.3%和46.7%,分别较对照提高了23.3和13.7个百分点(表5)。综上,初步筛选获得了适合欧李优良品种(系)壮苗与生根一步培养的培养基。

图5 矮壮素对生长的影响
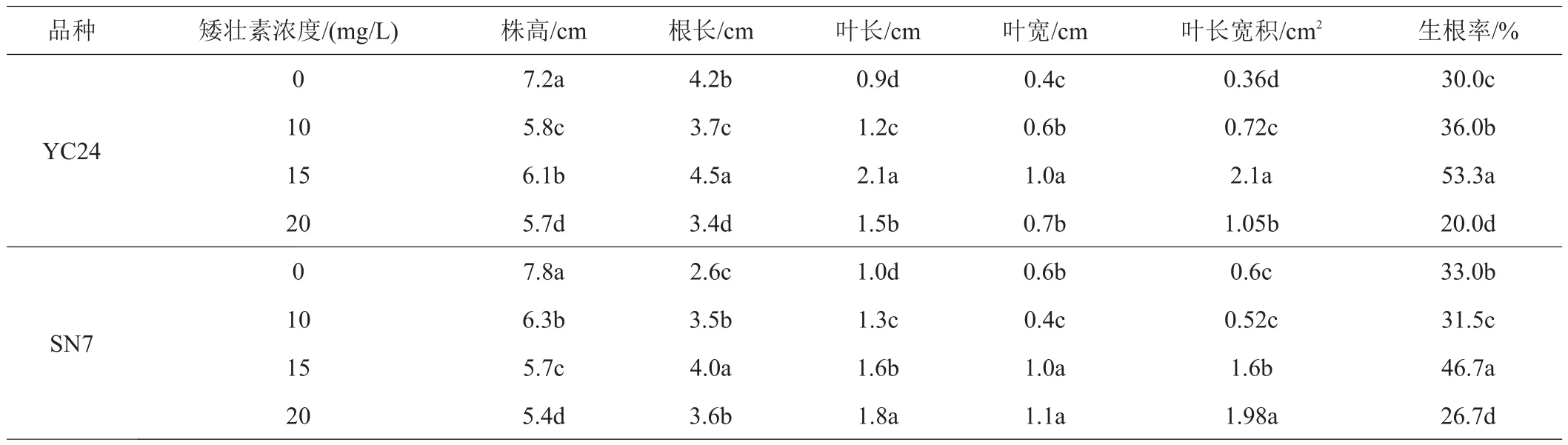
表5 矮壮素对欧李优良品种组培苗生长指标的影响
3 结论
研究明确了不同抗菌素浓度对3个欧李优良品种(系)内生菌的抑制效果,有效降低了外植体污染率。筛选获得适宜欧李分化与增殖培养的激素组合和分化周期,3个优良品种(系)分化系数均达14以上。在明确11种激素组合对欧李生根培养影响的基础上,针对YC24等优系生根率低、速度慢等问题,筛选获得了生根壮苗一步培养基,使组培苗生根率由25.0%提高至53.3%。
试验通过探索外植体表面消毒、分化和生根的最适培养基和浓度,建立了欧李嫩枝快速繁殖体系,确定了适宜本地种植的3个优良种质的最适培养基和激素浓度。为优良种质的后续练苗移栽、扩大培养和推广应用奠定了基础。
4 讨论
利用植物组织培养与快繁技术,可以在很短时间内建立高效的快速繁殖体系,但是在离体快繁过程中,特别是初代启动培养过程中,外植体的带菌状况会直接影响培养体系的建立,所以有必要对采自田间的外植体消毒灭菌。目前关于外植体的消毒研究主要集中在消毒剂的选择与消毒时间探索[23-25],本试验在结合前人探索的基础上,在初代培养过程中加入100 mg/L头孢霉素,进一步降低了污染率、提高了成活率,为无菌培养体系奠定了基础。
植物生长调节物质对植物细胞的分裂、分化产生影响。一定浓度配比的细胞分裂素和生长素对丛生芽的诱导、增殖和生根发挥着重要作用[26]。分化培养阶段,细胞分裂素IBA的存在较生长素NAA有更高的分化率,说明细胞分裂素在欧李外植体分化阶段起着至关重要的作用。而较高浓度的细胞分裂素ZT与IBA的组合使用,能够获得更高的分化率。IBA浓度与梁伟玲[27]的结果相同,不同之处在于本试验添加ZT获得了更高的分化率。生根培养阶段,较低浓度的IBA有利于根形成,这与杜艳丰[28]1.0 mg/L IBA是最适生根浓度的结果不同。这可能是由于欧李品系不同,枝条生长特性有差异。适当浓度的生长素NAA能够促进生根率提高,表明生长素有利于根的生成,这与邢一帆[29]在其研究中生根培养阶段NAA具有关键作用的结论一致。生根培养时加入少量活性炭,能够防止褐变,并通过创造黑暗环境和吸附非极性物质和色素等有害物质而有利于生根[30]。但活性炭的浓度加入超过1.0 g/L时,会使外植体变黄,逐渐枯死。许建兰[31]在以Damas1869李腋芽为材料的研究中,加入0.05%活性炭获得了最佳的生根效率。本试验中加入0.2 g/L获得了较好的生根率。赵文魁[32]的研究表明,适量浓度的矮壮素对马铃薯脱毒试管苗有较好的生根壮苗效果。在木本植物杨树的组培过程中添加适量浓度的矮壮素能够促进其生根并提高移栽成活率[33]。本试验中筛选得出欧李优良品种的最适矮壮素添加浓度为15 mg/L。
本试验以引进和自育的欧李优良品种(品系)为研究对象,通过系统研究芽诱导、增殖、生根等组织培养中关键环节,建立高效的组培快繁技术体系,为欧李快速规模化繁育提供技术支撑。其中欧李组培苗生根培养是工厂化种苗繁育的关键环节,针对欧李生根速度慢、生根率的问题,通过调整生根培养基中生长素和细胞分裂素配比,添加附加物等方法,筛选获得了生根壮苗一步培养法,有效缩短了生根时间,大幅提高了生根率,为欧李组培高效快繁体系的建立提供了参考。

