螺旋霉素超细粉的喷干法和反溶剂法制备及性质研究
朱鸿维?陈梦昱?刘志伟?张鲁斌?王佳丽?牛亚倩?王建豪?夏行昊?张晓南

摘要:目的 螺旋霉素原料藥粉的粒径大、团聚现象严重,因此极大的限制了其临床应用;有研究报道超细粉制备技术可以很好地解决这些问题; 方法 采用了两种代表性的方法制备螺旋霉素的超细粉:分别为喷雾干燥法和反溶剂法;并以粒径为指标,采用单因素实验优化得到最佳结果,对上述两种方法制备的粉体分别进行粒径、形貌特征和物化性质对比。结果 两种方法的最佳条件为:喷雾干燥法的进料速度为5 mL/min,雾化空气速度为800 L/h,进口温度为150℃,出口温度为85℃,平均粒径为(1638±10.99) nm。反溶剂法在25℃条件进行实验,溶剂与反溶剂的比例为1:5,最佳搅拌速度为1000 r/min,获得的平均粒径为(230±7.31)nm,以上结果经过扫描电子显微镜(SEM),动态光散射(DLS),傅立叶变换红外光谱(FTIR),差示扫描量热仪(DSC)和X射线衍射(XRD)进行表征;经气相色谱检测,两种方法中的溶剂残留均符合ICH最低标准(5000 ppm);结论 与喷雾干燥法相比,反溶剂法制备的螺旋霉素粒径更小、粉体分散性更佳,其溶解度更高。因此反溶剂法制备的螺旋酶素微粉更适用于制药业,为微粉技术提供技术思路。
关键词:螺旋霉素;喷雾干燥;反溶剂;溶解;粒径
中图分类号:R978.1, R453文献标志码:A
Preparation and properties of spiramycin micro-powder by spray drying and antisolvent method
Zhu Hong-wei1,2, Chen Meng-yu1, Liu Zhi-wei1, Zhang Lu-bin1, Wang Jia-li2, Niu Ya-qian2, Wang Jian-hao2,
Xia Xing-hao2, and Zhang Xiao-nan1,2
(1 Shool of Jiaying University, Meizhou 541000; 2 Northeast Agricultural University, Harbin 150030)
Abstract Objective Spiramycin powder has large particle size and serious agglomeration, which greatly restricts its clinical application. It has been reported that ultrafine powder preparation technology can solve these problems well. Methods Two representative methods were used to prepare spiramycin ultrafine powder: spray drying method and anti-solvent method. Aim for particle size, single factor experimental optimization was used to obtain the best results. The particle size, morphology and physical and chemical properties of the powders prepared by the above two methods were compared respectively. Results The optimal conditions of the two methods were as follows: the feeding speed of spray drying was 5 mL/min, the atomized air speed was 800 L/h, the inlet temperature was 150℃, the outlet temperature was 85℃, and the average particle size was 1638±10.99 nm. The anti-solvent method was tested at 25℃, and the ratio of solvent to anti-solvent was 1:5. The optimal stirring speed was 1000 r/min, and the average particle size was 230±7.31 nm. The above results were characterized by scanning electron microscopy (SEM), dynamic light scattering (DLS), fourier transform infrared spectroscopy (FTIR), differential scanning calorimeter (DSC) and X-ray diffraction (XRD). By gas chromatography, the solvent residues in both methods met the ICH minimum standard (5000 ppm). Conclusion Compared with spray drying method, spiramycin prepared by anti-solvent method has smaller particle size, better powder dispersion and higher solubility. Therefore, spirase micropowder prepared by anti-solvent method is more suitable for pharmaceutical industry and provides technical ideas for micropowder technology.
Key words Spiramycin; Spray drying; Anti-solvent; Dissolve; Particle size
螺旋霉素(C43H74N2O14,分子量:843.06)来源于竹链霉菌培养基,并从中获得16种单体化合物组成的大环内酯类抗生素(图1)[1],是一种广谱抑菌剂[2]。螺旋霉素对金黄色葡萄球菌[3]、溶血性链球菌[4]、白喉棒状杆菌、革兰阳性球菌、金黄色芽孢杆菌、革兰阴性球菌[5]、军团菌和支原体等具有很强的抑制作用[6];同时也对口咽呼吸,尿路感染[7],隐孢子虫病,弓形虫[8-9]和其他疾病具有良好的治疗作用。它被广泛用于家畜的抗菌治疗,例如牛、猪、鸡、鸭和其他家禽[10-11]。主要通过结合细菌核糖体的50S亚基来阻断肽链的延伸并影响细菌蛋白质的合成[12-13]。市面销售的螺旋霉素原粉的生物利用度低,这是由其固有的高密度物理结构引起的,这种结构决定了其水溶性差和生物利用度低[14-15],限制了其临床应用[16]。
根据Noyes-Whitney方程,溶解速率与溶解介质暴露的比表面积成反比例[17-18],因此有多种方法对难溶性大颗粒进行制备,获得粒径小,比表面积增大,粒径范围小于1 μm的超细粉体,以期达到增溶的效果;以往制备超细粉的传统方法包括固体分散[19]、球磨[20]、超临界快速膨胀[21-22]和超临界反溶剂[23-24]等方法;然而以上研究方法都具有一定的缺点和不足;固体分散制备的样品保存期短,样品的含量和添加剂也会影响其功效性;球磨法的能耗高,溶解效果较差;而超临界快速膨胀和超临界反溶剂法虽然制备的粉体细小均匀,但成本非常高,此外超临界的设备结构复杂,保养和维修起来困难,且具有产量小的缺点。
喷雾干燥法是通过热风干燥原理制备微粉,首先配制一定浓度溶液,其次通过一定压力系统的传送,溶液通过高压喷嘴射流在干燥室内,在这个过程中溶剂和水分被迅速去除,短时间内形成了干燥的超细粉末[25];这种方法常用来大规模生产干燥粉末,无需粉碎和其他程序;喷干法具有产量大、时间短、溶剂可回收再利用的优点,和其他制备微粉的方法相比,喷雾干燥法制备的微粉具有疏松,密度小的特点,因此被广泛应用于保健品和制药行业[26]。
反溶剂法是一种便捷的超微粉制备方法,它将药物搭配不同体系的溶剂,通过两相溶剂充分混合,引起的过饱和度增大,在反溶剂的基础上将药物析出,这个过程是通过微孔射流技术形成了超微粒子;由于反溶剂具有较高的药物得率、溶剂可回收再利用和高效环保等特点,因此在医药工业中得到了广泛应用[27-28];反溶剂微粉技术已成功用于银杏叶提取物[29],厚朴酚[30]和鞣花酸[31]的制备。因此,尝试采用反溶剂技术制备螺旋霉素超细粉,以期改善其溶出度。由于上述的喷雾干燥和反溶剂两种方法都具备了操作便捷,溶剂可回收和成本低廉的特点,因此本研究将两种方法应用于制备螺旋霉素超细粉,并进行比较;通过扫描电子显微镜(SEM)观察两种螺旋霉素微粉的外观形貌并进行对比,通过傅立叶变换红外光谱(FTIR),X-射线粉末衍射(XRD)和差示扫描量热法(DSC)对粉体的性质进行表征;对粉体的溶解速度和溶剂残留进行了详细的探讨。
1 材料与方法
1.1 材料和仪器
螺旋霉素的原料(纯度≥96%)购自北京中金生物制药有限公司(乙醇,分析纯),购自北京化学试剂有限公司。实验室去离子水净化系统(恩谊,UPL-10L,中国上海)。喷雾干燥器(BY-2000,上海新兴公司); 反溶剂装置(独立研究,东北农业大学食品科学学院)由进料系统、搅拌系统和反应系统3部分组成。
1.2 螺旋霉素超细粉的制备
1.2.1 喷雾干燥过程
喷雾干燥进样、加热、液体雾化、干粉喷射和旋风分离5个部分组成。首先,配制一定浓度范围(10~50 mg/mL)螺旋霉素乙醇溶液,0.45 μm过滤;实验开始,溶液通过传送系统进样加热,雾化系统的喷射流在高温下立即除去乙醇溶剂,获得干燥的螺旋霉素粉末。使用实验室规模的喷雾干燥设备制备样品,喷射速率范围为2~10 mL/min,喷嘴直径300~600 μm,进出口温度85℃~130℃(表1),螺旋霉素超细粉通过旋风收集到直径为100 mm的收集瓶中,然后转移至低温干燥器保存备用。
1.2.2 反溶剂过程
选择乙醇作为溶剂、水作为反溶剂,通过图2的装置(由真空泵,进样口,高速电机和反应容器组成)制备螺旋霉素超细粉;将原始螺旋霉素溶解在无水乙醇(10~50 mg/mL)中,通過0.45 μm膜过滤,螺旋霉素溶液通过蠕动泵的负压力传送到反溶剂中,两相溶液比例(1: 3~7)充分混合溶液。射流速度2~8 mL/min,在高速匀浆(3000~15000 r/min)体系下,低温有利于生成超细粒子(5~20℃)(表2)。混合溶液以10000 r/min离心10 min,0.22 ?m过滤收集滤饼,并置于60℃烘箱干燥6 h,获得螺旋霉素超细粉。
1.3 螺旋霉素粉体的理化性质
1.3.1 扫描电子显微镜(SEM)
将适量的干燥螺旋霉素原粉,喷雾干燥粉和反溶剂粉进行预处理,分别用双面导电胶带粘贴在观测台上,放置在离子溅射仪的样品室中,并以15 mA的电流喷涂金。使用扫描电镜(JEOL,JSM-6360LV,日本)观察样品的表面形态和结构,并计算平均尺寸。
1.3.2 动态光散射
动态光散射(DLS)用于确定微粉化样品的粒度分布范围(激光粒度分析仪,Zeta Pals,Brookhaven仪器)。用去离子水稀释待测试的样品,在108 W强度条件下超声3 min,避免颗粒粘连团聚,将样品置于DLS观察仓内进行扫描,分析样品的粒度分布情况;以上步骤重复3次,获得水中颗粒物的分布数据,绘制图,表征粒径分布范围。
1.3.3 傅立叶红外光谱(FTIR)观察
采用FTIR(Nicolet,Magna-IR560,美国)测量未处理和处理过的超细样品,观察峰形。 使用KBr作为分散剂,并通过压片法制备待测固体样品。将螺旋霉素粉末与一定比例的KBr充分混合,并在低真空下用液压机(8 T/cm2)对其加压5 min,以获得厚度约为1~2 mm的透明圆圈。在红外干燥箱中干燥2 min后,在4000-1~400cm-1的范围内进行红外扫描分析。
1.3.4 样品的X射线衍射(XRD)
使用XRD(Philips,Expert-pro,荷兰)测试样品粉末,分别将原粉,喷雾干燥粉和反溶剂粉3个螺旋霉素样品研磨成粉末后通过XRD检测;在电流30 mA和电压50 kV的条件下进行,采用Cu KL1照射,扫描范围5°~90°,单位是2θ,扫描速度为3°/min。
1.3.5 溶剂表面残留物分析
在这项研究中,使用配备有G1540N-210火焰离子化检测器和HP-5毛细管柱的气相色谱仪(型号:Agilent 7890A,美国)来检测螺旋霉素超微粉的乙醇残留。首先,制备10 mg/mL的螺旋霉素甲醇溶液,以10000 r/min离心10 min后取上清液5 mL进样。 气相色谱探测器的初始温度为40℃,入口温度为200℃,出口温度为280℃。维持注射5 min后,以40℃/min的速度升温到240℃。
1.3.6 溶解速率实验
考察螺旋霉素的不同样品颗粒在水中的溶解速率并进行了对比[30],在室温条件下,精确称取1.5 g螺旋霉素粉末样品,在室温下溶解于水中,充分混合后形成饱和溶液,在转速为10000 r/min条件离心10 min取上清液,通过高效液相色谱法(HPLC)测定含量。
1.3.7 模拟人工胃肠实验
体外药物释放研究,通过HPLC测定螺旋霉素原粉、喷干粉和反溶剂粉的溶解度,将300 mg样品与15 mL缓冲溶液充分混合,将其置于Slide-A-Lyzer透析袋(Thermo Fisher Science,3500,美国)中,搅拌速度设定为100 r/min,用200 mL人工胃液和人工肠液的培养基,溶液温度设定为37.0℃,在不同的时间点(5、10、15、30、45、60、120、240和360 min)取样,用0.22 μm的滤膜过滤,并用甲醇适当稀释以提取2 mL样品[30]。通过高效液相色谱法测定样品中螺旋霉素的浓度,并绘制标准曲线。使用C18反相柱(Diamonsil,5 μm,250 mm×4.6 mm,Dikma Technologies)进行测定。柱温为25℃,流动相流速为1.0 mL/min的条件下重复实验3次并记录结果。
2 结果与分析
2.1 螺旋霉素的理化评估
采用SEM和DLS分析螺旋霉素样品的外观形貌和尺寸,通过FTIR,XRD和DSC分析螺旋霉素样品的粉体性质[15-16]。
2.1.1 螺旋霉素顆粒的形态
螺旋霉素原粉,喷干粉和反溶剂粉通过扫描电镜分析,结果如图3所示,螺旋霉素原粉颗粒显示出不规则的形状,粉体尺寸大小不均匀,粒径范围为500~1000 nm,而且原粉的黏连现象比较明显,具有这种结构的螺旋霉素粉末在临床应用中的效率可能非常低。与原始螺旋霉素粉(图3a)末相比,螺旋霉素喷干粉(图3b)相对均匀,尺寸稍小,但仍然有较大的颗粒;粉末外观呈半球形。相比较原粉和喷干法制备的粒径,反溶剂法制备的螺旋霉素超微粉(图3c)具有更好的均匀性、分散性和更小的粒度;因此我们推测反溶剂法制备的螺旋霉素超微粉溶解性可能会更好。
2.1.2 动态光散射分析螺旋霉素样品
图4显示了螺旋霉素样品的动态光散射分析,这种方法是在均质溶液系统中选择一个折射点,通过折射点计算小颗粒数量。图4a显示,原始螺旋霉素颗粒的分布范围为100~7000 nm,并且大量粒径集中在约5000 nm的尺寸附近,这表明原始螺旋霉素的颗粒显示出大颗粒或多数粒子团聚体,这可能是由于特定的螺旋霉素制备工艺过程导致的,在螺旋霉素粉结晶的初始过程颗粒自然粘附导致的,因此可以推断这是原始螺旋霉素水溶性差的主要原因。喷干法制备的螺旋霉素粉(图4b)粒径集中在200~500 nm范围内有大量颗粒,同时在2000 nm处也有大量颗粒,这可能是由于在喷雾干燥过程中溶液受热不均匀,溶液喷射过程温度过高引起的 。图4c是反溶剂法制备的螺旋霉素样品的粒径分布图,图4c显示大多数颗粒集中在较小的粒径范围内(约200~400 nm),但是多数粒子集中在200 nm处,与前两个样品相比,反溶剂粉具有更小的粒径和更均匀的粒度分布,这可能决定了其更高的溶解度和生物利用度。原粉的聚合物分散指标(PDI)>0.7,粒子分散均一性差,大颗粒过多,因此水溶性差,而经过制备后的反溶剂超微粉分散系数≤0.3,相比较原粉,粒子均一性较好。
2.1.3 螺旋霉素样的红外光谱
图5所示的螺旋霉素样品通过红外光谱分析仪进行表征,分析范围在500~4000 cm-1,3个样品的曲线和峰型几乎保持一致,以上结果表明制备前和制备后的螺旋霉素样品均没有发生分子结构上的变化[32]。
2.1.4 X-衍射分析螺旋霉素样品
为了进一步研究晶体结构,我们采用XRD分析螺旋霉素样品的结晶形态。图6显示了螺旋霉素粉末的观察结果。螺旋霉素原粉、喷干粉和反溶剂粉的峰型几乎相同,均为无定形态。但喷雾干燥的螺旋霉素粉在12°处有一个额外的小峰(图6b),这很可能是由于高温环境所致,过高的温度在对样品形成有了一定轻微的影响。以上结果表明,上述螺旋霉素样品的曲线基本相同,制备前后无明显的结构变化。
2.1.5 残留溶剂测定
作为医学临床应用产品,螺旋霉素样品涉及残留有机溶剂的问题;乙醇是国际协调会议(ICH)3类的低毒有机溶剂。在这项研究中,使用乙醇溶解螺旋霉素作为溶液,并通过气相GC方法确定溶剂的残留量;如图7a所示,反溶剂超细粉的乙醇的色谱峰时间约为3.63 min,喷雾干燥粉的乙醇峰时间(见图7b)约为3.61 min,标准曲线公式中的峰面积(y)对乙醇浓度(x)的线性回归方程为y=480.79x+23.01,(R2=0.9983)。根据回归方程计算出喷雾干燥法制备的超细粉乙醇残留量为1850 ppm; 反溶剂法制备的超细粉中乙醇残留量为2150 ppm,因此两种方法制备的螺旋霉素超细粉均符合ICH要求的最低标准(<5000 ppm)。
2.1.6 螺旋霉素的溶解速率研究
配制相同浓度的螺旋霉素样品溶液来验证其溶出速率,如图8中所示, 在60 min内原始螺旋霉素的最大饱和浓度为17.87%,而通过喷雾干燥和反溶剂法获得的粉饱和浓度分别为67.05%和95.10%;原粉具有一定的溶解性,但溶出度最低,只有17.87%;而反溶剂法制备的螺旋霉素粉溶出速率高于喷雾干燥粉的溶出速率。在该溶出验证实验中,可以得到3种溶出验证:反溶剂粉> 喷干粉>原粉。
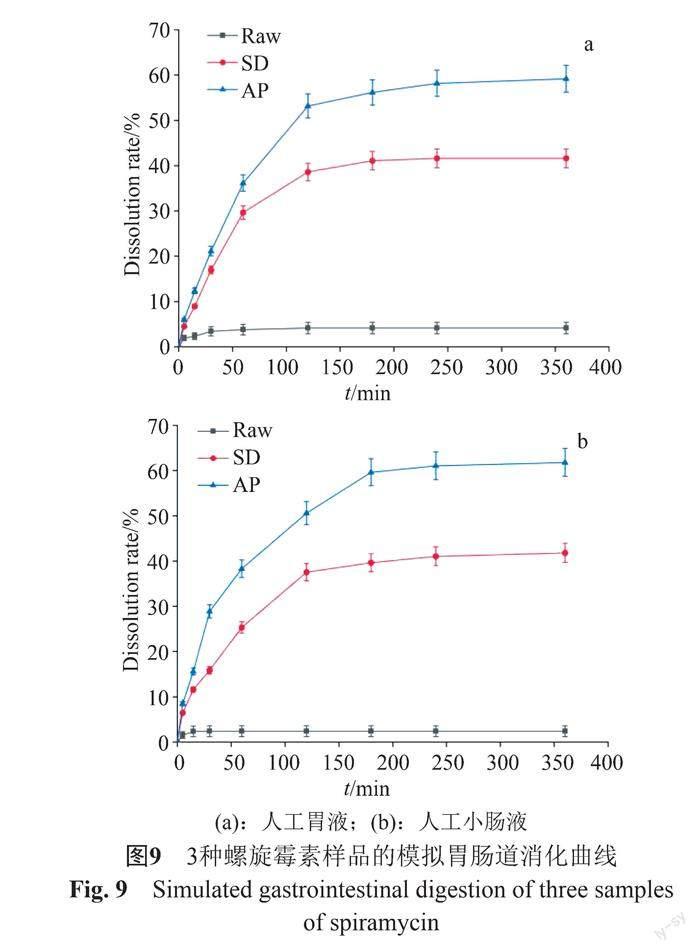
2.1.7 螺旋霉素体外消化模拟分析
螺旋霉素原粉,喷雾干燥粉和反溶剂粉在人工胃液中的平衡溶解度分别为2.04、18.05和23.52 mg/mL,在人工肠液中的平衡溶解度分别为1.8、17.77和24.39 mg/mL。如图9所示,结果表明喷干粉和反溶剂粉均比螺旋霉素原粉的溶解度高出很多倍。但是由于反溶剂粉的粒径较小且更均匀,反溶剂粉的平衡溶解度比喷干粉的平衡溶解度高,因此反溶剂粉具有更高的溶解度。螺旋霉素样品在模拟胃液中的溶出率分别为41.78%和66.78%,这一点略高于在模拟肠液中的溶出率。在模拟人工胃液中反溶剂粉和喷干粉颗粒的平衡溶出度分别比原粉高出8.85倍和11.5倍。模拟人工肠液的平衡溶出度分别是原始粉末的9.87倍和13.51倍。 螺旋霉素超细粉的溶出速率增加主要是由于粒径显著减小和比表面积增加所致。喷干粉在人工胃液和人工肠液中溶解速度分别比原始螺旋霉素粉末快10.5倍和12.5倍。因此,在相同的处理条件下,螺旋霉素样品的溶出度为:反溶剂粉>喷雾干燥粉>原粉。
3 结论与讨论
在这项研究中,分别采用喷雾干燥法和反溶剂法制备螺旋霉素超细粉,将制备好的两个样品与螺旋霉素原粉进行比较,并获得满意的结果。相比较螺旋霉素原粉,制备后螺旋霉素超细粉溶解度得到了很大的提高,同时螺旋霉素的化学性质没有改变。反溶剂粉的溶解度为95.10%,高于喷雾干燥粉的67.05%,这可能是由于反溶剂法制备的螺旋霉素超细粉具有更小的粒径,更均匀的粉体分布和更大的溶解度;反溶剂粉的平均粒径(230 nm)小于喷雾干燥粉平均粒径(1638 nm)。
通过DSC,XRD和FTIR对粉体性质进行表征,结果表明,螺旋霉素原粉,喷雾干燥粉和反溶剂粉的晶体结构,化学性质几乎没有发生改变。同时,对两种制备后的螺旋霉素样品乙醇残留结果(1850 ppm,2150 ppm)测试表明,螺旋霉素超细粉符合ICH最低标准(<5000 ppm),因此適用于制药工业。
通过上述实验我们可以推断出:粉体的溶解度直接与粒径大小相关, 这是因为粒度的减小间接地增加了其表面积,且其饱和溶解度也相应增加;因此溶解速率也将增加[34-35]。同时,我们还得出了结论:反溶剂法制备的螺旋霉素超细粉在人体吸收方面比喷雾干燥法制备的超细粉具有更好的效果。喷雾干燥法是一种非常流行,快速且方便的超细粉技术,已广泛用于批量生产制备中,但是,在这个操作过程中可能会损失大量热能,此外由于喷雾干燥设备自身的结构特点,会导致目标产品损失,而且也不适合加工热敏材料;与喷雾干燥法相比,反溶剂法在制备超细粉剂时具有更大的优势,尤其体现在粒度、溶解度和成本上,同时反溶剂法还适合制备热敏性生物活性粉体,因此我们应进一步优化该工艺,为工业放大生产提供技术平台。
参 考 文 献
Dai J L, Wang Y G, Liu J J, et al. The regulatory genes involved in spiramycin and bitespiramycin biosynthesis[J]. Microbiol Res, 2020, 240 (4): 737-738.
Thomas R, John D, Arie V W. Antibiotic resistance in human chronic periodontitis microbiota[J]. J Periodontol, 2014, 85(1): 160-169.
Mallik A, Das N, Mukherjee S, et al. A Systematic Review and Meta-Analysis of Different Diagnostic Procedures to Detect Gonococcus Infection in Resource-Limited Scenario[J]. Indian J Med Microbiol, 2020, 38(3-4): 299-306.
Takashi A, Sunao T, Tadatoshi K, Antibacterial action of chemotherapeutic agents against non-hemolytic streptococcus sp. isolated from cultured marine fish yellowtail seriola quinqueradiata[J]. Nippon Suisan Gakkaishi, 1983, 49(11): 1673-1677.
Desnottes J, Diallo N. Comparative study of intramacrophagic penetration and action on phagocytosis of a macrolide (spiramycin) and a fluoroquinolone (pefloxacin)[J]. Pathol Biol (Paris), 1990, 38(4): 281-285.
Agapova Y, Talyzina A, Altukhov D, et al. Virtual screening targeting dimerization signals of two mycoplasma HU proteins revealed different types of inhibitors interacting with common binding determinants[J]. Crystallogr Rep, 2019, 64(4): 602-607.
Loria G R, Sammartino C, Nicholas R, et al. In vitro susceptibilities of field isolates of Mycoplasma agalactiae to oxytetracycline, tylosin, enrofloxacin, spiramycin and lincomycin-spectinomycin[J]. Res Vet Sci, 2003, 75(1): 3-7.
Dylewski J, Clecner B, Dubois J, et al. Comparison of spiramycin and doxycycline for treatment of Chlamydia trachomatis genital infections[J]. Antimicrob Agents Chemother, 1993, 37(6): 1373-1374.
Chrusciel T, Samochowiec L, Steffen J, et al. Criteria of efficacy of chemotherapeutic substances in experimental toxoplasmosis and the therapeutic effect of the spiramycin-sulfamethoxydiazine combination in white mice inoculated with Toxoplasma gondii[J]. Presse Med, 1964, 72 (72): 1125-1128.
Avci M E, Arslan F, ?ift?i ?, et al. Role of spiramycin in prevention of fetal toxoplasmosis[J]. J Matern Fetal Neonatal Med, 2016, 29(13): 2073-2076.
Renaudin H, Barbeyrac B, Bebear C. Study of bactericidal effect of the spiramycin and minocycline on mycoplasma pneumoniae[J]. Pathol Biol (Paris), 1987, 35(5): 595-598.
Huebra D, Vincent U, Bordin G, et al. Characterisation of dirithromycin and spiramycin using high performance liquid chromatography and direct infusion mass spectrometry[J]. Anal Chim Acta, 2004, 503(2): 247-256.
Shimizu M, Saito T, Mitsuhashi S. Macrolide resistance in Staphylococcus aureus decrease of spiramycin-binding to 50S ribosomal subunit in macrolide resistant strains of staphylococci[J]. J Antibiot (Tokyo), 1970, 23(9): 467-468.
Coutsogeorgopoulos C. On the accumulation of short peptides in the presence of certain inhibitors of protein synthesis[J]. Arch Biochem Biophys, 1972, 153(1): 199-206.
Hu J, Dong Y. Continuous and scalable process for water-redispersible nanoformulation of poorly aqueous soluble APIs by anti-solvent precipitation and spray-drying[J]. Int J Pharm, 2011, 404(1): 198-204.
Deng W, Wang H, Wun B, et al. Selenium-layered nanoparticles serving for oral delivery of phytomedicines with hypoglycemic activity to synergistically potentiate the antidiabetic effect[J]. Acta Pharm Sin B, 2019, 9(1): 84-96.
Zhang Y, Zhao H, Li Y, et al. Preparation, characterization, and dissolution rate in vitro evaluation of total panax notoginsenoside nanoparticles, typical multicomponent extracts from traditional Chinese medicine. Using supercritical antisolvent process[J]. J Nanomater, 2015, 439540: 1-12.
Lindberg N O, Lundstedt T. The relationship between the dissolution rate and the particle size of prednimustine: A disagreement with the Noyes-Whitney equation[J]. Drug Dev Ind Pharm, 1994, 20(16): 2547-2550.
Sumana N, Chhitij T. Formulation and enhancement of dissolution rate of poorly aqueous soluble drug aceclofenac by solid dispersion method: In vitro study[J]. Afr J Pharm Pharmacol, 2020, 14(1): 1-8.
Choi, H, Lee S, Eom K, Facile phosphorus-embedding into SnS 2 using a high-energy ball mill to improve the surface kinetics of P-SnS_2 anodes for a Li-ion battery[J]. Appl Surf Sci, 2019, 466(2): 578-582.
Zabihi F, Akbarnejad M M, Yazdi A V, et al. Drug nano-particles formation by supercritical rapid expansion method; operational condition effects investigation[J]. Iran J Chem Chem Eng, 2011, 30(1): 7-15.
Türk M, Lietzow R. Stabilized nanoparticles of phytosterol by rapid expansion from supercritical solution into aqueous solution[J]. AAPS Pharm Sci Tech, 2004, 5(4): 56.
Tian Y, Sun Z, Zhang Y, et al. Micro-spherical sulfur/graphene oxide composite via spray drying for high performance lithium sulfur batteries[J]. NanoNanomaterials (Basel), 2018, 8(1): 50.
Liu W, Li Y, Jin A, et al. Supercritical anti-solvent precipitation of micro-particles of ethylcellulose[J]. J Functional Materials, 2005, 36(6): 922-926.
Lee S H, Heng D, Ng W K, et al. Nano spray drying: A novel method for preparing protein nanoparticles for protein therapy[J]. Int J Pharm, 2011, 403(1): 192-200.
Dobry D E, Settell D M, Baumann J M, et al. A Model-Based methodology for spray-drying process development[J]. J Pharm Innov, 2009, 4(3): 133-142.
Dalvi S V, Dave R N. Controlling particle size of a poorly water-soluble drug using ultrasound and stabilizers in antisolvent precipitation[J]. Ind Eng Chem Res, 2009, 48(16): 7581-7593.
Sana S, Boodhoo K, Zivkovic V. Production of starch nanoparticles through solvent-antisolvent precipitation in a spinning disc reactor[J]. Green Process Synth., 2019, 8(1): 507-515.
Zu Y G, Wang L L, Zhao X H, et al. Purification of ginkgo biloba extract by antisolvent recrystallization[J]. Chem Eng Technol, 2016, 39(7): 1301-1308.
Wu W W, Wang L, Wang L L, et al. Preparation of honokiol nanoparticles by liquid antisolvent precipitation technique, characterization, pharmacokinetics, and evaluation of inhibitory effect on HepG2 cells[J]. Int J Nanomedicine, 2018, 13: 5469-5483.
Li Y, Zhao X H, Zu Y G, et al. Preparation and characterization of micronized ellagic acid using antisolvent precipitation for oral delivery[J]. Int J Pharm, 2015, 486(1): 207-216.
Zu Y G, Sun W, Zhao X H, et al. Preparation and characterization of amorphous amphotericin B nanoparticles for oral administration through liquid antisolvent precipitation[J]. Eur J Pharm Sci, 2014, 53: 109-117.
Zu Y G, Wu W W, Zhao X H, et al. Enhancement of solubility, antioxidant ability and bioavailability of taxifolin nanoparticles by liquid antisolvent precipitation technique[J]. Int J Pharm, 2014, 471(1): 366-376.
Mosharraf M, Nystr?m C. Apparent solubility of drugs in partially crystalline systems[J]. Drug Dev Ind Pharm, 2003, 29(6): 603-622.
Leuner C, Dressman J. Improving drug solubility for oral delivery using solid dispersions[J]. Eur J Pharm Biopharm, 2000, 50(1): 47-60.
Mosharraf M, Nystr?m C. Apparent solubility of drugs in partially crystalline systems[J]. Drug Dev Indus Pharm, 2003, 29(6): 603-622.
Leuner C, Dressman J. Improving drug solubility for oral delivery using solid dispersions[J]. Eur J Pharm Bio, 2000, 50(1): 47-60.
收稿日期:2021-06-10
基金項目:梅州市科技专项(No. 2021B0204007)
作者简介:朱鸿维,男,生于1994年,在读硕士研究生,研究方向为超微制备技术, E-mail: hognweizhu@163.com
*通讯作者, E-mail: xiaonanzhang@neau.edu.cn

