盐酸与碳酸钠分步反应探究实验装置的改进
郭雨琦 孟庆华 刘翠 邢蓓蓓
摘要: 在评析相关文献工作的基础上,根据盐酸与碳酸钠分步反应的原理,探析盐酸与碳酸钠反应过程中模拟的pH、 CO2浓度变化的双纵坐标曲线应具有的特征。为获得接近该模拟曲线的实验数据,采用蠕动泵、真空循环泵对实验装置进行改进,优化实验条件。实验结果表明,盐酸溶液与碳酸钠溶液均为0.01mol/L、滴定速度约为5mL/min、空气循环流速度为第三档的条件下,较准确地反映了反应物之间的量比关系,改善了CO2浓度测定数据滞后等问题,获得的pH、 CO2浓度变化的双纵坐标曲线与模拟曲线基本一致。
关键词: 碳酸钠溶液; 盐酸溶液; 反应机理; 实验装置改进
文章编号: 1005-6629(2022)11-0070-05
中图分类号: G633.8
文献标识码: B
1 问题提出
碳酸钠、碳酸氢钠与酸的反应是苏教版高中化学教材(必修)第一册中“碳酸钠、碳酸氢钠”一节的教学内容,其中“学以致用”栏目中“表3-6碳酸鈉与碳酸氢钠的性质比较”中描述:“碳酸钠、碳酸氢钠与酸反应都放出CO2气体,但NaHCO3与酸反应比Na2CO3更剧烈”,这种
宏观的实验现象隐含的微观原因是什么?一般学生根据实验现象均认为是NaHCO3与酸的反应比Na2CO3与酸的反应速率快,而真正的微观原因是Na2CO3与酸的反应是分步进行的:Na2CO3与酸反应先生成NaHCO3,过量的酸继续与NaHCO3反应生成CO2气体。如何让学生更容易理解掌握碳酸钠与盐酸反应是分步进行的,进而建构多元弱酸盐与较强酸反应的认知模型?教育学理论认为,形象思维可以降低抽象内容的学习困难,有助于学生更好地理解抽象的概念和理论[1,2]。所谓形象思维就是利用感官直接接受具体形象的信息,在头脑中形成表象,再利用这些表象进行类比、概括、联想、想象等思维加工直至形成认识。中学化学中的数字化实验就是将抽象知识可视化进而充分发挥学生的形象思维作用的重要手段。获得的数据和图像将直观有效地呈现Na2CO3与酸分步反应的机理和反应的微观本质。
2 相关文献简评
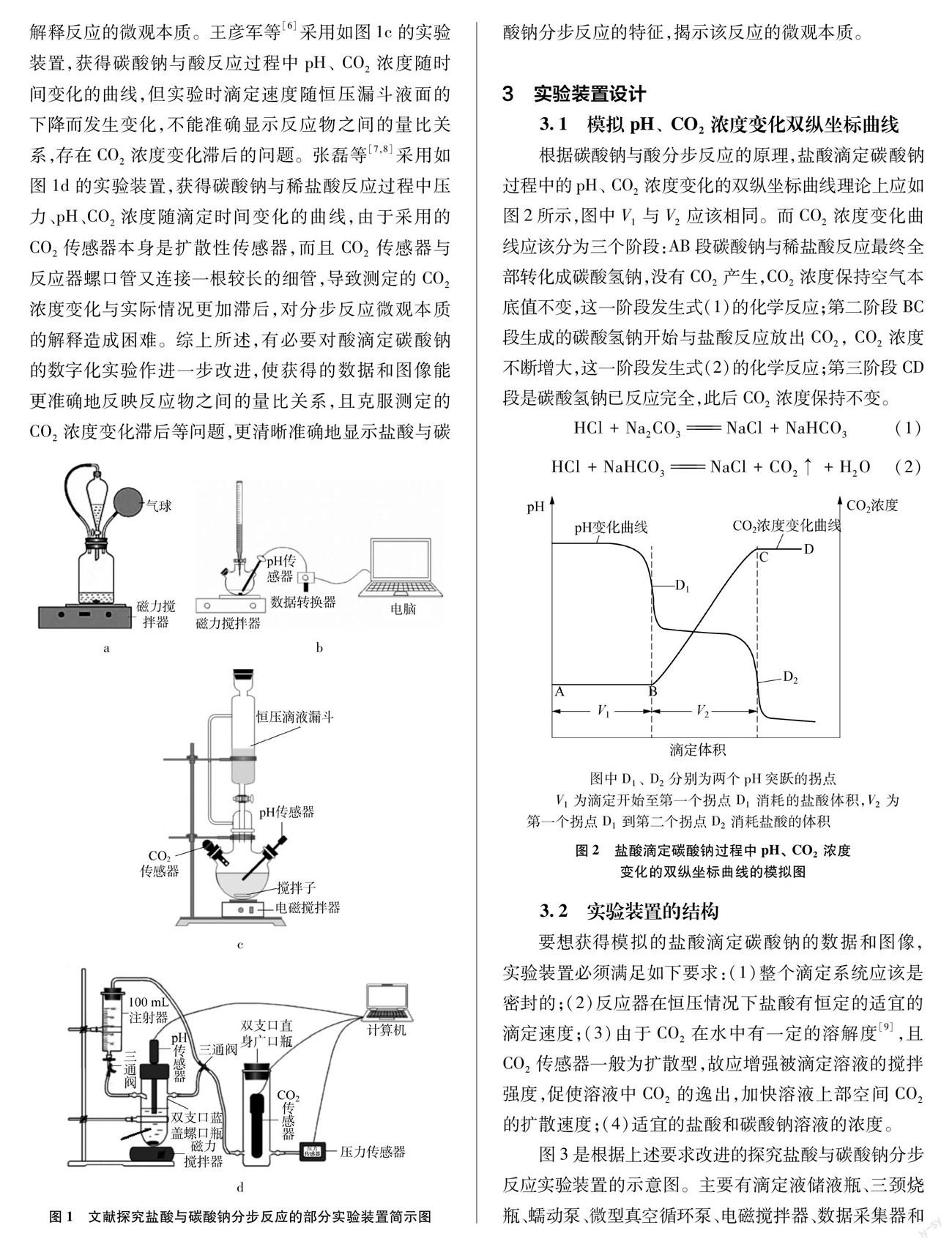
有关Na2CO3与酸的分步反应许多研究者已做了大量的探究工作,早期的文献报道主要集中在对传统实验装置的改进以及对实验条件的探寻,使分步反应的实验现象更明显、易于观测等[3]。随着数字化技术的发展,将压强传感器、pH传感器、CO2传感器与数据采集器和计算机依次相连,采集实验过程中多种物理量(如压强、pH、 CO2浓度)的变化数据并以图像形式呈现,可视化地显示了分步反应的特征,经过软件对数据进行分析,学生通过形象思维就比较容易获得实验结论。伍强等[4]采用了如图1a所示的恒压式实验装置来探究Na2CO3溶液与酸的互滴反应,但实验结果对现象背后反应的本质仍难以解释清楚,用该装置进行实验时,要求盐酸与碳酸钠溶液的浓度要严格一致,否则对实验现象尤其是颜色的观察会有影响。符吉霞等[5]采用如图1b的装置记录碳酸钠与酸反应过程中pH随时间的变化曲线,只能说明反应是分步进行的,但不能解释反应的微观本质。王彦军等[6]采用如图1c的实验装置,获得碳酸钠与酸反应过程中pH、 CO2浓度随时间变化的曲线,但实验时滴定速度随恒压漏斗液面的下降而发生变化,不能准确显示反应物之间的量比关系,存在CO2浓度变化滞后的问题。张磊等[7,8]采用如图1d的实验装置,获得碳酸钠与稀盐酸反应过程中压力、pH、CO2浓度随滴定时间变化的曲线,由于采用的CO2传感器本身是扩散性传感器,而且CO2传感器与反应器螺口管又连接一根较长的细管,导致测定的CO2浓度变化与实际情况更加滞后,对分步反应微观本质的解释造成困难。综上所述,有必要对酸滴定碳酸钠的数字化实验作进一步改进,使获得的数据和图像能更准确地反映反应物之间的量比关系,且克服测定的CO2浓度变化滞后等问题,更清晰准确地显示盐酸与碳酸钠分步反应的特征,揭示该反应的微观本质。
3 实验装置设计
3.1 模拟pH、 CO2浓度变化双纵坐标曲线
根据碳酸钠与酸分步反应的原理,盐酸滴定碳酸钠过程中的pH、 CO2浓度变化的双纵坐标曲线理论上应如图2所示,图中V1与V2应该相同。而CO2浓度变化曲线应该分为三个阶段:AB段碳酸钠与稀盐酸反应最终全部转化成碳酸氢钠,没有CO2产生,CO2浓度保持空气本底值不变,这一阶段发生式(1)的化学反应;第二阶段BC段生成的碳酸氢钠开始与盐酸反应放出CO2, CO2浓度不断增大,这一阶段发生式(2)的化学反应;第三阶段CD段是碳酸氢钠已反应完全,此后CO2浓度保持不变。
HCl+Na2CO3NaCl+NaHCO3(1)
HCl+NaHCO3NaCl+CO2↑+H2O(2)
图中D1、 D2分别为两个pH突跃的拐点
V1为滴定开始至第一个拐点D1消耗的盐酸体积,
V2为第一个拐点D1到第二个拐点D2消耗盐酸的体积
3.2 实验装置的结构
要想获得模拟的盐酸滴定碳酸钠的数据和图像,实验装置必须满足如下要求:(1)整个滴定系统应该是密封的;(2)反应器在恒压情况下盐酸有恒定的适宜的滴定速度;(3)由于CO2在水中有一定的溶解度[9],且CO2传感器一般为扩散型,故应增强被滴定溶液的搅拌强度,促使溶液中CO2的逸出,加快溶液上部空间CO2的扩散速度;(4)适宜的盐酸和碳酸钠溶液的浓度。
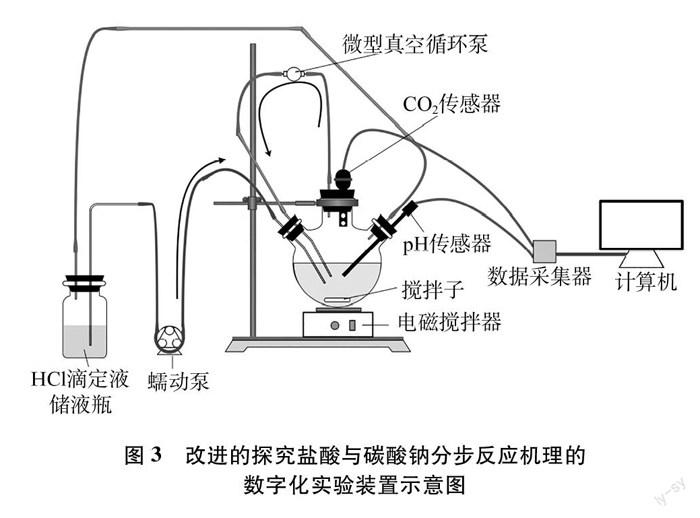
图3是根据上述要求改进的探究盐酸与碳酸钠分步反应实验装置的示意图。主要有滴定液储液瓶、三颈烧瓶、蠕动泵、微型真空循环泵、电磁搅拌器、数据采集器和计算机(包括相关数据采集、处理软件)等组成。储液瓶、三颈烧瓶各开口用直径不同、带孔的橡胶塞密封。蠕动泵可使滴定液的滴加速度恒定不变,并可方便调节滴定速度。储液瓶与三颈烧瓶用橡胶管连通,可使滴定系统气压保持平衡。滴定过程中使用电磁搅拌器
搅动三颈烧瓶中的溶液。微型真空循环泵驱动空气通入溶液中加强溶液搅动强度,使溶解其中的CO2逸出,加快系统内CO2的扩散,克服CO2传感器检测的滞后问题。利用数据采集器的两个通道同时采集滴定过程中的pH、 CO2浓度的数据,为方便比较采用双纵坐标曲线直观显示二者的变化。
4 仪器和药品试剂
4.1 仪器
威尼尔(Vernier)CO2-BAT型CO2传感器、威尼尔(Vernier)PH-BAT型pH传感器、威尼尔(Vernier)LabQuest Mini型数据收集器、数据采集软件(Logger Pro3.14.1)、威尼尔(Vernier)STIR电磁搅拌器、HY-V1微型真空循环泵(科斯达机电)、(为微型真空循环泵供电)24V可变直流电源、BT100-2J蠕动泵(220V交流供电,保定兰格恒流泵有限公司)、外径5mm壁厚1mm硅胶软管、500mL三颈烧瓶(定制)、500mL广口试剂瓶
4.2 药品试剂
碳酸钠(分析纯,西陇科学股份有限公司)、碳酸氢钠(分析纯,国药集团化学试剂有限公司)、浓盐酸(分析纯,西陇科学股份有限公司)、纯净水
溶液的配制:1.0mol/L HCl溶液储备液;1.0mol/L Na2CO3溶液储备液;1.0mol/L NaHCO3溶液储备液;不同浓度的上述各种溶液可分别取上述储备液用纯净水稀释获得。
5 实验部分
5.1 空气循环泵的使用方法
改进的实验装置采用微型真空循环泵的型号是HY-V1,直流电压供电,最大工作电压为24V。泵头有一个进气口和一个出气口,最大空气流速为12L/min,根据提供给真空循环泵电压大小(0V、 8V、 16V、 24V)分别将空气循环流速定义为0档、1档、2档和3档。
设置不同的工作电压可改变空气循环流速,0V即空气不循环,电压越大空气循环流速越快。
5.2 蠕动泵的使用方法
蠕动泵又叫恒流泵或软管泵,由驱动器、泵头和软管三部分组成;蠕动泵通过泵头上的滚轮对泵软管进行交替挤压,在管内形成负压,液体从泵软管进口端吸入,从出口端流出,就像用手指挤压一根充满液体的软管,随着手指向前滑动管内的液体便向前移动。实验中采用外径5mm壁厚1mm硅胶软管,设置蠕动泵驱动器不同的转速,使滴定速度分别为5mL/min、 7.5mL/min、 10mL/min和15mL/min。
5.3 实验步骤
按图3所示组装实验装置,实验操作步骤如下:
(1)将滴定液装入干燥洁净的滴定液储液瓶中;
(2)打开蠕动泵、微型真空循环泵、电磁搅拌器、计算机电源(并启动数据采集处理软件),设置各仪器的工作参数;
(3)(滴定液首次使用时)启动蠕动泵工作一段时间,用滴定液冲洗管道并使管内充满滴定液;
(4)清洗三颈烧瓶,并将适量体积的碳酸钠溶液(被滴定液)定量移入洁净的三颈烧瓶中,检查确认滴定系统处于密封状态;
(5)先启动微型真空循环泵、电磁搅拌器工作,然后启动蠕動泵,同时开始数据采集,进行滴定分析;
(6)需结束滴定分析时,先停止数据采集(并保存数据),然后依次停止蠕动泵、电磁搅拌器以及微型真空循环泵的工作。
6 实验结果与讨论
6.1 浓度对pH、 CO2浓度双纵坐标曲线形状的影响
在探究盐酸与碳酸钠分步反应的文献中,盐酸溶液与碳酸钠溶液浓度一般均采用相同的浓度值,但不同文献中溶液的浓度是不同的,浓度范围一般在0.1~1.0mol/L之间。
本文最终所采用碳酸钠、碳酸氢钠以及盐酸溶液的浓度均为0.01mol/L。
实验发现,若按文献采用的最小浓度0.1mol/L,将20.00mL Na2CO3溶液定量转移至500mL三颈烧瓶中进行滴定分析时,滴定曲线在第二个拐点D2后CO2浓度已超出CO2传感器的检测上限。于是便不断降低浓度进行实验,当浓度为0.01mol/L时,在较优的真空循环泵空气循环流速和滴定速度下,pH、 CO2浓度的变化曲线比较接近模拟曲线。若浓度低于0.01mol/L后,则pH变化曲线的第一突跃就不太明显,CO2浓度的变化也因生成量太少而有滞后现象,因此确定溶液的浓度均为0.01mol/L较为适宜。
6.2 空气循环流速对pH、 CO2浓度双纵坐标曲线形状的影响
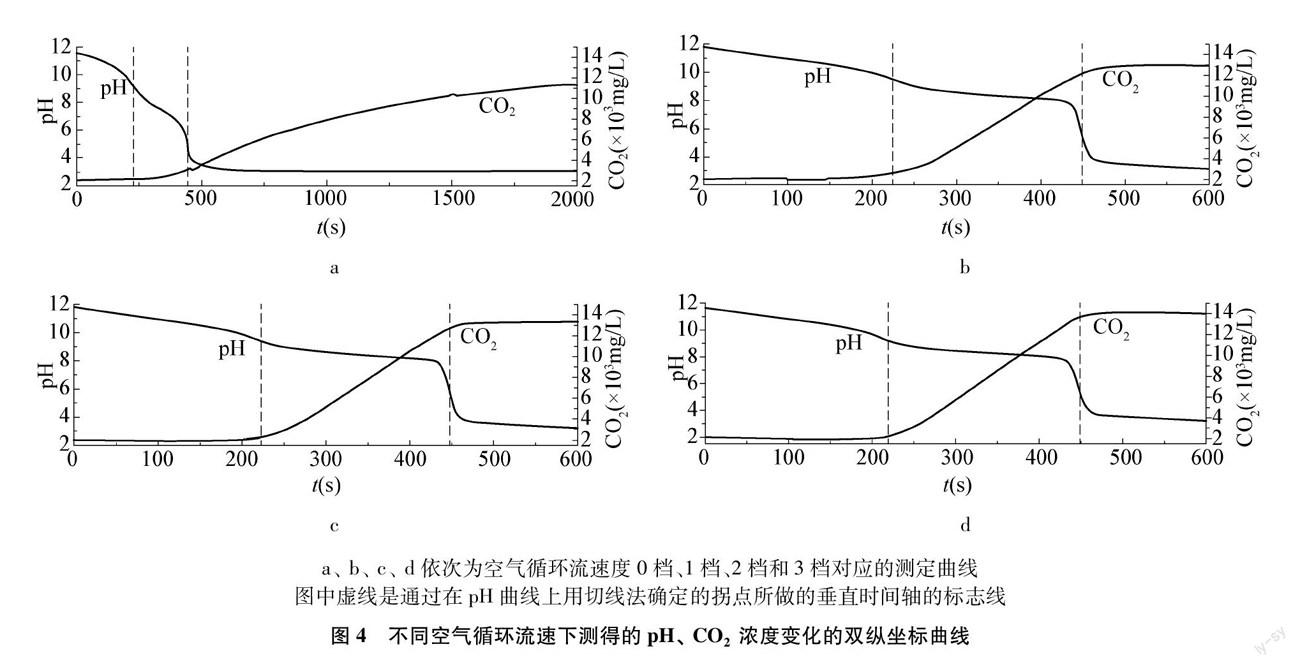
真空循环泵在最大工作电压24V下(第三档)工作,基本可消除CO2滞后现象。图4是溶液浓度值采用0.01mol/L,滴定速度采用5mL/min时不同的空气循环流速下,测得的pH、 CO2浓度双纵坐标曲线。从图4a可以看出空气不循环时,测定的CO2浓度变化远远滞后于化学反应;图4b、 4c、 4d显示,随空气循环流速增大,CO2滞后程度不断减小,因此确定真空循环泵在最大工作电压24V下(第三档)工作较为适宜。
6.3 滴定速度对pH、 CO2浓度双纵坐标曲线形状的影响
在其他条件较优的条件下,滴定速度为5mL/min比较适宜。图5是溶液浓度采用0.01mol/L,空气循环流速为第三档时滴定速度分别为5mL/min、7.5mL/min、 10mL/min和15mL/min测得的pH、 CO2浓度变化的双纵坐标曲线,依次对应的是图5a、 5b、 5c、 5d。从图中可以看出随滴定速度的增加,CO2滞后现象越严重,原因是在第一拐点后随着滴定速度的增加,单位时间内产生的CO2总量增加,CO2不能及时扩散到传感器造成的。但若滴定速度太小,实验时间又会拖得太长,综合考虑后确定滴定速度为5mL/min。
表1是对图5a、 5b、 5c、 5d中pH变化曲线采用切线法确定的化学计量点计算的V1和V2值,表中数据表明V1基本与V2相同。
根据上述实验结果确定较优实验条件为:溶液浓度宜采用0.01mol/L、空气循环流速为第三档、滴定速度为5mL/min。图6是在较优条件下获得的盐酸与碳酸钠反应的pH、 CO2浓度变化的双纵坐标曲线,与图2的理想曲线基本一致。为便于分析对比,还在较优条件下测定了盐酸与碳酸氢钠反应的pH、 CO2浓度变化的双坐标曲线如图7所示。比较图6和图7就能解释碳酸钠、碳酸氢钠分别与酸反应时,宏观上为什么NaHCO3与酸反应比Na2CO3与酸反应更快更剧烈。
7 结语
在利用数字化实验探索某些知识可视化实验时,要充分考虑实验装置结构、实验条件等因素对获得的图像
的直观性影响,通过对实验装置结构和实验条件的优化,让知识点的特征和规律在图像中充分呈现,
展示和发挥学生的形象思维的作用,有助于学生更好地理解抽象概念及理论,提高教学效果。
尽管本次改进的实验装置在较优条件下基本上能得到与理想曲线一致的pH、 CO2浓度变化的双坐标曲线,但毕竟溶液浓度(0.01mol/L)太小,致使盐酸与碳酸钠反应的pH曲线第一突跃不太明显,若要增大浓度,有必要从三颈烧瓶的体积和形状上作进一步的改进,后续相关工作将另文报道。
致谢:感谢江苏省徐州市第二中学孟彦老师对本论文研究过程中实验装置应用方面的支持。
参考文献:
[1] 陈屹, 吴俊明. 化学的形象思维训练及能力培养[J]. 化学教学, 2021, (3): 8~12.
[2] 江家发. 化学教学论[M]. 芜湖: 安徽师范大学出版社, 2014: 147~150.
[3] [4] 伍强, 方瑞光. 碳酸钠和碳酸氢钠与稀盐酸反应实验的创新设计[J]. 化学教学, 2016, (8): 63~65.
[5] 符吉霞, 丁伟. 碳酸钠和碳酸氢钠与稀盐酸反应的创新实验设计及教学应用[J]. 教育与装备研究, 2020, (2): 28~32.
[6] 王彥军, 施彩娟. 基于化学学科素养培育的创新实验研究[J]. 新课程导学, 2019, (25): 25~26, 28.
[7] 张磊, 王璇, 孙美华. 基于传感器检测探究盐酸与碳酸钠溶液的反应[J]. 化学教学. 2021, (6): 74~77.
[8] 张磊, 王璇, 董金水. 碳酸钠溶液与盐酸反应原理探究的装置改进[J]. 化学教学, 2022, (1): 64~68.
[9] 徐环. 电解质溶液中CO2的盐效应和沉积物-海水界面CO2扩散通量的研究[D]. 青岛: 中国海洋大学硕士学位论文, 2003: 31~45.

