1株跨种裂解李氏杆菌噬菌体的分离鉴定
李天昊,赵学慧,宋 晨,委慧玲,齐玉梅,田常青,祁国军,史文静,苟惠天,薛慧文
(甘肃农业大学动物医学院,兰州 730070)
李氏杆菌()可污染奶制品、肉制品、水产品以及即食食品等,是重要的食源性致病菌之一。目前常见的李氏杆菌共有7种,其中,产单核细胞李氏杆菌(,)是唯一能引起人类疾病的。当摄入被产单核细胞李氏杆菌污染的食品后,孕妇、婴幼儿及老人等免疫低下人群极易罹患李氏杆菌病,其致死率高达23.6%。由于缺乏完善的监测系统,产单核细胞李氏杆菌的低温生长等特性,李氏杆菌病仍作为世界四大食源性疾病,给人畜带来严重危害。
由于过度使用抗生素导致细菌耐药性增加和超级细菌的出现,有望将噬菌体视为可能的抗生素补充或替代品。噬菌体在治疗细菌性感染方面,较抗生素其优势:严格的宿主特异性、增殖速度快、研发时间短、成本低、安全无污染等。基于以上特点,虽然国内外已有将噬菌体用于疾病治疗及食品生产加工方面的报道,但噬菌体的应用也存在一些缺陷。由于噬菌体的高度特异性,单一的噬菌体或给药途径的治疗方式,效果并不十分明显。根据目前对其他噬菌体的研究发现,噬菌体和抗生素联用取得的效果比单一噬菌体或抗微生物药物给药所取得的治疗效果更为显著。
本试验主要利用实验室保存的产单核细胞李氏杆菌为宿主菌,使用双层琼脂平板法从屠宰污水样品中分离出噬菌体,通过对其形态学、生物学、基因组学等方面进行鉴定。旨在评价分离到的噬菌体在预防和治疗产单核细胞李氏杆菌病过程中的效果以及应用价值,为实验室后续建立产单核细胞李氏杆菌噬菌体库和基于产单核细胞李氏杆菌噬菌体的应用提供基础。
1 材料与方法
1.1 材料
1.1.1 样本来源 分别从甘肃省定西市、武威市某屠宰场,采集污水样品,4 ℃保存。
1.1.2 菌株来源 甘肃农业大学动物医学院公共卫生实验室保存的产单核细胞李氏杆菌、威尔斯李氏杆菌和英诺克李氏杆菌。
1.2 分离和纯化
离心并过滤后的样品进行共孵育,37 ℃,震荡培养24 h,分离时采用双层琼脂平板法,琼脂比例为上层1.2%,下层0.5%。挑取单个噬菌斑,进行双琼脂平板培养,重复5~6次,得到单一噬菌体。
1.3 浓缩和超离
噬菌体裂解液与宿主菌各100 μL混合,37 ℃,共孵育15 min后,加入100 mL TSB-YE培养基中,37 ℃,220 r·min培养12 h,利用PEG8000沉淀法进行沉淀。对噬菌体浓缩液进行氯化铯密度梯度离心,进一步提高效价以及纯化噬菌体颗粒(噬菌斑的解离条件为4 ℃过夜解离,浓缩中加入PEG8000后冰浴4 h)。
1.4 效价的测定
噬菌体浓缩液进行10倍连续梯度稀释。选取合适的梯度进行培养、计数,重复3次,取平均值。噬菌体效价(滴度)的计算方法:
噬菌体效价(PFU·mL)=密度适当平板上的噬菌斑数×稀释倍数×10。
1.5 电镜观察
取5 μL超速离心后的噬菌体样品滴加到300目铜网上吸附10 min。滤纸吸干噬菌体溶液,滴加5 μL的1 %磷钨酸溶液复染2 min后,吸除染液。室温晾干后,电镜观察。
1.6 生长特性鉴定
1.6.1 宿主谱的测定 利用不同菌株与噬菌体LP8进行混合孵育后,利用双层琼脂平板法计算噬菌体效价(PFU),计算宿主菌与受试菌电镀效率(EOP),计算公式为EOP=受试菌平均PFU/宿主菌平均PFU。
1.6.2 温度 设定25、35、45、55、65、75 ℃不同的温度梯度,将噬菌体裂解液置于其中孵育30 min后进行培养,根据平板计数确定该噬菌体的最适温度和失活温度。
1.6.3 pH 将噬菌体液加入pH为2、4、6、7、8、10、12的SM缓冲液中,37 ℃孵育1 h,通过培养来确定该噬菌体的最适pH。
1.6.4 有机溶剂 在噬菌体液(1×10PFU·mL)中等体积加入异戊醇、丙三醇、甲醇、乙醇、氯仿和硫酸镁缓冲液(SM缓冲液)。37 ℃作用30 min后,测定效价。
1.6.5 一步生长曲线测定 通过对噬菌体-宿主菌共培养液,不同时间点(10、20、30、40、50、60、70、80、90、100、110、120 min)取混合物进行培养,测定噬菌体的效价,绘制一步生长曲线,确定噬菌体的潜伏期等。
1.6.6 最佳感染复数(MOI)测定 对细菌和噬菌体进行定量,设置不同的感染比例(0.001、0.01、0.1、1、10、100)进行共孵育,培养后计算出不同感染复数下的噬菌体效价(见“1.4”),试验重复 3 次,并确定噬菌体的 MOI。
1.7 全基因组测序
利用Tris法对噬菌体超离液中的噬菌体颗粒进行基因组提取。在所提取的基因组中加入DNase Ⅰ、RNase Ⅰ和绿豆核酸酶,对基因组进行酶切、电泳,鉴定基因组类型。将成功提取的噬菌体基因组送至广东惠通生物科技有限公司,采用Illumina测序技术完成噬菌体基因组扫描测序,构建了Illumina PE文库,对获得的测序数据进行质控后利用生物信息学分析手段完成噬菌体的全基因组组装。利用基因组绘图软件Snap Gene绘制基因组图,对其相应基因进行预测分析。
2 结 果
2.1 产单核细胞李氏杆菌噬菌体的分离
利用本实验室保存的产单核细胞李氏杆菌作为宿主菌,对采集的所有污水样品利用双琼脂平板法进行分离,分离出若干株噬菌体,选取一株性状优良、传代稳定的噬菌体进行后续试验,并命名为LP8,宿主菌编号为ATCC19111(1/2a),平板上可以观察到明显的噬菌斑,噬菌斑形状规整,边缘整齐,颜色透亮,直径2 mm左右,纯化传代稳定,无晕环(图1)。
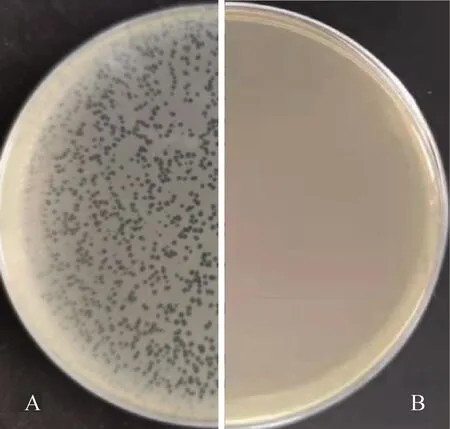
A.LP8分离纯化平板;B.对照组。平板直径为90 mm
2.2 噬菌体超离
利用氯化铯密度梯度离心法对LP8噬菌体浓缩液进行超离,在密度为1.50~1.70 g·mL的氯化铯溶液梯度之间具有噬菌体层,吸取噬菌体超离液,通过效价核定,效价为4.4×10PFU·mL。
2.3 噬菌体电镜观察
利用透射电镜对LP8样品进行观察,发现LP8为肌尾科噬菌体,具有标准的20面体的头部,还有一个由中空的针状结构和鞘组成的尾部,以及尾针组成的基部,噬菌体的头部直径约为80 nm;尾部长度约为120 nm(图2)。
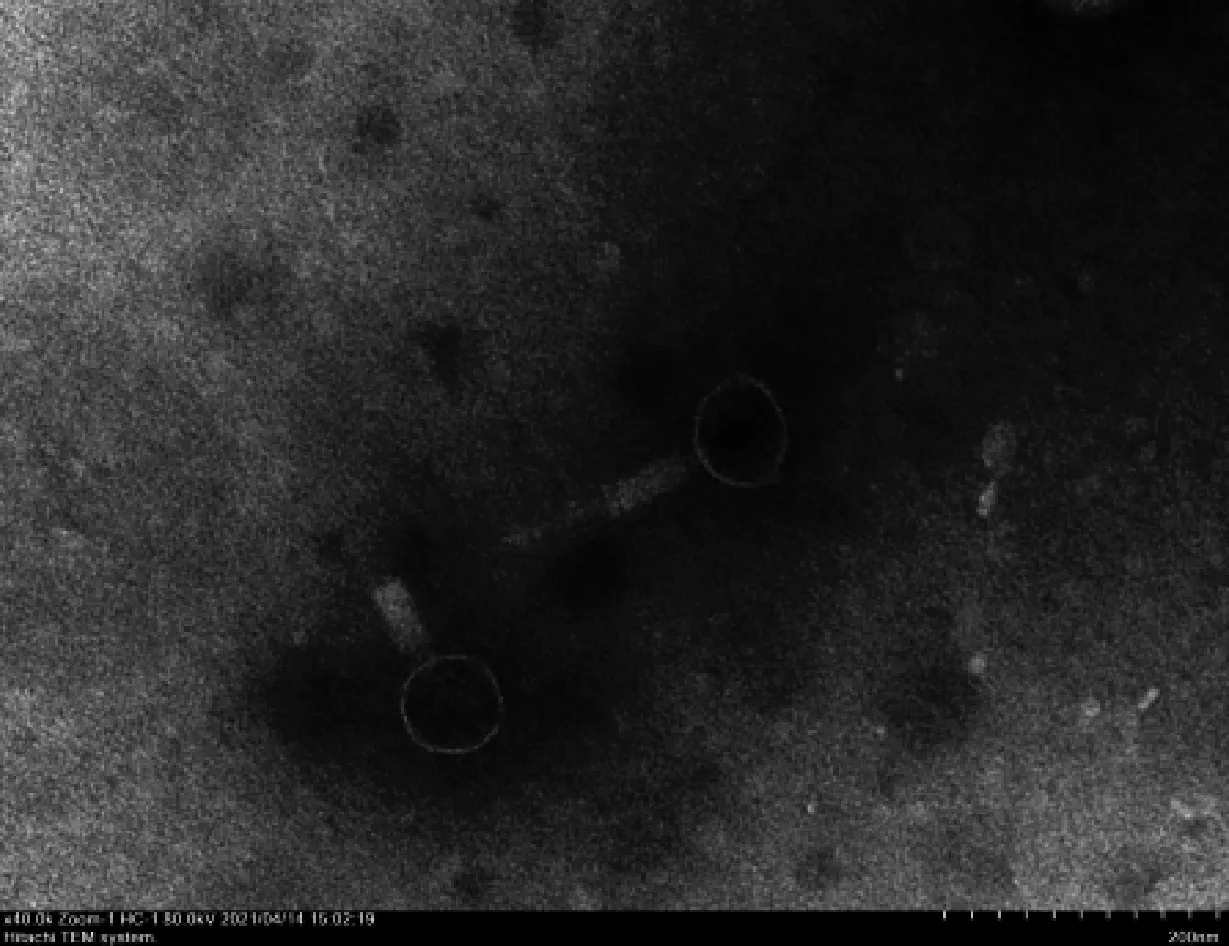
白色箭头表示噬菌体,比例尺为200 nm
2.4 LP8噬菌体效价的测定
对LP8噬菌体的裂解液、浓缩液、超离液进行效价测定,结果分别为1.76×10、2.67×10、4.4×10PFU·mL。
2.5 LP8噬菌体宿主谱鉴定
利用实验室所保存的产单核细胞李氏杆菌、威尔斯李氏杆菌和英诺克李氏杆菌对LP8噬菌体进行宿主谱鉴定,结果显示LP8噬菌体对18株LM都具有裂解性,对5株威尔斯李氏杆菌(C10、9-2、4-40、C59、4-43)具有裂解性,对22株英诺克李氏杆菌均无裂解性(表1)。
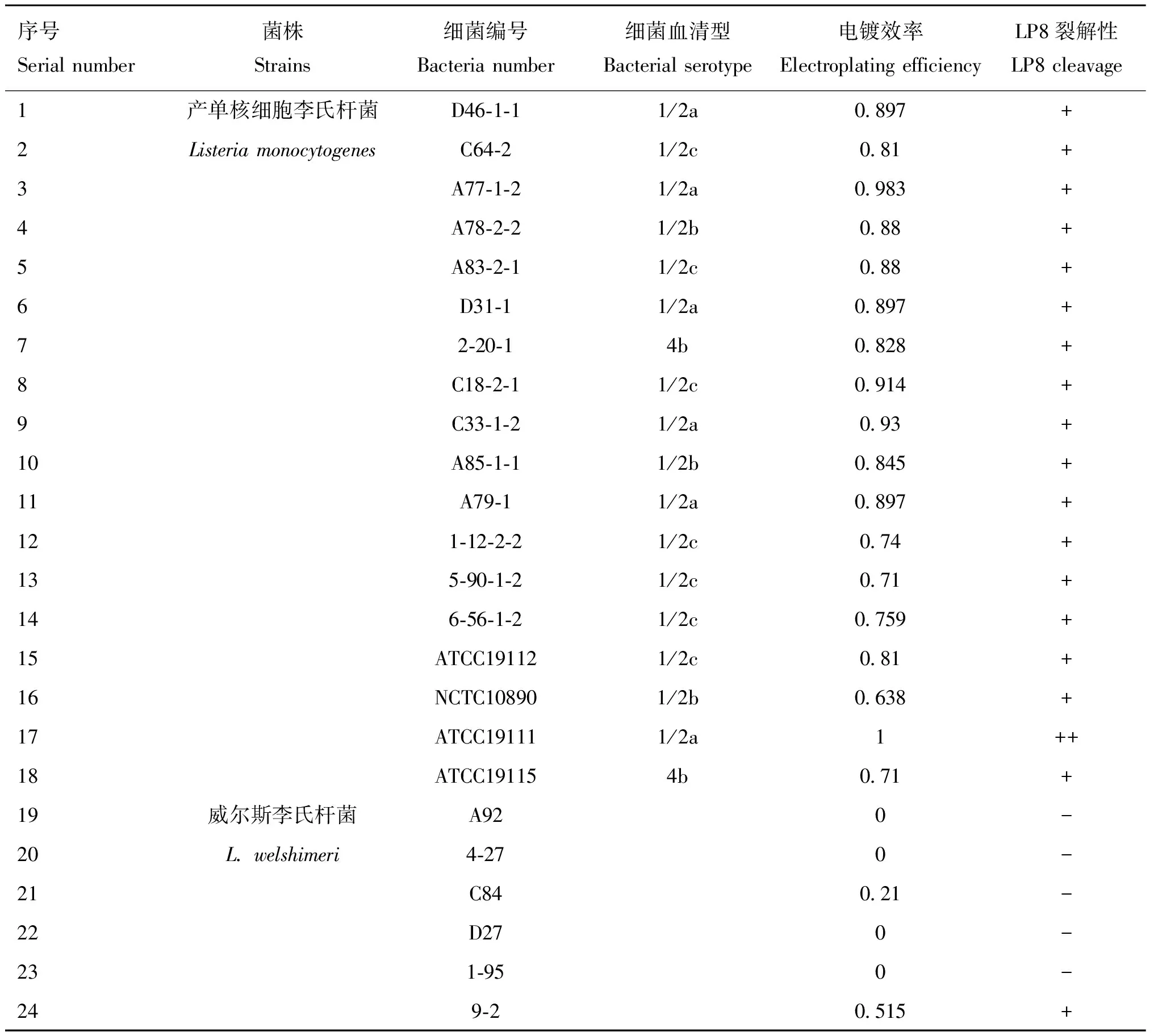
表1 LP8噬菌体宿主谱
2.6 LP8噬菌体生长特性
对LP8设置不同的感染比例,测定出LP8的MOI为1(图3A);设置25、35、45、55、65、75 ℃温度梯度,确定LP8的最适温度为45 ℃(图3B);设置pH为2、4、6、7、8、10、12梯度,确定LP8的最适pH为7(图3C);采用的6种有机溶剂中,氯仿和异戊醇对LP8影响最大,可造成LP8全部失活,丙三醇和SM空白对照组没有影响,甲醇和乙醇会导致噬菌体部分失活(图3D);绘制一步生长曲线,确定LP8潜伏期为23 min,对数期为23~80 min,80 min以后达到平台期,噬菌体效价最大可达到3.4×10PFU·mL(图3E)。

A.最佳感染复数;B.温度影响;C.pH影响;D.有机溶剂影响;E.一步生长曲线
2.7 LP8基因组酶切鉴定
电泳条带显示,噬菌体LP8基因组在1、2号DNA酶泳道未出现条带,在3、4号RNA泳道和5、6号绿豆核酸酶泳道都出现了条带,根据条带结果得出噬菌体基因组为双链DNA(图4)。
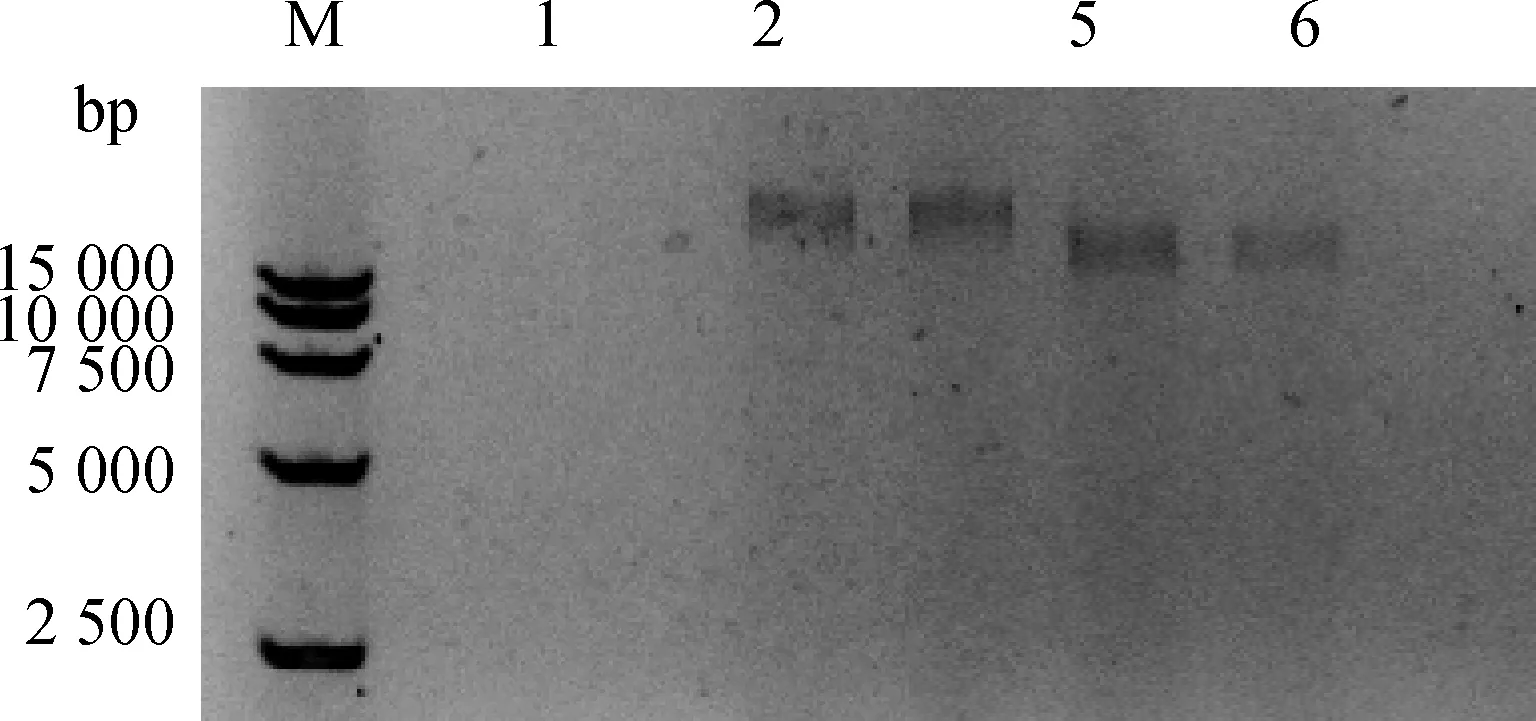
M.15000 DNA相对分子质量标准;1、2.DNase I;3、4.RNase I;5、6.绿豆核酸酶
2.8 LP8基因组测序
经测序,噬菌体LP8的基因组为87 038 bp,共有120个编码基因,编码基因的累加长度为76 326 bp、编码基因的平均长度为636 bp、编码区域长度占基因组的比例为87.69%。通过SnapGene软件对全基因组进行绘图,分析其基因的大小和分布情况。通过COG、KEGG、GO对LP8的基因进行注释,发现有6个编码基因参与原噬菌体合成;有20个编码基因参与噬菌体有关的生物过程;11个编码基因参与分子功能,如结合或催化;8个编码基因参与噬菌体的合成,具体生物学通路最多的为嘌呤代谢和嘧啶代谢(图5)。
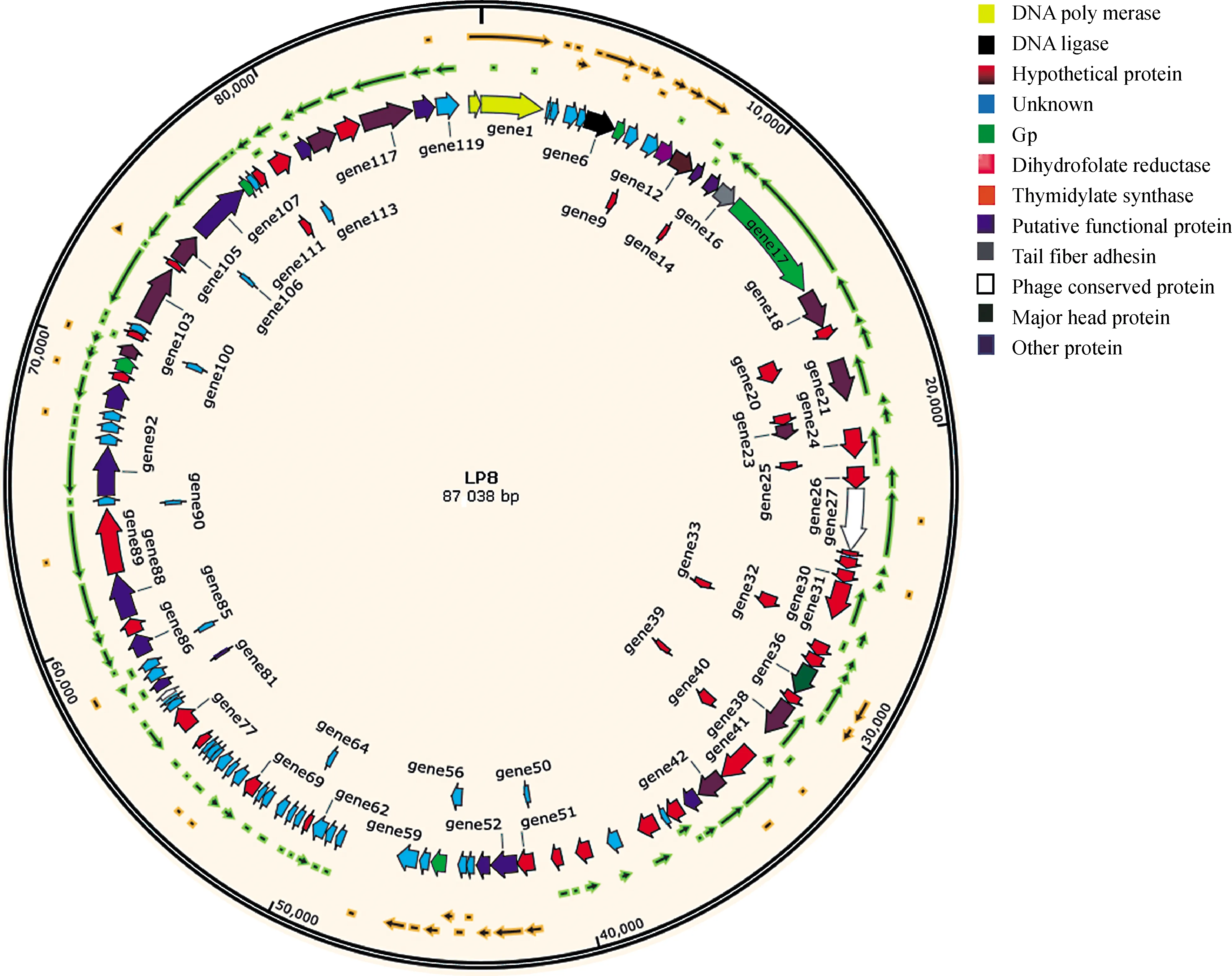
图5 LP8噬菌体基因组
3 讨 论
目前,国内从事产单核细胞李氏杆菌噬菌体的研究,多见于产单核细胞李氏杆菌噬菌体裂解酶、噬菌体蛋白对于李氏杆菌的快速检测、产单核细胞李氏杆菌溶源性噬菌体的诱导与鉴定等。对于产单核细胞李氏杆菌裂解性噬菌体的分离鉴定及临床应用相关研究较少,而国外此方面研究相对较多,美国、加拿大和瑞士已使用LISTEXP100用以防治产单核细胞李氏杆菌所引起的食品安全问题;LP8与国外LISTEXP100产品相比,具有作用时间短、作用温度范围广、保存时效性长等特点。LP8在25~45 ℃具有很高的活性,而且在55 ℃时,LP8噬菌体的效价仍能保持在2.1×10PFU·mL。
Song等测定3种LM噬菌体LP020、LP027、LP094的一步生长曲线结果显示,这3种LM噬菌体的潜伏期都在45~60 min,LP8的潜伏期在23 min左右,80 min便达到平台期,平台期最高效价4种噬菌体都在1×10PFU·mL以上,具有相同效果,但LP8作用速度更快。Lee等从鸡粪样品中分离到的两种LM噬菌体LMP1和LMP7对ATCC7644、ATCC15313、ATCC19114、ATCC19115四种LM具有裂解性。LP8除了对18株产单核细胞李氏杆菌具有裂解性外,对5株威尔斯李氏杆菌(9-2、4-40、C10、C59、4-43)也具有裂解性,说明LP8具有跨种裂解性,且有较高的感染复数。综上,LP8具有更好的生物制剂开发前景。
本试验分离得到的噬菌体中,有30%的噬菌体会在纯化阶段不能稳定传代而丢失,表明丢失的噬菌体本身裂解能力并不强。司樨东提出,噬菌体在感染宿主菌的过程中,部分基因会整合到宿主菌的基因组中,在一定条件下并不会立即表达,裂解性噬菌体基因有成为溶原性噬菌体基因的可能性,也会影响噬菌体的表达。在本试验过程中,发现琼脂的浓度较低时,噬菌斑会变大,颜色更透亮。究其原因,下层琼脂一般为营养琼脂,较硬的质地为上层琼脂提供支持和营养作用,上层琼脂质地较软,噬菌体受到本身构造限制,其穿行能力较弱,如果仅限于培养细菌涂布后干燥的平板表面条件,噬菌体对周围的细菌没有侵袭能力,很小的作用范围并不支持形成肉眼可见的噬菌斑,而且噬菌斑能被肉眼观察,是由于在噬菌斑内没有细菌生长,与周围生长有细菌的琼脂形成色差导致。我们在普通光学显微镜下观察噬菌斑,发现噬菌斑相较于周围琼脂较低,形成一个略浅的凹陷,裂解挑斑发现噬菌斑本身具有一定厚度,与周围正常琼脂相比,厚度约减少1/5,可能是由于噬菌斑内生长的细菌被侵蚀死亡而造成的坍缩导致。
通过对LP8全基因组序列进行对比,确定本试验所分离的噬菌体为李氏杆菌新噬菌体,噬菌体基因组编码区占基因组大小的80%以上。所编码的基因中,76个基因与沙门菌噬菌体、大肠杆菌噬菌体、欧文菌噬菌体、柠檬酸杆菌噬菌体中的部分基因具有高度相似性,基因组序列单一覆盖率最大7%,累计覆盖率38.4%。基因组所编码的120个基因与噬菌体基因数据库中的基因相似性都很低,其中44个基因功能未知,以上现象说明LP8在进化过程中可能经历了复杂的基因水平转移、突变、重组等过程,也有可能是由其他噬菌体演化而来。
4 结 论
LP8相较于其他噬菌体,热稳定性更强,酸碱耐受范围更广,对有机溶剂的抵抗性更高,对LM具有强裂解性,并且可以跨种裂解李氏杆菌。因此,LP8噬菌体在未来的噬菌体生物制剂的研发过程中,具有一定的开发潜力。

