小奥德蘑属食用菌多糖提取、化学结构和生物活性研究进展
黄 敏,苗晶囡,王 勇,邱军强,李海霞
(教育部热带转化医学重点试验室,海南省热带药用植物研究开发重点试验室,海口市黎族医药重点实验室,海南医学院药学院,海南海口 570100)
食用菌在全世界广泛分布,为一类营养价值高且味道鲜美的食材而备受人们喜爱,其能够补充人体所需的各种营养物质,包括多糖、蛋白质、矿物质元素和维生素等[1]。作为食用菌物种最丰富的国家之一,我国的食药用真菌的种类达2000 种,早在公元前4000 年到公元前3000 年,就已经有采食真菌的记录。小奥德蘑属(Oudemansiella)食用菌为一种新兴食用菌,隶属于担子菌门(Basidiomycota),伞菌目(Agaricales),膨瑚菌科(Physalacriceae)[2]。通过国内外数据库(Web of Science、Elsevier、中国知网和万方数据知识服务平台)查询发现目前有关小奥德蘑属食用菌的研究报道主要集中于卵孢小奥德蘑和鳞柄小奥德蘑。小奥德蘑属食用菌因其具有鲜嫩醇香、肉质细嫩、口感鲜甜、柄脆爽口、香味浓郁、生熟皆可食、营养丰富和食用保健价值高等特点而备受人们的关注,为一种高蛋白、低脂肪、低纤维的药食两用真菌[3]。近年来小奥德蘑属食用菌为我国“南菇北扩”发展起来的重要珍稀优质木腐生食用菌[4]。研究表明,多糖为小奥德蘑属食用菌的主要活性成分之一,具有抗氧化、抗炎、抗高血压、抗肿瘤、抗菌和免疫调节等生物活性[5−6],被称为“生物反应调节剂”[7]。食用菌多糖一般易溶于水而不溶于醇、醚或丙酮等有机溶剂,根据溶解性的不同被分为水溶性多糖、水不溶性多糖、酸性多糖和碱性多糖等,不同的提取方法对食用菌多糖的提取率、理化性质、化学结构及生物活性有一定的影响[8]。
随着小奥德蘑属食用菌人工种植技术的推广,有关小奥德蘑属食用菌多糖提取、化学结构和生物活性研究报道越来越多。本文查阅了近年来有关小奥德蘑属食用菌多糖的研究文献,对有关小奥德蘑属食用菌多糖的提取方法、化学结构及生物活性做了系统梳理和综述,以期为小奥德蘑属食用菌多糖的进一步研究开发提供理论基础。
1 小奥德蘑属食用菌多糖的提取方法
截止到目前,食用菌多糖提取方法主要包括热水提取法[9]、酸碱提取法[10]、酶辅助提取法[11]、超声波辅助提取法[12]、微波辅助提取法[13]、超微粉碎技术辅助提取法[14]和超临界萃取技术辅助提取法[15]等。各类提取方法的提取原理和优缺点见表1。而目前有关小奥德蘑属食用菌多糖的提取多采用传统的热水提取法,少量文献报道酶辅助提取法[16−17]。其中热水提取法和酸碱提取法的提取原理类似,通过高温热水或者酸碱水对小奥德蘑属食用菌进行破壁处理,例如采用热水提取法对鳞柄小奥德蘑多糖进行提取时,多糖得率为8.72%~8.84%[18];酶辅助提取法、超声波辅助提取法和微波辅助提取法分别通过生物酶酶解破壁、超声波破壁和微波破壁的原理对多糖进行提取[11−13];超微粉碎技术辅助提取法主要利用各种粉碎技术,对小奥德蘑属食用菌进行研磨、冲击和剪切,得到小奥德蘑属食用菌超微粉末,然后进行食用菌多糖提取[14];超临界流体萃取技术辅助提取法的原理为利用流体在临界点附近某区域内,与小奥德蘑属食用菌多糖具有异常相平衡行为和传递性能[15]。鉴于热水提取法和酸碱提取法具有耗时长和得率低等缺点,而超微粉碎技术辅助提取法和超临界流体萃取技术辅助提取法具有设备昂贵和不宜大规模生产等缺点,后期可采取优势相对较明显的酶辅助提取法、超声波辅助提取法和微波辅助提取法对小奥德蘑属食用菌多糖进行提取。需要注意的是,研究不同提取方法获得的小奥德蘑属食用菌多糖,不仅要关注多糖的提取得率,而且还应关注这些多糖理化性质、化学结构和生物活性的差别。

表1 食用菌多糖提取方法Table 1 Extraction methods of polysaccharides from edible mushroom
2 小奥德蘑属食用菌多糖理化性质、组成以及结构分析
目前针对小奥德蘑属食用菌多糖理化性质和化学结构的研究主要集中于卵孢小奥德蘑和鳞柄小奥德蘑多糖,有关厚褶小奥德蘑的研究报道较少,结果见表2。GAO 等[19]研究表明,通过酶辅助提取法得到的卵孢小奥德蘑多糖中甘露糖:葡萄糖:半乳糖:岩藻糖的摩尔比为1.99:6.33:4.78:1.00,而酸水解法提取多糖中甘露糖:葡萄糖:半乳糖:岩藻糖的摩尔比为1.00:4.52:4.78:1.31,二者的分子量分别为35.5和13.6 kDa。此外GAO 等[20−21]还对比研究了两种富硒培养卵孢小奥德蘑菌丝体和普通卵孢小奥德蘑菌丝体多糖单糖组成,其中两种富硒培养的菌丝体多糖主要由核糖、甘露糖、半乳糖和葡萄糖组成,其摩尔比分别为2.50:3.00:25.20:25.30 和7.00:16.00:15.00:21.00,而正常培养菌丝体多糖主要含有甘露糖、半乳糖和葡萄糖,其摩尔比分别为2.70:15.80:9.20 和3.00:1.50:10.00。另外两种多糖的分子量分别为31.2 和56.9 kDa。甲基化分析和核磁共振结果表明卵孢小奥德蘑菌多糖主要由Manp-(1→、→3)-Fucp-( 1→、 →2) -Manp-( 1→、 →4) -Glcp-( 1→、→6)-Galp-(1→、→2,6)-Manp-(1→、→6)-β-DGlcp-(1→和→6)-α-D-Galp-(1→等糖残基组成,且含有α和β构型的吡喃糖。
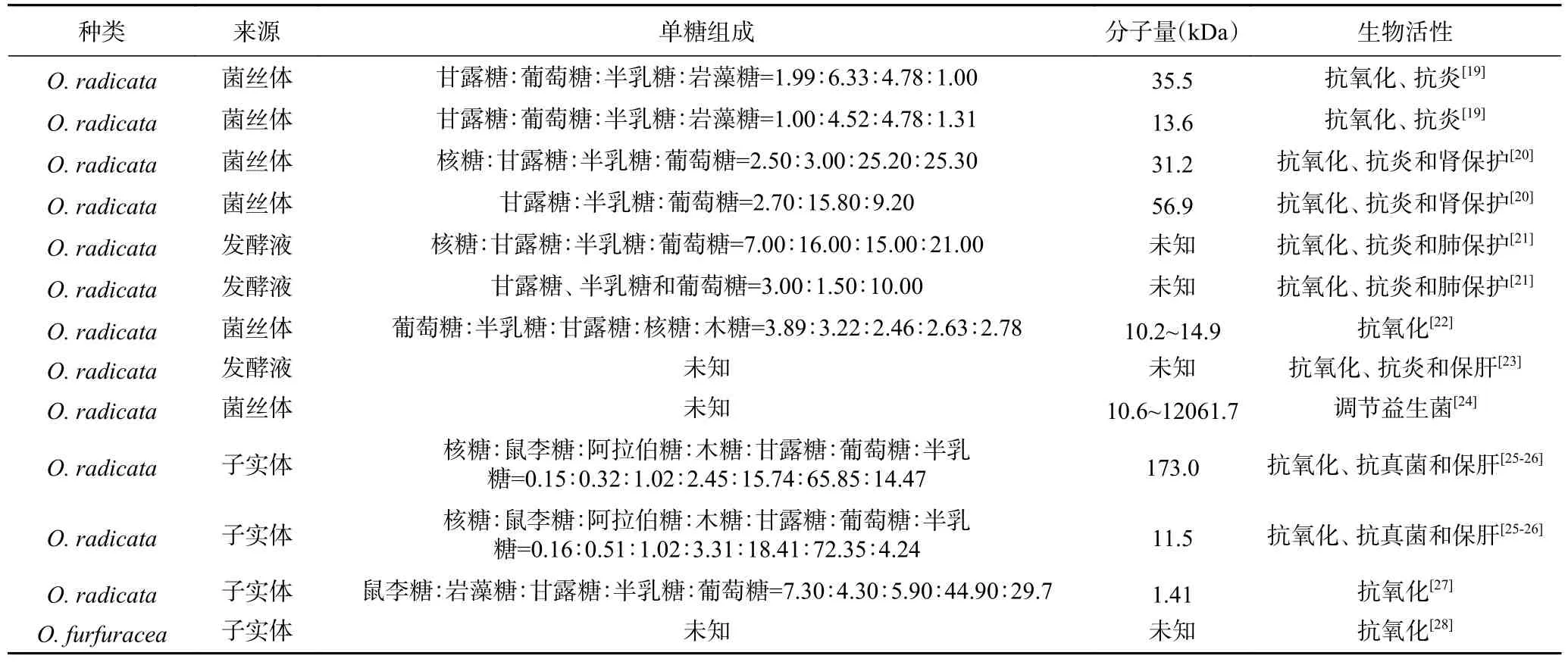
表2 小奥德蘑属食用菌多糖的来源、提取方法、理化性质和生物活性Table 2 The source, extraction method, physicochemical properties and biological activities ofOudemansiellamushroom polysaccharides
3 小奥德蘑属食用菌多糖的生物活性
目前普遍认为食用菌多糖在发挥多种生物活性的同时,具有绿色安全无毒的优势。这些食用菌多糖主要具有免疫调节、抗肿瘤、抗氧化、抗菌、镇痛、抗炎和降血糖等生物活性作用[29],有关小奥德蘑属食用菌多糖生物活性总结见表2。
3.1 抗氧化活性
目前有关小奥德蘑属食用菌生物活性的报道主要集中为抗氧化活性。王倩等[30]比较研究了小奥德蘑、桑黄、猴头菇和韩芝在内的四种食用菌发酵菌质醇提液抗氧化活性,结果表明四种食用菌发酵菌质醇提液均具有显著的清除DPPH 自由基和清除羟自由基活性。LIU 等[31]比较研究了四种烹饪方法(烹煮、清蒸、煎炸和微波加热)对卵孢小奥德蘑消化液抗氧化活性(DPPH 清除活性、还原力和金属螯合能力)的影响,结果表明四种烹饪方法的综合抗氧化活性大小顺序依次为:煎炸>清蒸>微波加热>烹煮,这是因为煎炸烹饪后的卵孢小奥德蘑还原性糖含量最高。史钏等[8]研究表明厚褶小奥德蘑菌丝体水提液的还原力和清除羟自由基活性显著高于醇提液和发酵液,同时其清除羟自由基活性为VC的1.8 倍。王晶等[28]采用正交实验法对鳞柄小奥德蘑多糖提取工艺进行了优化,结果表明优化提取工艺后的多糖得率最高为8.84%,且具有较强的羟自由基清除力和还原力,而对超氧阴离子自由基的清除力较弱。WANG 等[32]从卵孢小奥德蘑中分离得到了分子量分别为13.9、14.9 和10.2 kDa 的三种均一多糖,三种多糖的体外亚铁离子螯合活性、羟自由基清除活性、DPPH 和ABTS 自由基清除活性强弱与其分子量之间没有显著的相关性,推测三种多糖的抗氧化活性可能和其单糖组成具有密切联系,其构效关系尚不明确。此外,GAO 等[27]对卵孢小奥德蘑硒化多糖体内抗氧化活性进行了研究,发现酶解硒化多糖和酸水解硒化多糖能够显著提高脂多糖诱导氧化损伤模型小鼠脏器超氧化物歧化酶(SOD)、谷胱甘肽过氧化物酶(GSHPx)和过氧化氢(CAT)等抗氧化酶系活力,并降低小鼠机体过氧化脂质(LPO)和丙二醛(MDA)含量。LIU 等[33]制备了两种卵孢小奥德蘑多糖硒纳米粒,体外抗氧化活性结果表明,相比于普通硒纳米粒,卵孢小奥德蘑多糖硒纳米粒具有更强的清除自由基(DPPH 自由基、ABTS 自由基和超氧自由基)活性。综上所述,小奥德蘑属食用菌多糖在体外和体内实验中均具有较强的抗氧化活性,在功能性食品或保健品领域具有一定的开发价值。
3.2 抗炎活性
GAO 等[19−21]对卵孢小奥德蘑多糖和硒化多糖的抗炎活性进行研究,结果表明两种多糖均能抑制脂多糖诱导昆明小鼠所致的肺损伤,其主要作用机制与下调肿瘤坏死因子-α(TNF-α)、白介素-1β(IL-1β)和白介素-6(IL-6)水平有关。LIU 等[23−25]对卵孢小奥德蘑多糖及其硒化多糖的保肝活性进行研究,结果表明两种多糖均能够显著降低四氯化碳诱导昆明小鼠肝损伤模型血清中丙氨酸转移酶和天冬氨酸转移酶的活性,并抑制肝脏中MDA 的产生,同时提高肝脏中超氧化物歧化酶和谷胱甘肽过氧化物酶的活性。此外研究表明卵孢小奥德蘑硒化多糖能显著提高酒精性肝损伤模型小鼠血清超敏C 反应蛋白、补体3和碱性磷酸酶的活性[23,25,32]。GAO 等[20]对卵孢小奥德蘑硒化多糖的抗炎活性和肾保护活性进行研究,结果表明该硒化多糖发挥保护肾脏活性与其降低血清中的肌酐(CRE)、尿素氮(BUN)和尿酸(UA)含量,提高肾脏SOD、GSH-Px、CAT 和T-AOC 等抗氧化酶系活力,并降低过氧化物酶(MPO)的活力密切相关。这些结果表明小奥德蘑属食用菌多糖能够通过其抗炎和抗氧化活性发挥保护机体脏器的作用。
3.3 免疫调节活性
食用菌多糖能够通过作用于淋巴细胞、巨噬细胞和网状内皮系统发挥调节机体免疫功能的活性,从而增强机体免疫力。王晶等[34]研究了鳞柄小奥德蘑多糖对ICR 小鼠巨噬细胞的免疫调节作用,结果表明鳞柄小奥德蘑多糖能够显著提高体外培养和小鼠体腹腔内巨噬细胞的吞噬能力和一氧化氮(NO)的合成量,同时增加体外培养的小鼠巨噬细胞中TNF-α、IL-1、IL-6 和IL-12 的水平,提示鳞柄小奥德蘑多糖可能通过提高巨噬细胞对NO 和免疫相关信号因子的分泌,增强巨噬细胞吞噬能力,进而发挥调节小鼠机体免疫功能的活性。张绍楠等[35]研究了鳞柄小奥德蘑多糖体外对巨噬细胞NR8383 的作用,通过建立巨噬细胞和结肠癌细胞体外共培养体系,发现鳞柄小奥德蘑多糖对结肠癌细胞的生长无显著影响,但其能提高巨噬细胞对诱导性一氧化氮合成酶的合成、NO 和TNF-α的分泌水平,从而减少共培养体系中结肠癌细胞的数量,表明其可以增强巨噬细胞杀伤肿瘤细胞的能力。上述研究表明小奥德蘑属食用菌多糖对肿瘤细胞无直接杀伤活性,其发挥抗肿瘤活性主要与其调节机体免疫功能有关。
3.4 抗菌活性
研究表明,鳞柄小奥德蘑发酵物对植物病原菌具有较高的抑制活性,尤其是对苹果腐烂病菌、烟草赤星病菌、苹果炭疽病菌、玉米小斑病菌和番茄灰霉病菌的抑制率达80%以上[36]。郭艳芳等[37]研究了卵孢小奥德蘑乙醇提取物的抗人参立枯病菌活性,结果表明其浓度为0.50 g/mL 时的抑菌率达52.90%。此外,LIU 等[26]对卵孢小奥德蘑水溶性多糖体外抗指状青霉活性进行了研究,发现其最小抑菌浓度(MIC)达0.25 g/L,同时其最低抗菌浓度达1.00 g/L。目前市面上常见的抗菌剂主要为具有一定毒副作用的化学抗菌剂,而食用菌多糖作为一类纯天然、绿色无毒和价格低廉的抗菌剂,具有潜在的开发应用价值[38]。近年来有关食用菌多糖抗菌活性研究报道较为广泛,包括灵芝、香菇、金针菇、北芪菇、黑木耳和毛木耳等等[39−42],其对金黄色葡萄球菌、大肠杆菌、枯草芽孢杆菌、志贺氏菌和铜绿假单胞菌等具有显著的抗菌活性,但是这些多糖的抗菌机理仍待进一步研究阐释[43]。
3.5 其他活性
除上述活性之外,小奥德蘑属食用菌还具有调节机体肠道菌群的作用,LIU 等[24]研究了卵孢小奥德蘑多糖体外对肠道菌群组成的影响,结果表明卵孢小奥德蘑多糖与肠道菌群进行共发酵后,其化学结构没有发生变化,发酵液中不含游离单糖;经发酵后多糖分子量减小,发酵液中短链脂肪酸含量增加,包括乙酸、丙酸和正丁酸;此外卵孢小奥德蘑多糖能够显著增加拟杆菌和副拟杆菌属菌群丰度。WANG 等[44]研究了卵孢小奥德蘑多糖对盐酸林可霉素诱导肠道菌群失调昆明小鼠模型肠道菌群的影响,结果表明卵孢小奥德蘑多糖能够恢复抗生素所致小鼠肠道菌群紊乱状态,主要通过增加益生菌(双歧杆菌、乳杆菌)的数量,减少致病菌(脱硫弧菌)的数量,且以中剂量干预组效果最好。
4 结论与展望
食用菌在我国具有悠久的药用和食用传统,其发挥各类生物活性均与其所含多糖密切相关[45]。近十年来,研究人员已经对香菇、灵芝、黑木耳、猴头菇、银耳和鸡枞菌等药食两用真菌多糖提取方法、分离纯化、结构鉴定和构效关系进行了大量研究,而小奥德蘑属食用菌作为一种近年来新兴的珍贵药食两用菌,具有很好的开发和利用前景。国内关于小奥德蘑属食用菌多糖提取方法、生物活性、多糖结构的研究还比较少[46],且主要集中于卵孢小奥德蘑和鳞柄小奥德蘑,而有关厚褶小奥德蘑的研究报道更是少之又少。鉴于此,在今后进行小奥德蘑属食用菌研究过程中,应开展各类提取方法对不同种类小奥德蘑属食用菌多糖成分进行优化提取,特别是鳞柄小奥德蘑、厚褶小奥德蘑以及其他种类小奥德蘑,并对其发挥各类生物活性的多糖化学结构、单糖组成和空间构型进行详细研究,从而阐明其发挥各类生物活性构效关系,为小奥德蘑属食用菌的开发奠定扎实的基础。

