红树根际解磷真菌筛选及其对桐花树生长的影响
林钰栅,刘景春,卢豪良,丁友芳,严重玲*
(1.滨海湿地生态系统教育部重点实验室(厦门大学),福建 厦门 361102;2.厦门市园林植物园,福建 厦门 361003)
土壤中的磷含量是影响湿地初级生产力、物种结构和功能的重要因素,与红树林生态系统的群落结构和生产力息息相关。然而,红树林生境普遍存在低氧化还原电位、周期性淹水、高有机质含量等特性,大部分磷酸盐被土壤间隙水中的Ca、Fe、Al等离子固定或被有机物质吸附,土壤中具生物有效性的磷酸盐含量常处于较低水平,导致多地区红树植物生长受到限制。
潜在的磷酸盐危机(Potential phosphate crisis)已成为21 世纪全球可持续发展的重要挑战之一。土壤中的微生物在磷循环和生态平衡中的重要性日益凸显,尤其是其中的解磷微生物(Phosphate-solubilizing microorganisms,PSMs)。解磷微生物具有溶解无机磷或矿化有机磷的能力,从而可以将难溶性磷酸盐转化为植物或微生物可直接吸收并利用的形态,利用微生物解磷也被认为是提高土壤磷利用率最经济和友好的方法。
近年来,解磷微生物在红树林生态系统中的作用受到国内外学者的广泛关注,但研究主要集中于解磷细菌的生物多样性、解磷特性及其对植物的促生效果。TEYMOURI 等从潮间带红树根部筛选出了芽孢杆菌属(sp.)、假单胞菌属(sp.)和不动杆菌属(sp.)。骆韵涵等从罗源湾红树根际土壤中筛选出了洋葱伯克霍尔德菌()和短小芽孢杆菌(),并研究了菌株的解磷特性和动态解磷过程。然而,与解磷细菌相比,解磷真菌可分泌更多有助于自由磷酸根离子释放的低分子量有机酸,解磷真菌的解磷能力通常是解磷细菌的几倍甚至更高的水平,同时,真菌的遗传性状比细菌的遗传性状更稳定。因此,本研究重点关注红树林生态系统中的解磷真菌。
为应对红树林湿地以每年0.16%~0.39%的速度持续退化的困境,深入研究红树林解磷真菌的解磷特征,挖掘解磷真菌与红树植物之间的互利合作关系对退化加速、营养贫瘠的红树林尤其重要。红树林生境的特殊性使其可能蕴藏着不同于其他生态系统的宝贵微生物资源,加之根际效应(Rhizosphere effect)的影响,根际区域成为筛选有益功能微生物的最好来源。因此,本研究分离和筛选出红树根际土壤中的解磷真菌,分析其对该生境中多种典型难溶性磷酸盐的解磷特性,并以抗寒、耐淹的广布先锋种桐花树()作为供试植物,评估高效解磷真菌在影响桐花树幼苗生长、根系活力、营养吸收、光合作用等方面的潜在功能。
1 材料与方法
1.1 解磷真菌的分离和筛选
从福建省漳江口国家红树林自然保护区中挑选生长良好的健康红树植株,参照XIE 等的方法采集根际土壤(0~20 cm)。采用添加0.5%的Ca(PO)、AlPO或FePO的NBRIP(National Botanical Research Institute's phosphate)固体培养基来分离可溶解不同难溶性磷酸盐的解磷真菌。为抑制细菌的生长,当培养基冷却至45 ℃时加入25 mg·mL的链霉素和25 mg·mL的青霉素。稀释涂布平板后,将平板倒置于28 ℃恒温培养箱中培养7~14 d。选取有透明解磷圈的真菌菌株纯化培养后转接到新鲜PDA(Potato dextrose agar)固体培养基中,4 ℃条件下保存备用。
1.2 解磷真菌的周期性培养
为进一步定量分析初筛菌株的解磷能力,将事先在PDA 培养基中培养5 d 的菌株,用0.02%(体积分数)的吐温80 溶液调节孢子悬液至1×10CFU·mL。将1 mL 孢子悬液加入到含有0.5% Ca(PO)的100 mL NBRIP 液体培养液中,同时以等量0.02%的吐温80 溶液作为未接种对照处理。所有处理组置于(28±2)℃、160 r·min条件下培养,并分别于第1、2、3、4、5、6、7天取出3瓶培养液用于分析解磷真菌的解磷动力学过程,具体方法为:将培养液在2 000的条件下离心15 min,用事先烘干并已称取质量的Whatman No.1 滤纸进行过滤,获得的滤液过0.22 μm 滤膜后立刻测定pH 和可溶性磷酸盐含量。利用0.5 mol·L的HCl溶液去除菌丝体中残留Ca(PO)的干扰,用无菌水清洗3 次后于(70±2)℃条件下烘干约48 h 后获得菌丝体干质量。
1.3 解磷真菌对多种难溶性磷酸盐的溶解能力
为分析供试菌株对难溶性无机磷酸盐的溶解能力,将NBRIP 液体培养基中的Ca(PO)替换成5.0 g·L的AlPO或FePO。同时,参照MUDRYK的方法制备0.2 g·L的卵磷脂溶液,以分析菌株矿化难溶性有机磷的能力。所有处理均设3个重复。利用无菌的1 mol·LHCl或NaOH溶液调节培养液的pH为7.0~7.2,所有处理均在(28±2)℃和160 r·min的条件下培养,分别于第3、7、14天分析培养液pH和可溶性磷酸盐含量。
1.4 解磷真菌的鉴定
分别参照BRIC 等和SCHWYN 等的方法评估供试菌株分泌吲哚-3-乙酸(IAA)和合成铁载体的能力。综合考虑菌株的解磷能力、分泌IAA和合成铁载体的能力,最终选取高效解磷真菌PSF-FJ1开展进一步研究。
采用光学显微镜观察菌株PSF-FJ1 的形态学特征,利用ITS 序列分析方法进行分类鉴定。用灭菌牙签将在PDA 培养基上生长3 d 的菌丝体刮入无菌研钵中,加液氮研磨成细粉后,利用真菌基因组DNA 提取试剂盒提取真菌的基因组DNA。采用的通用引物为ITS1(5'-TCCGTAGGTGAACCTGCGG-3')和ITS4(5'-TCCTCCGCTTATTGATATGC-3'),由厦门精聚科技有限公司完成测序工作,测序结果在GenBank(https://www.ncbi.nlm.nih.gov)中进行Blast比对分析。
1.5 盆栽试验设计
供试土壤采自福建省九龙江红树林保护区,采用BASHAN 等的方法对盆栽用土(过2 mm 筛)进行前处理以避免土著解磷微生物的干扰。采用常规方法分析得到土壤的pH 为6.46,有效磷含量为27.76 mg·kg。将长至2 对真叶的桐花树幼苗定植到每盆3 株,参考XIE 等的方法用30 μm 孔径的尼龙网模拟根际环境,从而区分根际和非根际区域,并参照EL-TARABILY 等的方法进行解磷菌剂的接种处理。本研究设置两组处理:解磷真菌sp.PSF-FJ1 接种处理和等量无菌水不接种对照,每个处理设3 个重复。所有处理随机摆放在自然光照、湿度65%的温室中,土壤含水量保持在60%左右,培养6个月。
1.6 植物和土壤样品分析
培养结束后,选定从顶端向下数的第二片完整、成熟、完全展开的功能叶,利用LI-6400XT 便携式光合测定仪(Li-6400,Li-Cor,Lincoln,NE,美国)在晴朗天气(9:00—11:00)测定植株的净光合速率(Pn)、蒸腾速率(Tr)、气孔导度(Gs)和胞间CO浓度(Ci)。待光合参数测量结束后,采用冷冻干燥法获取植株各组分生物量。选取合适叶片分析光合色素含量;采用氯化三苯基四氮唑方法分析根系活力;利用CHNSO元素分析仪(VarioEL Cube,德国)测定根、茎、叶中氮元素的含量,各组分经HSO-HO消煮后测定全磷含量。土壤有效磷含量采用OLSEN的方法,并以荧光素二乙酸(FDA)水解活性来评估土壤中微生物的活性。将适量土壤于5 000离心30 min 后过0.45 μm微孔滤膜,用于分析可溶性糖含量。
2 结果与分析
2.1 根际土壤解磷真菌的筛选结果
根据菌株的形态学差异,从红树根际土壤中分离出11 株可在含Ca(PO)的NBRIP 培养基中产生明显解磷圈的真菌菌株,部分菌株在PDA 培养基中的菌落形态如图1所示。经14 d培养后,初筛菌株PSFFJ1、PSF-FJ2和PSF-FJ3可以使90 mm培养皿里的白色难溶物Ca(PO)全部消失,其他真菌虽亦产生明显解磷圈,但在固体培养基中的解磷能力远不及前3株真菌。

图1 部分解磷真菌在PDA培养基中的菌落形态(培养5 d)Figure 1 Colonial morphology of typical PSF strains on PDA medium(incubate 5 days)
当NBRIP 固体培养基中的难溶性磷源为AlPO时,只有菌株PSF-FJ1、PSF-FJ2和PSF-FJ3可产生透明的解磷圈,但解磷圈直径远小于其在含Ca(PO)的NBRIP 培养基中的直径。当磷源为FePO时,所有培养皿上均未发现透明解磷圈。
2.2 培养液pH、可溶性磷酸盐和菌丝体干质量随时间的变化
与未接种处理相比,供试菌株PSF-FJ1、PSF-FJ2和PSF-FJ3的加入明显改变了培养液pH 和可溶性磷酸盐含量(图2),说明菌株生长良好且可有效溶解难溶性Ca(PO)。菌株PSF-FJ1 对Ca(PO)的溶解能力最强,经过7 d 培养后磷酸盐含量高达(773.36±1.85)mg·L。
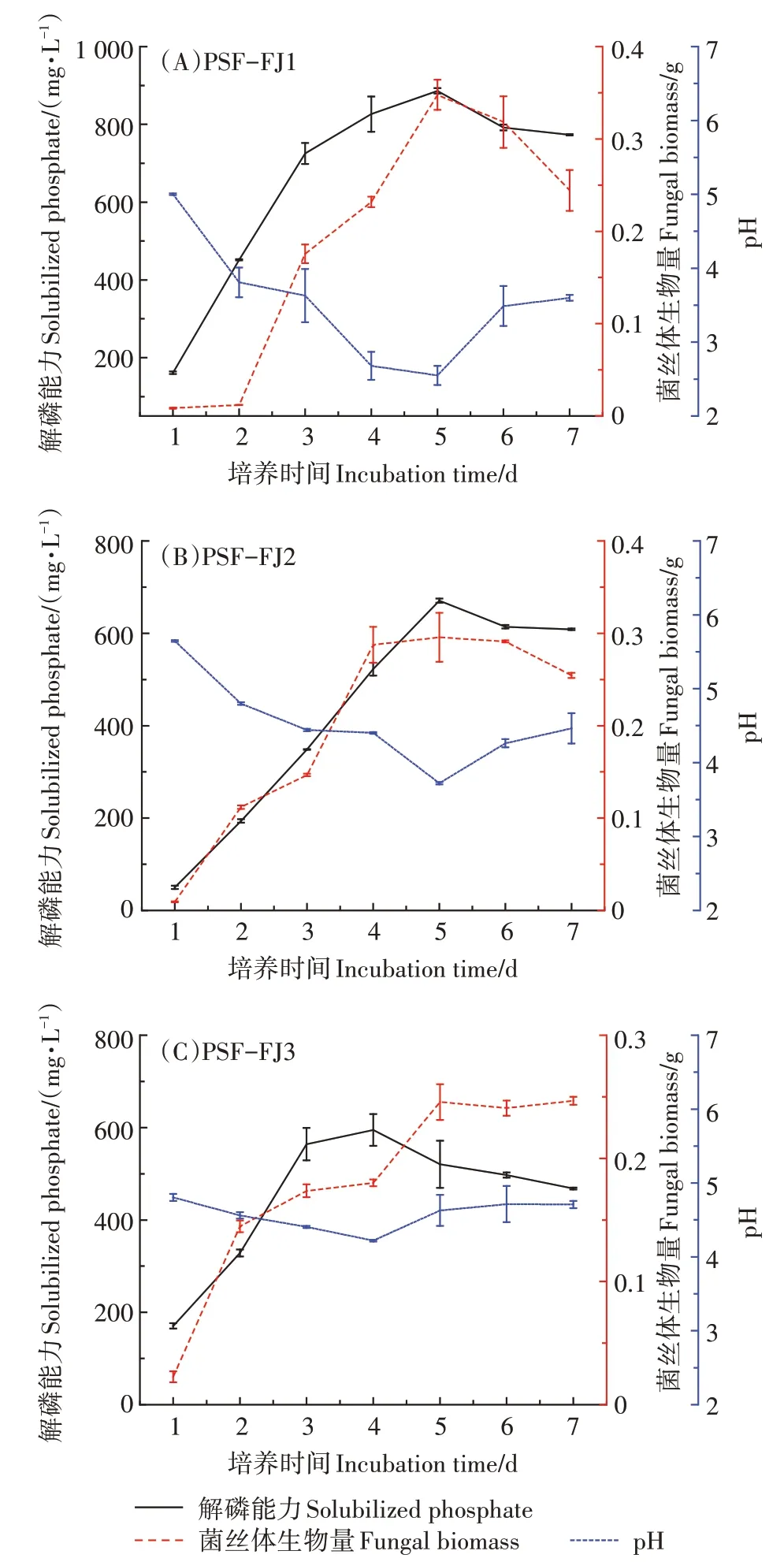
图2 解磷真菌对Ca3(PO4)2的溶解动力学过程Figure 2 Changes in soluble phosphate concentration,pH,and fungal biomass of PSF strains grown in presence of Ca3(PO4)2
研究发现,培养至第4天时,菌株PSF-FJ3使培养液中的白色浑浊物全部消失,但其解磷能力却远低于PSFFJ1和PSF-FJ2,这可归因于菌株PSF-FJ3在培养过程中产生大量菌丝球,这些菌丝球将数量可观的难溶性Ca(PO)包裹在其中,使得部分难溶性磷酸盐未能充分溶解。
菌株PSF-FJ1 和PSF-FJ2 的生物量与磷酸盐含量呈高度正相关,相关系数()分别为0.91 和0.97,菌株PSF-FJ3 的生物量与磷酸盐含量呈显著正相关(=0.78)。3株菌均可使培养液pH 下降至5.0以下,尤其是菌株PSF-FJ1 的培养液pH 最低可降至2.59,菌株PSF-FJ1 和PSF-FJ2 的磷酸盐含量与pH 呈高度负相关,分别为-0.91 和-0.89,菌株PSF-FJ3 的磷酸盐含量与pH呈显著负相关(=-0.66)。
2.3 解磷真菌对不同难溶性磷酸盐的溶解能力
如表1 所示,供试菌株对卵磷脂的矿化能力介于(1.86±0.15)~(3.40±0.15)mg·L,培养液pH 先降低,随后升高。各菌株处理下的磷酸盐含量在培养至第7 天时低于对照值,随后有所增加,菌株表现出矿化卵磷脂的能力。
菌株对不同无机磷酸盐的溶解能力与菌种类型、磷酸盐类型密切相关(表1)。菌株对AlPO的溶解能力强于其对FePO的溶解能力,菌株PSF-FJ2在培养至第14天时呈现出最大AlPO溶解能力,其值为(74.75±7.41)mg·L;而对FePO溶解能力最强的为菌株PSF-FJ3,解磷能力仅为(8.89±0.85)mg·L。所有接种处理都使得培养至第3天时的培养液pH达到最低。

表1 解磷菌株在NBRIP液体培养基中对不同难溶性磷酸盐的溶解能力Table 1 P-solubilizing efficiency by PSF strains in NBRIP liquid medium amended with different phosphates
选取解磷效果最好的3 株菌株进行产IAA 能力和铁载体活性测定时,发现菌株PSF-FJ1 具有以L-色氨酸为前体物质合成IAA和铁载体的能力,菌株分泌IAA的能力可达(3.73±0.02)mg·L,这使得菌株PSF-FJ1 在促进植物生长方面具有重要价值。根据菌株的菌丝形态、分生孢子形态和ITS 序列测序结果,该菌株被鉴定为青霉属真菌(sp.)。
2.4 解磷真菌Penicillium sp. PSF-FJ1 对植株生长的影响
由图3 可知,解磷真菌sp.PSF-FJ1 对桐花树幼苗的生长具有积极的生态效应。与不接种解磷菌剂处理相比,解磷真菌sp.PSF-FJ1处理组的总生物干质量提高23.13%,植株的地上部分和地下部分干质量分别达到(13.17±0.57)g·盆和(13.65±1.31)g·盆,而对照处理仅为(11.23±0.62)g·盆和(10.55±0.45)g·盆。

图3 菌株Penicillium sp.PSF-FJ1接种对桐花树幼苗生长参数的影响Figure 3 Effect of inoculation with Penicillium sp.PSF-FJ1 strain on growth parameters of A.corniculɑtum seedlings
接种解磷真菌sp. PSF-FJ1 增加了根际区域有益微生物的丰度,从而促进了桐花树幼苗对营养的吸收水平。接种处理植株根部和茎中的磷含量显著增加(表2),分别达到(2.14±0.03)mg·g和(0.94±0.05)mg·g,而对照处理植株中的磷含量仅为(1.56±0.16)mg·g和(0.80±0.07)mg·g。菌株对植株生物量的促生效果也会导致更多的磷元素被吸收和转移到植株体内,使得根部和茎中的磷含量进一步显著增加。除磷元素外,与不接种处理相比,解磷真菌sp. PSF-FJ1 处理也使植株茎中氮含量和总氮含量显著增加。

表2 接种Penicillium sp.PSF-FJ1对桐花树幼苗磷和氮营养吸收的影响Table 2 Influences of inoculation with Penicillium sp.PSF-FJ1 strain on P-uptake and N-uptake
解磷真菌sp. PSF-FJ1 对桐花树幼苗的影响不仅表现在生物量上,也体现在叶片的光合特性上(图4)。接种处理的叶片光合色素含量与对照相比显著增加(图4A),叶片中叶绿素a、叶绿素b 和类胡萝卜素含量分别提高40.91%、43.53% 和31.29%;接种处理也使Pn、Tr 和Gs 均显著高于对照处理(图4B),叶片中Pn、Tr 和Gs 分别显著提高37.92%、40.04%和41.70%。

图4 接种Penicillium sp.PSF-FJ1对叶片光合色素和光合参数的影响Figure 4 Photosynthetic pigments and photosynthetic parameters in leaves as affected by Penicillium sp.PSF-FJ1 strain
如表3所示,以FDA 水解酶评估的微生物活性数据表明,土著解磷真菌sp.PSF-FJ1回归桐花树幼苗根际区域后生长良好。与未接种处理相比,菌株sp.PSF-FJ1 不仅可促进植物根系的生长,也可显著提升其根系活力,植株根系活力增强了64.91%。更为活跃的植株根系活动可使植物在根际区域分泌更多的根系分泌物,如其中非常重要的营养和能量物质——可溶性糖。

表3 菌株Penicillium sp.PSF-FJ1接种处理与未接种处理的效果对比Table 3 Difference between Penicillium sp.PSF-FJ1 strain inoculation and non-inoculated treatment
3 讨论
土壤是植物和微生物生长的重要磷库,土壤中储存的磷对缓解磷资源短缺具有重要价值。鉴于红树林酸性硫酸盐土的生境,本文选取Ca(PO)、FePO、AlPO3种无机磷化合物来分析菌株的解磷特征。本研究中,供试菌株在液体培养体系中具有溶解Ca(PO)、FePO、AlPO的能力,且溶解能力表现为Ca(PO)>AlPO>FePO。在以Ca(PO)为磷源的固体初筛培养基中产生明显解磷圈的真菌菌株,也对Ca(PO)表现出最强的溶解能力。与SPAGNOLETTI 等的研究结果相似,菌株对FePO的溶解能力最弱,未在NBRIP固体初筛培养基中产生透明解磷圈。
本研究筛选的解磷真菌sp. PSF-FJ1对Ca(PO)的最大溶解能力可达773.36 mg·L,远高于SPAGNOLETTI 等研究的深色有隔内生菌(DSE)的解磷能力(51.33 mg·L),但低于YIN 等所筛选的拜莱青霉()、草酸青霉()和黑曲霉()的解磷能力(1 400~1 800 mg·L)。供试菌株培养液中的磷酸盐含量与pH呈负相关关系,最高可溶性磷酸盐含量通常也伴随着最低的pH,说明培养液酸化是解磷真菌溶解Ca(PO)的关键机制之一。菌株在溶解Ca(PO)时对培养介质pH 的变化敏感,因此,在酸性培养介质中,解磷真菌呈现出对Ca(PO)更高的溶解性。
与已有研究结果相似,本研究供试菌株对3 种无机磷化合物的溶解能力存在差异,菌株对Ca(PO)的溶解能力强于其对AlPO或FePO的溶解能力。解磷效率的差异与不同磷化合物的结构和成分有关,Ca(PO)的溶度积(p)仅为6~14,而AlPO和FePO的p分别为28~32 和33~35。Al和Fe对自由磷酸根离子具有很强的结合能力,因此限制了其溶解性。尽管菌株的代谢活动也使培养介质的pH 降至3.69~4.70,但仍表现出较低的FePO溶解能力。培养基酸化无法解释菌株对AlPO和FePO的溶解现象,菌株对磷酸盐的溶解效率与其分泌葡萄酸、柠檬酸等低分子量有机酸有关,有机酸的羟基或羧基的螯合作用与AlPO或FePO的溶解效果关系更为密切。
本研究还发现,供试解磷真菌同时具有溶解无机磷酸盐和矿化有机磷的能力。尽管红树林沉积物富含有机磷,但鲜少有研究关注到该生境中解磷真菌对有机磷的矿化能力。供试真菌对卵磷脂的矿化水平远低于其对无机磷酸盐的溶解水平。卵磷脂的矿化主要是通过各种磷酸酶来实现,在低磷胁迫环境下,解磷真菌分泌的植酸酶或磷酸酶可以将有机磷酸盐转化为植物或微生物可直接吸收并利用的可溶性磷酸盐。
磷主要以HPO或HPO的形式被植物吸收,植物对磷的需求量巨大,其吸收也深受根际环境中解磷真菌的影响。接种菌剂可提高功能菌在根际区域的丰度,有助于增强其与其他微生物类群竞争的优势,有益于红树植物的营养需求。作为一种可持续的土壤改良方法,将从红树林根际土壤中筛选得到的高效解磷真菌sp.PSF-FJ1 应用于根际环境,对桐花树幼苗的生物量累积和磷、氮营养吸收都具有积极的影响。植物磷、氮养分对调节植株生长和生态系统生产力至关重要,微生物可促进磷、氮的可用性,触发宿主植物对磷、氮的吸收,从而通过改变内部养分平衡来调节植物生长和生物量积累。本研究的结果也支持了这一点,即桐花树生长的改善与sp.PSF-FJ1菌剂改变植株内部营养吸收相关。
除了解磷能力之外,解磷真菌sp.PSF-FJ1 还能产生植物生长调节剂(IAA 和铁载体),这也是菌株可作为植物生长促生微生物(PGPM)的重要特征。EMAMI 等研究发现,与单独接种解磷菌或IAA产生菌相比,接种拥有多种促生植物生长特性的细菌表现出更好的植物促生效果,促生植物生长的各性状之间并非彼此独立,而是多种机制协同促进植物的生长。微生物分泌的促进植物生长的植物激素中IAA最具代表性,这类化学信使可刺激植株根系的生长和根表面积的增大,使得植物可以吸收更多的水分和矿物营养以用于自身生长,从而累积更多生物量。此外,BAUTISTA-CRUZ 等的研究也指出,微生物产生的IAA激素可影响植物组织的敏感性,从而刺激植物生长并提高作物产量。供试菌株sp.PSF-FJ1与FU 等所研究的菌株类似,菌株所具备的IAA 合成潜力都在植株根系生长方面发挥重要作用,桐花树幼苗的根系活力显著增强了64.91%。
供试菌株sp. PSF-FJ1 也已被验证可合成有利于植物光合作用的铁载体。LOBO等研究发现微生物产生的铁载体可有效增强植物光合能力。在本研究中,解磷真菌sp.PSF-FJ1不仅可以刺激植株生长,还增强了叶片的光合能力。叶片作为光合作用的器官,其含有的养分将影响植株碳同化和生长水平。此外,ALONGI 等发现红树植物在生长初期易受到有效性铁营养含量低的限制,而菌株sp. PSF-FJ1 具溶解土壤中难溶性FePO的能力,这将有利于红树植物对铁营养的吸收和利用,从而避免植株生长受到铁营养的限制。
已有研究发现IAA 激素可削弱植物细胞壁的功能,产生更多根系分泌物,从而为根际微生物的生长提供额外含碳化合物等能量和养分。本研究中产IAA 的菌株sp. PSF-FJ1 也使根际区域中可溶性糖含量显著增加,而可溶性糖是微生物非常重要的能量和营养物质。SINGH等研究提出微生物从根际分泌物中获取更多的营养和能量物质,从而进一步促进该区域微生物的生长和繁殖。植物地下根系对矿物养分的吸收和地上叶片的光合效率是植物生长的动力源,解磷真菌sp.PSF-FJ1 的加入促进了桐花树的生长,同时微生物也从根际区域获得正向反馈,植物-解磷真菌之间形成了良好的互利合作关系。
4 结论
从红树根际土壤中筛选得到的解磷真菌对典型难溶性含磷化合物的溶解能力为Ca(PO)>AlPO>FePO>卵磷脂,真菌菌株在溶解Ca(PO)时对培养介质pH的变化敏感,解磷能力与pH呈负相关关系。
分离和筛选得到的解磷真菌sp.PSFFJ1 对Ca(PO)的溶解能力最强,且具有IAA 和铁载体合成能力。该菌剂的接种处理显著增加植株生物量累积,增强根系活力,提高磷和氮的营养吸收,强化植物叶片光合能力,对桐花树幼苗的生长具有积极的生态效应。而更活跃的根系活动也为根际微生物带来丰富的可溶性糖,更多的营养和能量物质有助于微生物生长,植物-解磷真菌之间形成良好的互利合作关系。

