SHH信号通路在海马神经可塑性及相关神经系统疾病中的作用
谢露露, 姚宝珍
武汉大学人民医院儿科,武汉430000
音猬因子(sonic hedgehog,SHH)是一种分泌蛋白质,在动物海马的发育中起重要作用,且SHH 信号转导对于海马中神经元的模式形成、轴突引导、增殖、存活和分化至关重要。SHH 的异常信号通路会导致多种神经系统疾病发生,如自闭症[1]、抑郁症[2]、神经退行性疾病[3]等。因此,控制SHH信号通路转导,如运用SHH通路抑制剂或激动剂可能有助于相关疾病的治疗,但SHH 信号转导的机制较复杂,目前尚未完全明确。本文综述了SHH 信号通路的海马神经可塑性及其在中枢神经系统发育和相关疾病中的影响,以期阐明SHH 信号转导受损导致中枢神经系统受损和相关疾病的发病机制。
1 海马的可塑性和脆弱性
海马属于大脑边缘系统的一部分,主要负责长时记忆的存储转换和定向等功能。多个感觉关联皮层传递的输入信息汇聚于海马回路的神经元上,从而增强和激活突触。海马的神经回路对环境变化会表现出明显的适应性结构和功能反应,如出现新的突触形式,修剪现有突触,或从海马齿状回亚颗粒区域的神经祖细胞(neural progenitor cell,NPC)中产生新的神经元[4]。当大鼠或小鼠执行认知任务时(如迷宫学习),海马锥体和齿状颗粒神经元的突触数量会增加[5]。
海马神经元特别是CA1 和CA3 锥体神经元,在阿尔茨海默氏病(Alzheimer's disease,AD)、抑郁症和颞叶癫痫这3种主要的神经系统疾病中易出现功能障碍和萎缩,其变性涉及谷氨酸受体的过度活化,生物能/线粒体缺陷,以及受损的细胞应激抗性和修复机制[6]。研究表明,在发育过程中激活促进神经元可塑性和细胞存活的信号通路可保护海马免受损伤,避免疾病[7-8]。在发育过程中,许多调节海马神经元回路形成的细胞信号通路也介导了成年海马的结构和功能可塑性,包括由神经递质谷氨酸和脑源性神经营养因子激活的通路[9]。SHH 在海马神经可塑性和脆弱性中具有重要作用,且在胚胎发育过程中可控制早期细胞模式和轴突生长[10-11]。
2 海马中SHH信号转导
SHH 是一种46 kD 的功能形态发生素,当SHH 肽合成和释放后,其在成人神经组织、大脑中枢系统的生理及病理中发挥重要作用。SHH与其跨膜受体补缀同源物(protein patched homolog,PTCH)结合后,使得细胞跨膜蛋白平滑蛋白(smoothened protein,SMO)游离并被激活,SMO 下游神经胶质瘤致病基因(glioma-associated oncogene homolog,Gli1)水平升高并从核外转移到核内,成为转录激活因子并与DNA 结合诱导目标基因的转录。
在通路激活过程中,SHH 作为配体与受体PTCH1、PTCH2 结合并激活它们,可减轻对SMO的抑制,最终导致锌指家族转录因子Gli 的激活[12]。果 蝇 的Gli 转 录 因 子 有3 个 同 源 物,即Gli1、Gli2 和Gli3。Gli2 和Gli3 是具有C 端激活域和N 端抑制域的双功能转录因子,可以作为激活子或阻遏物发挥作用,而Gli1缺乏N端抑制域,仅作为转录激活子发挥作用[12]。进入细胞核后,Gli转录因子的激活可促进各种靶基因的转录,包括参与SHH通路反馈的基因GLI1和PTCH1,促增殖基因Cyclin-D1和MYC,细胞周期调节剂CCND2和CCNE1,凋亡调节器bcl2以及参与血管生成ANG1/2,上皮间质转化SNAIL和干细胞自我更新NANOG和SOX2[13-14]。该途径的最终结果取决于GLI蛋白的激活剂和阻遏物形式之间的平衡。
目前对从SMO到GLI蛋白的信号转导级联的确切分子机制尚未完全阐明,但研究表明,哺乳动物SHH 信号转导激活需要初级纤毛的参与,SMO和其他下游通路组件必须通过易位来完成Gli 转录[15]。在哺乳动物中,PTCH1 和PTCH2 存在于初级纤毛和周围部位,在与配体结合时,这些受体消散并被SMO 取代[16]。SMO 被蛋白激酶A(protein kinase A,PKA)和酪蛋白激酶1 磷酸化并转移至纤毛[17]。作为SHH 信号转导激活步骤之一,SMO定位于初级纤毛是必需的,此外作为响应,与抑制融合蛋白(suppressor of fused,SuFu)复合的GLI转录因子被转运至初级纤毛的尖端[18];然后,Gli-Su-Fu 复合物解离,激活Gli,并转入细胞核,在细胞核内诱导靶基因的转录。驱动蛋白超家族7(kinesin superfamily7,Kif7)协调纤毛尖端的SHH 信号转导,并防止Gli3 在SHH 刺激下裂解为阻遏物形式[19]。
在无配体结合的情况下,细胞质中的细胞内囊泡中存在的SMO 及其向初级纤毛的易位被PTCH 受体抑制。在这些条件下,Kif7主要定位于初级纤毛的基体,其是一种富含蛋白酶体的结构。Gli2 和Gli3 被蛋白激酶A、糖原合酶激酶和Kif7 磷酸化后,可通过蛋白水解过程转化为阻遏物形式,从而阻止转录[20]。SuFu 是该途径的强负调节剂,其直接与Gli 蛋白结合,防止它们易位到细胞核中[21]。SuFu 也可以进入细胞核,并与DNA中的Gli 结合序列结合并抑制基因转录[22]。音猬因子相互作用蛋白(sonic hedgehog interacting protein,HHIP)是另一个重要的跨膜蛋白,其功能是减弱SHH 信号,可与SHH 配体结合,并通过内吞作用促进HHIP 的吸收,从而使溶酶体降解[23]。SHH信号通路关闭和开放状态如图1所示。
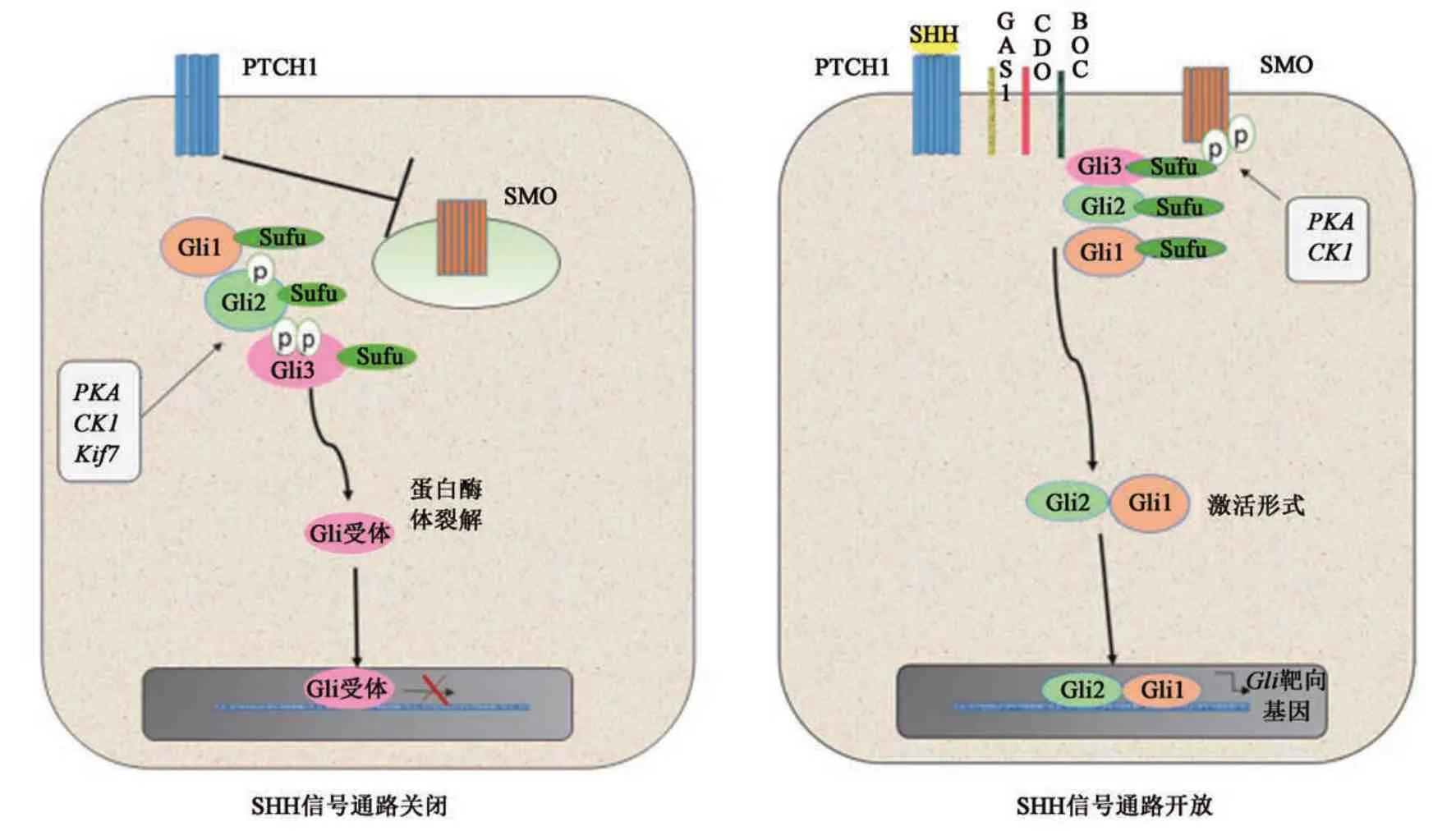
图1 SHH信号通路图Fig.1 SHH signaling pathway diagram
3 SHH在海马中的功能
SHH 可介导海马的结构和功能可塑性,包括神经发生、轴突伸长和突触可塑性。
3.1 SHH可影响海马神经发生
SHH 信号在很大程度会影响胚胎发育过程中部分神经的发生。胚胎发育后期在腹侧海马中产生的NPCs会在出生后迁移至背侧海马,这一过程可能受到SHH 的调节,而SHH 是由海马内神经元的不同亚群和投射到齿状回的内侧内嗅皮层神经元产生的[24]。在胚胎发育末期大脑中选择性敲除SHH 可导致NPC 增殖减少、神经发生减少及新皮层中神经元的异常定位[25]。当从NPC 中敲除转录因子性别决定区Y 框2(sex determining region Y-box 2,SOX2)时,大脑在出生时可能未显示异常,但后期可能表现出干细胞丢失和严重的发育不全[26]。研究表明,用SHH 途径激动剂(SHH pathway agonists,SAG)治疗可部分挽救SOX2 缺陷小鼠的海马发育不全,证明SOX2 下游的SHH在海马发育中起关键作用,且SHH基因是SOX2的靶标[27]。
研究表明,SHH 信号转导也能够调节成年海马NPC 的增殖和分化,海马NPC 可表达PTCH,当从海马中分离出NPC 并将其保留于细胞培养物中时,SHH 会刺激其增殖[28]。此外,腺相关病毒介导的SHH 在海马中的过表达刺激了体内NPC的增殖,而环巴胺抑制了它们的增殖。成年海马在齿状回的亚颗粒区域内存在NPC,这些NPC 可以整合到齿状回中的神经元,并从其他海马神经元以及内嗅皮层、中隔和丘脑的神经元中接收突触输入[29]。海马神经发生在空间模式分离中具有重要作用,这种模式的学习和记忆对于产生认知图(人经历的神经元网络编码模式,包括图像和声音序列)至关重要[30]。成年小鼠基础海马神经发生需要SHH 信号转导,因为表达巢蛋白NPC 中SHH的条件性缺失会导致神经发生减少[31]。
3.2 SHH可刺激轴突伸长
研究表明SHH 可以直接作用于轴突来调节其生长[32-33],但最近有研究表明,胚胎大鼠海马神经元轴突的生长不受SHH 的影响,而是树突中SHH 信号的激活刺激了海马神经元轴突的伸长[34]。PTCH 和SMO 存在于海马神经元的树突状区室中,其中SMO 的局部激活可诱导轴突前纤维蛋白的表达,而前纤维蛋白的突变可消除SHH 对轴突生长的促进作用[34]。此外,与NPC 中的SHH信号不同,即使在缺乏初级纤毛的胚胎海马神经元中,SHH 的轴突伸长促进作用也可能发生。以上研究表明,树突中SHH 信号的激活可增强轴突在同一神经元上的生长,从而加快其与靶神经元树突的相互作用和突触连通性。
3.3 SHH可调节突触可塑性
免疫电子显微镜显示,PTCH 和SMO 聚集于未成熟的胚胎海马神经元的树突状生长锥中以及成年海马的树突和树突棘中,SHH 信号在突触可塑性调节中具有潜在作用[35]。据报道,SHH 会增加海马神经元突触前末端的大小,这与微型兴奋性突触后突触电流频率的增加有关[36]。但目前尚未明确调节海马轴突生长和突触可塑性的SHH的来源。然而,研究表明,SHH 存在于突触前和突触后末端,可能与突触囊泡和小体有关[37]。要充分了解SHH 的具体位置、何时以及如何影响突触可塑性和相关功能(学习、记忆等),还需要进一步深入研究。
4 SHH 信号转导异常可引起多种神经系统疾病
SHH 信号转导的遗传缺陷会在动物和人的神经系统中引起严重的发育异常。SHH 信号的改变也可能导致其他神经发育障碍。
4.1 SHH信号转导异常与唐氏综合症密切相关
唐氏综合症(Down's syndrome,DS)是由21号染色体重叠造成的发育畸形。DS 患者表现出认知能力和运动协调能力发育受损,并且还可发展为阿尔茨海默病(Alzheimer's disease,AD)神经病理特征,包括海马中的淀粉样斑块和神经原纤维缠结[38]。在DS小鼠模型中,SHH信号在神经细胞中减少,PTCH 表达增加[39-40]。SAG 治疗DS 小鼠模型中Ts65Dn新生小鼠可改善小脑发育缺陷,有效恢复颗粒细胞前体库。在DS 模型Ts65Dn 小鼠中海马神经发生受到损害,当采用γ-分泌酶抑制剂治疗小鼠后,神经发生恢复正常[41]。SHH 信号是恢复神经发生所必需的,原因为采用环巴胺治疗小鼠时,γ-分泌酶的抑制作用不能恢复神经发生。SAG 对新生Ts65Dn 小鼠的治疗还可以挽救包括认知缺陷在内的海马表型[42],证明大脑区域/神经回路中的SHH 信号与DS 密切相关[43]。但Ts65Dn 小鼠出生后SAG 治疗并不能缓解小脑内关于运动、学习、任务(相逆适应和前庭眼反射的巩固)的缺陷。有研究将Ts65Dn 小鼠与PTCH 表达降低(增加SHH 信号转导)的小鼠杂交,结果发现,DS小鼠中的部分大脑结构和行为表型趋于正常化[44]。
4.2 SHH信号转导异常可能与自闭症的发生有关
虽然异常的SHH 信号可能会导致DS 神经表型,但尚不清楚SHH 信号是否参与其他常见发育性神经疾病的发生。SHH 信号受损可能导致自闭症的发生,原因为胆固醇生物(7-脱氢胆固醇还原酶)合成的突变会导致常染色体隐性遗传疾病,即史密斯-莱姆利-奥提兹综合症,该病具有自闭症特征。有研究表明,胆固醇水平降低会削弱该疾病的SHH信号转导[45];此外,由编码PTCH 同源物的基因缺失引起的X连锁遗传性神经发育障碍的特征为智力低下和自闭症样行为[46]。NPCs 的纤毛中发现了高水平的磷酸磷脂酰肌醇4-磷酸酯(phosphatidylinositol 4-phosphate ester,PI4P),而肌醇多磷酸5-磷酸酶E 的失活使纤毛中的PI4P耗尽,减少了SHH 信号转导并损害了海马神经的发生[47]。
4.3 SHH信号转导异常可能导致脑缺血
SHH 可能在成人脑损伤反应和与年龄有关的神经退行性疾病中发挥作用。在局灶性缺血性中风大鼠模型中,鞘内注射SHH 或在脑梗死区上方的脑表面局部应用SHH 可以改善功能结局,减少神经元变性并增加神经发生[48]。同时,实验性局灶性脑缺血后短时间即用SMO 激动剂嘌吗啡胺治疗小鼠,可改善功能结局,并减轻中风模型的脑损伤和神经炎症[49];相反,环巴胺治疗会损害小鼠局部缺血性中风后间充质干细胞(mesenchymal stem cell,MSC),影响神经突生长、突触形成以及髓鞘再生和功能恢复的能力[50]。研究表明,MSC 促进神经元和星形胶质细胞中SHH 和组织纤溶酶原激活物生成,进而促进神经突向外生长、突触形成和髓鞘形成。在脑缺血性中风的动物模型中,海马NPC 增殖增加,且SHH 信号在这种对神经元损伤的适应性反应中起关键作用[51]。SHH可能在黑素皮质素对缺血的神经源性反应的下游起作用,原因为选择性地阻断SHH 信号转导可以阻止黑素皮质素4 受体激动剂诱导的神经发生[52]。星形胶质细胞可能是对脑损伤产生SHH的主要来源。有研究表明,响应实验性兴奋毒性癫痫发作,小鼠海马中反应性星形胶质细胞中SHH 表达上调,并且星形胶质细胞产生的SHH 可能刺激星形胶质细胞和小胶质细胞的增殖[53]。除对NPC 和神经元的潜在直接影响外,SHH 信号还可以刺激脑血管生成[54],这可能有助于改善中风和慢性神经退行性疾病(如AD)。
4.4 SHH信号紊乱可能参与AD的发病机制
AD 的发生与海马突触和神经元退化相关,SHH 信号紊乱可能参与AD 的发病机制。研究表明,AD 患者的脑组织样本中PTCH 的水平明显降低[55]。淀粉样蛋白β 肽(amyloid β peptide,Aβ)的自聚集是AD 患者海马的突出特征,对AD 的试验细胞培养和动物模型进行研究表明,Aβ会损害海马神经发生和突触可塑性,并可能引发兴奋性中毒神经元钙超载[56]。在AD 试验模型中,SHH 或SHH 激动剂是否能保护脑细胞尚不清楚,但有研究认为,SHH 可以通过诱导BDNF 的产生保护海马神经元免受Aβ 毒性的影响[57],且在AD 试验模型中已证明BDNF 具有神经保护作用[58]。SHH 可能增强变性中神经元抵抗力的另一种机制是增强自噬。自噬受损与AD 中细胞毒性蛋白Aβ 的积累和线粒体功能障碍有关[59],通过增强线粒体生物能、增强自噬作用可以减轻AD 模型小鼠的AD样Aβ 病理变化[60]。SHH 信号转导可以刺激神经元的自噬[61],但尚不清楚SHH 信号转导是否可以保护神经元免受AD 或神经退行性疾病的功能障碍和变性。未来可采用药理或分子遗传技术对AD 动物模型的SHH 信号操纵进行分析,以增加对疾病的了解,并开发预防和治疗的新方法。
4.5 SHH信号转导异常可能导致抑郁症发生
抑郁是一种常见的精神疾病,发病率和死亡率均较高。动物模型研究表明,抑郁症的认知缺陷是由BDNF 信号缺陷、突触丧失和神经发生受损引起的,而SHH 可能具有抗抑郁作用[62]。电痉挛性休克(electroconvulsive shock,ECS)治疗通常在重度抑郁症患者中较有效。ECS诱导大鼠海马NPC 增殖,而用环巴胺阻断SHH 信号可完全阻止ECS 诱导的NPC 增殖[63]。目前,尚不明确在抑郁症中SHH 信号转导是否受损,或者SHH 激动剂(如SAG)是否表现出抗抑郁作用。SHH 诱导BDNF 表达为抑郁模型中的SHH 信号调节剂的临床前研究提供了理论依据。
5 展望
近年来,研究发现,SHH 信号可以通过调节轴突的生长、突触发生和突触可塑性,进而在整个生命过程中调节海马神经元回路的形成及适应性和可塑性。目前,SHH 信号是否以及如何通过运动、饮食能量限制和从事智力挑战性活动来增强海马神经可塑性的机制尚需更深入的研究[64]。由于异常的SHH 信号转导可能导致发育缺陷,并且也可能导致一系列成人发作性神经系统疾病的发病[41,47,54,61,63],因此,可开发针对SHH 途径的干预措施。临床前研究结果表明,在与唐氏综合症和AD 相关的小鼠模型中,SHH 激动剂SAG 可以逆转海马突触可塑性和空间学习与记忆的缺陷[42]。在AD、抑郁、癫痫、脑缺血等海马疾病的动物模型中,进一步研究SHH 信号转导干预潜在治疗效果可能为将来在相关疾病患者中进行SHH 修饰干预的临床试验提供理论依据。

