艳山姜果实化学成分研究*
段熊仙,赵从琪,吕 芬,李振杰,张 玲,陈军文 ,徐俊驹,4
(1.云南农业大学 农学与生物技术学院,云南 昆明 650201;2.云南农业大学 烟草学院,云南 昆明 650201;3.云南中烟工业有限责任公司技术中心,云南 昆明 650231;4.云南省高校高原特色香料植物资源持续利用重点实验室,云南 昆明 650201)
艳山姜(Alpinia zerumbet)为姜科(Zingiberaceae)山姜属(Alpinia)植物,别名玉桃、大良姜、假砂仁、土砂仁等,广泛分布于中国东南部至西南部各地,是治理石漠化的重要经济植物,也是民间常用的香料植物资源[1-2]。艳山姜作为一种重要的中药材,其干燥成熟果实是贵州少数民族的常用药材之一[3]。有文献记载:以新鲜或干燥成熟的艳山姜果实入药,具有行气止痛、温中燥湿和截疟等功效,主治消化不良、心腹冷痛、胸腹胀满、呕吐腹泻和疟疾等病症[4]。艳山姜主要化学成分为挥发油类和黄酮类[5],现代药理研究结果表明:艳山姜具有抗菌[6]、抗氧化[7]、抗炎镇痛[8]、杀虫驱虫[9]、抗癌[10]和神经保护[11]等活性。目前,国内外对艳山姜的研究主要集中于挥发油及其活性方面,对其他具体化合物研究较少。为进一步开发艳山姜的药用价值,明确其活性物质基础,本研究对艳山姜果实进行系统的化学成分分析。
1 材料与方法
1.1 试验材料
艳山姜果实由云南恩和生物有限公司提供,并由云南农业大学烟草学院徐俊驹教授鉴定。
1.2 试验方法
1.2.1 艳山姜果实化学成分提取
取干燥的艳山姜果实24 kg,经粉碎机粉碎,放入80 L 的渗透桶中,倒入甲醇溶液50 L浸泡10 h,减压蒸馏,反复提取8 次,得到粗提物5 kg。将粗提物溶于蒸馏水中,用乙酸乙酯反复萃取10 余次,回收乙酸乙酯后得到萃取物2 kg。
1.2.2 艳山姜果实化学成分分离纯化
用石油醚和丙酮按体积比(50∶1、30∶1、20∶1、10∶1、8∶2、7∶3、6∶4 和1∶1)对乙酸乙酯层萃取物进行硅胶柱色谱分离,梯度洗脱,得到10 个组分(F1~F10)。
F6 经硅胶柱色谱[石油醚∶乙酸乙酯(50∶1~8∶2)]梯度洗脱,得到12 个组分(F6.1~F6.12);F6.6 经硅胶柱色谱[石油醚∶乙酸乙酯(30∶1~8∶2)]梯度洗脱,得到8 个组分(F6.6.1~F6.6.8);F6.6.4 经硅胶柱色谱[石油醚∶乙酸乙酯(30∶1~10∶1)]梯度洗脱后,得到5 个组分(F6.6.4.1~F6.6.4.5);F6.6.4.5 经制备型薄层色谱[石油醚∶乙酸乙酯(20∶1)]分离后,得到化合物4(0.5 g);F6.6.5 经制备型薄层色谱[石油醚∶乙酸乙酯(20∶1)]分离后,再利用HPLC [甲醇∶水(8∶2~1∶0)]梯度洗脱,得到化合物1(4.0 mg);F6.6.6经制备型薄层色谱[石油醚∶乙酸乙酯(10∶1)]分离后,再经HPLC [甲醇∶水(8.5∶1.5~1∶0)]梯度洗脱,得到化合物2(4.5 mg);F6.6.7 经制备型薄层色谱[石油醚∶丙酮(20∶1)]分离后,再经HPLC [甲醇∶水(8∶2~1∶0)]梯度洗脱,得到化合物3(5.0 mg)。
F7 经硅胶柱色谱[石油醚∶丙酮(30∶1~6∶4)]梯度洗脱,得到10 个组分(F7.1~F7.10);F7.6 经硅胶柱色谱[石油醚∶乙酸乙酯(20∶1~6∶4)]梯度洗脱,得到9 个组分(F7.6.1~F7.6.9);F7.6.8 经硅胶柱色谱[石油醚∶丙酮(10∶1~6∶4)]分离后,得到4 个组分(F7.6.8.1~F7.6.8.4);F7.6.8.3 中有白色片状固体析出,过滤后,采用制备型薄层色谱[乙酸乙酯∶二氯甲烷(8∶2)]分离,得到化合物5(0.45 g)。
F8 经硅胶柱色谱[石油醚∶丙酮(30∶1~6∶4)]梯度洗脱,得到10 个组分(F8.1~F8.10);F8.8 经硅胶柱色谱[石油醚∶乙酸乙酯(20∶1~6∶4)]梯度洗脱,得到9 个组分(F8.8.1~F8.8.9);F8.8.6 经硅胶柱色谱[石油醚∶丙酮(10∶1~6∶4)]分离后,得到4 个组分(F8.8.6.1~F8.8.6.4);F8.8.6.3 中有大量白色晶体析出,通过重结晶,得到化合物6(5.4 g)。
F9 经硅胶柱色谱[石油醚∶丙酮(10∶1~1∶2)]梯度洗脱,得到9 个组分(F10.1~F10.9)。在F10.6 中发现有无色透明方块晶体析出,用甲醇洗脱过滤,再用丙酮洗脱过滤,得到透明方晶,然后用二氯甲烷溶解方晶,再通过重结晶,得到化合物7(3 g)。
1.2.3 艳山姜果实化学成分鉴定
运用13C NMR、1H NMR 和ESI-MS 光谱分析方法对所得化合物进行结构鉴定,化合物1~7 结构如图1。
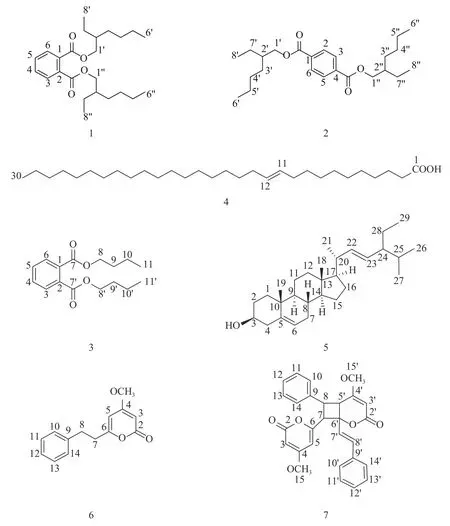
图1 化合物1~7Fig.1 The structures of compounds 1-7
2 结果与分析
化合物1:无色油状物,C24H38O4,ESI-MSm/z:391[M+H]+。1H NMR(800 MHz,CDCl3,δ,J/Hz):7.71(2H,dd,J=7.2,4.0,H-3,6),7.53(2H,dd,J=7.2,4.0,H-4,5),4.25~4.19(4H,m,H-1 ′,1 ″),1.68(2H,m,H-2′,2″),1.33~1.25(16H,m,H-3′,3″,4′,4″,5′,5″,7′,7″),0.90(6H,t,J=7.2,H-6′,6″),0.92(6H,t,J=7.2,H-8′,8″);13C NMR(200 MHz,CDCl3,δ):167.8(s,2×COO),132.5(s,C-1,2),128.8(d,C-3,6),130.9(d,C-4,5),68.2(t,C-1 ′,1 ″),38.7(d,C-2′,2″),30.4(t,C-3′,3″),28.9(t,C-4′,4″),23.0(t,C-5′,5″),14.1(q,C-6′,6″),23.8(t,C-7′,7″),11.0(q,C-8′,8″)。以上波谱数据与文献[12-13]报道基本一致,故鉴定该化合物为bis(2-ethylhexyl)benzene-1,2-dicarboxylate。
化合物2:无色油状物,C24H38O4。1H NMR(600 MHz,CDCl3,δ,J/Hz):8.09(4H,s,H-2,3,5,6),4.27(4H,m,H-1′,1′′),1.75(2H,m,H-2′,2′′),1.50~1.30(16H,m,H-3′,3′′,4′,4′′,5′,5′′,7′,7′′),0.90(6H,t,J=7.0,H-6′,6′′),0.95(6H,t,J=7.5,H-8′,8′′);13C NMR(150 MHz,CDCl3,δ):166.0(s,2×COO),134.2(s,C-1,4),129.5(d,C-2,3,5,6),67.7(t,C-1′,1′′),38.9(d,C-2′,2′′),30.6(t,C-3′,3′′),29.0(t,C-4′,4′′),23.0(t,C-5′,5′′),14.0(q,C-6′,6′′),24.0(t,C-7′,7′′),11.0(q,C-8′,8′′)。以上波谱数据与文献[14-15]报道基本一致,故将该化合物鉴定为terephthalic acid bis(2-ethylhexyl)ester。
化合物3:无色油状物,C16H22O4,ESI-MSm/z:279 [M+H]+。1H NMR(800 MHz,CDCl3,δ,J/Hz):7.72(2H,dd,J=5.6,3.2,H-3,6),7.53(2H,dd,J=5.6,3.2,H-4,5),4.31(4H,t,J=6.4,H-8,8′),1.74~1.70(4H,m,H-9,9′),1.47~1.42(4H,m,H-10,10 ′),0.96(6H,t,J=7.2,H-11,11 ′);13C NMR(200 MHz,CDCl3,δ):132.3(s,C-1,2),128.9(d,C-3,6),131.0(d,C-4,5),167.7(s,C-7,7′),65.6(t,C-8,8′),30.7(t,C-9,9′),19.2(t,C-10,10′),13.7(q,C-11,11′)。以上波谱数据与文献[16]报道基本一致,故鉴定该化合物为dibutyl phthalate。
化合物4:黄色油状物,C30H58O2,ESI-MSm/z:451[M+H]+。1H NMR(600 MHz,CDCl3,δ,J/Hz):5.36~5.33(2H,m,H-11,12),2.36(2H,m,H-10),2.35(2H,t,J=7.5,H-2),2.02(2H,m,H-13),1.63(4H,m,2×CH2),1.31(16H,br s,8×CH2),1.29(14H,br s 7×CH2),1.25(12H,br s,6×CH2),0.88(3H,t,J=6.9,H-30);13C NMR(150 MHz,CDCl3,δ):180.3(s,C-1),129.7(d,C-11),130.0(d,C-12),34.1(t),31.9(t,2×CH2),29.7(t,14×CH2),29.6(t),29.4(t),29.3(t),29.2(t),29.0(t),27.2(t),27.1(t),24.7(t),22.7(t),14.1(q,C-30)。以上波谱数据与文献[17]报道基本一致,故将该化合物鉴定为n-triacont-11-enoic acid。
化合物5:白色片状晶体,C29H48O。1H NMR(600 MHz,CDCl3,δ,J/Hz):3.52(1H,m,H-3),2.28(2H,m,H-4),5.35(1H,m,H-6),0.70(3H,d,J=7.3,H-18),1.02(3H,s,H-19),0.92(3H,d,J=6.5,H-21),5.16(1H,dd,J=15.2,8.8,H-22),5.02(1H,dd,J=15.2,8.8,H-23),0.84(3H,t,J=7.2,H-29);13C NMR(150 MHz,CDCl3,δ):37.2(t,C-1),31.9(t,C-2),71.8(d,C-3),42.3(t,C-4),140.7(s,C-5),121.7(d,C-6),33.9(t,C-7),31.6(d,C-8),50.1(d,C-9),36.1(s,C-10),21.1(t,C-11),39.7(t,C-12),42.3(s,C-13),56.7(d,C-14),24.3(t,C-15),28.2(t,C-16),56.0(d,C-17),11.8(s,C-18),18.8(s,C-19),39.7(d,C-20),23.0(s,C-21),138.3(d,C-22),129.2(d,C-23),45.8(d,C-24),29.1(d,C-25),19.8(s,C-26),19.4(s,C-27),26.0(t,C-28),12.0(s,C-29)。以上波谱数据与文献[18]报道基本一致,故鉴定该化合物为豆甾醇。
化合物6:白色针状晶体,C14H14O3,ESIMSm/z:231[M+H]+。1H NMR(600MHz,CDCl3,δ,J/Hz):5.41(1H,d,J=2.0,H-3),5.72(1H,d,J=1.9,H-5),2.75(2H,t,J=8.0,H-7),2.97(2H,t,J=7.6,H-8),7.29~7.16(5H,m,H-10,11,12,13,14),3.75(3H,s,4-OCH3);13C NMR(150 MHz,CDCl3,δ):171.0(s,C-2),87.5(d,C-3),164.7(s,C-4),100.1(d,C-5),164.1(d,C-6),32.6(t,C-7),35.2(t,C-8),139.7(s,C-9),126.2(d,C-10,14),128.1(d,C-11,13),128.4(d,C-12),55.6(q,4-OCH3)。以上波谱数据与文献[19]报道基本一致,故鉴定该化合物为dihydro-5,6-dehydrokawain。
化合物7:无色针状晶体,C28H24O6,ESIMSm/z:456[M]+。1H NMR(600 MHz,CDCl3,δ,J/Hz):5.34(1H,d,J=2.1,H-3),5.92(1H,d,J=2.0,H-5),4.17(1H,d,J=11.0,H-7),4.36(1H,dd,J=12.0,6.0,H-8),3.71(3H,s,4-OCH3),5.30(1H,s,H-3′),3.60(1H,d,J=9.8,H-5′),6.60(1H,d,J=15.8,H-7′),6.95(1H,d,J=15.8,H-8′),3.28(3H,s,4′-OCH3),7.43~7.24(10H,m)是2 个苯环上的氢信号。13C NMR(150 MHz,CDCl3,δ):164.6(s,C-2),91.8(d,C-3),170.5(s,C-4),102.7(d,C-5),158.6(s,C-6),45.7(d,C-7),54.5(d,C-8),135.8(s,C-9),127.5(d,C-10),128.4(d,C-11),128.2(d,C-12),128.4(d,C-13),127.5(d,C-14),55.9(q,C-15),163.9(s,C-2′),88.7(d,C-3′),169.9(s,C-4′),39.1(d,C-5′),79.4(s,C-6′),124.3(d,C-7′),131.4(d,C-8′),135.6(s,C-9′),126.8(d,C-10′),128.4(d,C-11′),127.8(d,C-12′),128.4(d,C-13′),126.8(d,C-14′),55.4(q,C-15′)。以上波谱数据与文献[20]报道基本一致,故鉴定该化合物为aniba dimer A。
3 讨论
艳山姜作为特色民族药材,国内外对其均有研究,但主要集中于艳山姜挥发油的成分及活性方面,对艳山姜果实的化学成分研究较少。在分离过程中发现:艳山姜果实中小极性物质较多,很多成分难以分离纯化,因此,本研究主要集中于中等极性成分的分离和鉴定,从中得到7 个化合物,其中dihydro-5,6-dehydrokawain 含量较高,有研究表明:该化合物能拮抗实验性胃及十二指肠溃疡,对花生四烯酸和胶原引起的家兔血小板聚集具有明显的拮抗作用,抑制ATP 释放[21]。在本研究的基础上,将对艳山姜果实化学成分以及生物活性展开进一步研究,为深度开发和利用艳山姜提供一定的数据支持。
4 结论
利用正相硅胶柱色谱、薄层层析色谱和HPLC 分离手段对艳山姜果实化学成分进行分离纯化,得到7 个化合物。其中,化合物bis(2-ethylhexyl)benzene-1,2-dicarboxylate(1)、terephthalic acid bis(2-ethylhexyl)ester(2)、dibutyl phthalate(3)和n-triacont-11-enoic acid(4)为首次从艳山姜果实中分离得到。

