贾第虫硫氧还蛋白对小鼠腹腔巨噬细胞炎性细胞因子分泌的影响
梁敏,赵盼盼,王晓岑,李新,张楠,张西臣,李建华,宫鹏涛,张媛媛
1.吉林大学动物医学学院,吉林 长春 130062;2.吉林大学人兽共患病研究所,吉林 长春 130062
十二指肠贾第虫(Giardia duodenalis,简称贾第虫)是一种重要的人兽共患寄生性原虫,通过污染的食物或水经口感染人及多种哺乳动物导致贾第虫病[1],引发腹痛、腹泻、消化不良等症状[2]。由于耐药性、致畸、致突变等问题的存在[3],至今尚无防治贾第虫病的药物。先天免疫是机体抵御病原入侵的重要屏障,研究贾第虫与宿主先天免疫的关系,有利于寻找防治贾第虫病的新型疫苗和药物的作用靶点,为贾第虫的防治提供新的思路。
硫氧还蛋白(thioredoxin,TRX)是一类调节活性氧代谢的氧化还原活性蛋白,在抗氧化系统、调控细胞激活与增殖、参与免疫反应调节、维持蛋白功能活性位点状态和细胞存活等方面发挥重要作用[4-6]。在HEK293 细胞内,人TRX1 可抑制由肿瘤坏死因子-α(tumor necrosis factor α,TNF-α)引起的核转录因子-κB(nuclear factor kappa-light-chain-enhancer of activated B cells,NF-κB)、丝裂原活化蛋白激酶(mitogenactivated protein kinase,MAPK)的活化[7],且TRX1对c-Jun 氨基末端激酶信号通路(JNK signaling pathway,JNK)和p38 丝裂原活化蛋白激酶(p38 mitogenactivated protein kinase,p38MAPK)通路的激活与细胞类型有关[8-10]。在原虫、吸虫等研究中,TRX 作为机体TRX 系统的组成部分,在抗氧化应激方面发挥重要作用[11-12]。贾第虫编码TRX 的基因,且TRX是贾第虫胞外囊泡蛋白组分之一[13],但关于贾第虫硫氧还蛋白(Giardia duodenalis thioredoxin,GdTRX)对先天免疫调节的影响尚未见报道。
本实验利用大肠埃希菌原核表达系统获得重组贾第虫硫氧还蛋白(rGdTRX),并对rGdTRX 调控小鼠腹腔巨噬细胞(peritoneal macrophages,PMs)中先天免疫调节机制进行研究,为GdTRX 免疫功能及其宿主抗贾第虫免疫机制的研究奠定基础。
1 材料与方法
1.1 虫株、质粒及菌株 十二指肠贾第虫WB 株、pET28a 空载体为吉林大学动物医学学院寄生虫实验室冻存并提供;大肠埃希菌感受态DH5α、BL21(DE3)购自北京全式金生物技术股份有限公司。
1.2 实验动物 野生型C57BL/6 小鼠,雌性,6 ~ 8周龄,体重15 ~ 18 g,购自辽宁长生实验动物中心,动物合格证号:SCXK(辽)2020-0001。所有与动物相关的实验均按照中华人民共和国动物伦理程序和指南进行。
1.3 主要试剂 RPMI1640 培养基、胎牛血清、青链霉素购自以色列BI 公司;酵母提取物、NaCl、K2HPO4、KH2PO4、葡萄糖、L-cysteine HCl、卡那霉素、IPTG、PCR 产物回收试剂盒购自生工生物工程(上海)股份有限公司;巯基乙酸培养基购自美国BD Biosciences 公司;Primer star Mix、EcoRⅠ和NotⅠ快切酶购自日本TaKaRa 公司;质粒提取试剂盒、高效无缝克隆试剂盒(MC40101)购自莫纳生物科技有限公司;His 标签蛋白纯化试剂盒购自北京康为世纪生物技术公司;TritonX-114、p38MAPK/ERK 抑制剂购自美国Sigma 公司;牛胆粉、枸橼酸铁铵、酪蛋白、维生素C-Na 购自德国默克公司;兔抗P-p38MAPK、p38MAPK、P-ERK1/2、ERK1/2 以及鼠抗β-actin抗体购自美国Abcam 公司;羊抗兔IgG-HRP 和羊抗鼠IgG-HRP 购自北京Proteintech 公司;小鼠IL-6、IL-12、TNF-α 细胞因子检测试剂盒购自美国Thermo Scientific 公司。
1.4 贾第虫滋养体的培养 将贾第虫从液氮罐中取出,迅速在37 ℃水浴锅中融化,室温2000 × g 离心5 min,弃上清,加入1 mL 改良TYI-S-33 贾第虫培养液(每20 mL 培养基含4 g 蛋白胨、2 g 酵母提取物、0.4 g NaCl、0.26 g K2HPO4、0.12 g KH2PO4、2 g 葡萄糖、0.2 g 牛胆粉、0.2 g L-cysteine HCl、0.04 g 维生素C-Na、200 μL 庆大霉素、660 μL 5 mol/L NaOH、2 mL 双抗、1 mL 枸橼酸铁铵、25 mL 胎牛血清)重悬后,转入厌氧培养瓶中,加满贾第虫培养液,置37 ℃恒温培养箱培养。
1.5 PMs 的分离及培养 小鼠腹腔内注射2 mL 巯基乙酸培养基,3 ~ 5 d 内断颈处死,浸泡于75%酒精中10 min;打开小鼠腹部暴露腹膜,用PBS 冲洗腹腔,将收集的细胞悬液1000 × g 离心10 min;计数后,按3 × 106个/ 孔铺至6 孔细胞培养板,用含10%胎牛血清、1%双抗的RPMI1640 培养基于37 ℃,5% CO2细胞培养箱中培养6 h,换液继续培养备用。
1.6 目的基因的扩增 根据GdTRX 基因序列(GL-50803_00104250)和原核表达载体pET28a 的多克隆位点设计引物,GdTRX-F:5′-ATGGGTCGCGGATCCGAATTCATGCCCTTCAGCCCCATTT-3′(下划线部分为EcoRⅠ酶切位点),GdTRX-R:5′-TGGTGGTGCTCGAGTGCGGCCGCCTAGAGCATGGCGGCCACG-3′(下划线部分为NotⅠ酶切位点),扩增片段大小为372 bp。引物由生工生物工程(上海)股份有限公司合成。收集对数生长期的贾第虫滋养体,提取总RNA 反转录为cDNA,以其为模板,PCR 扩增GdTRX基因。扩增产物经1%琼脂糖凝胶电泳鉴定。
1.7 重组表达质粒的构建 扩增产物经试剂盒回收纯化后,用无缝克隆连接酶将GdTRX 基因与经EcoRⅠ和NotⅠ酶切的pET28a 空载体于50 ℃,15 min 条件下连接,连接产物转化感受态大肠埃希菌DH5α,用含30 μg/mL 卡那霉素的LB 固体培养基于37 ℃过夜培养;提取质粒,进行双酶切鉴定,鉴定正确的质粒送库美生物科技有限公司测序。
1.8 rGdTRX 的表达及纯化 将pET28a 空载体及测序正确的pET28a-GdTRX 质粒分别转入大肠埃希菌BL21(DE3)感受态细胞,挑取单菌落至含30 μg/mL卡那霉素的LB 液体培养基中,37 ℃摇床过夜培养;将菌液按1 ∶100 的比例转接至含30 μg /mL 卡那霉素的LB液体培养基中,37 ℃摇床培养至A600约0.6~ 0.8 时,加入IPTG 至终浓度为1 mmol/L,37 ℃,140 r/min 诱导表达6 h;将菌液8000×g 离心10 min,用Binding Buffer 重悬菌体,超声破碎,再次离心,分离沉淀和上清,进行12% SDS-PAGE 鉴定。用His 标签蛋白纯化试剂盒对目的蛋白进行纯化并透析过夜,取部分透析后蛋白进行12% SDS-PAGE 及Western blot 鉴定。
1.9 内毒素的去除 将终浓度为1%的TritonX-114加至透析后的rGdTRX 蛋白液中,剧烈振荡混匀,冰浴10 min,随后37 ℃水浴10 min;12000 × g 离心10 min,吸取上层水相。将上述过程重复3 次,收集含有蛋白的上层水相,经BCA 法测定浓度后,0.22 μm滤器过滤,-80 ℃冰箱保存。
1.10 rGdTRX 对PMs 活力影响的检测 采用CCK-8法。将PMs 以1×105个/孔的密度铺至96 孔板,培养6 h;分别用PBS(未处理组)和浓度为5、10、20、50、80 μg/mL 的rGdTRX(实验组)刺激细胞24 h;每孔加入10 μL CCK-8 试剂,37 ℃,5% CO2细胞培养箱孵育2 h;450 nm 波长处测定吸光度值。按下式计算不同浓度rGdTRX 的细胞存活率。
细胞存活率(%)=(实验组吸光度值- 空白对照组吸光度值)/(未处理组吸光度值-空白对照组吸光度值)×100%
1.11 炎性细胞因子分泌水平的检测 采用ELISA 法。将PMs 以3 × 106个/ 孔的密度铺至6 孔细胞培养板,贴壁后,用rGdTRX 孵育细胞0、0.5、1、2、4、6 h;收集培养上清,用细胞因子ELISA 检测试剂盒检测IL-6、IL-12 和TNF-α 水平。
1.12 p38MAPK/ERK 信号通路激活情况的检测 采用Western blot 法。将PMs 以3 × 106个/ 孔的密度铺至6 孔细胞培养板,贴壁后,用PBS、His 标签蛋白、终浓度为50 μg/mL 的rGdTRX 孵育细胞0.5、1、2、4、6 h;收取全细胞蛋白后制样,经12% SDSPAGE 分离,湿转法转移至PVDF 膜上,5%脱脂奶粉室温封闭2 h;分别加入兔抗P-p38MAPK、p38MAPK、P-ERK1/2、ERK1/2 及鼠抗β-actin 抗体(均1 ∶1000稀释),4 ℃过夜;TBST 洗膜4 次,10 min/次,分别加入羊抗兔IgG-HRP 或羊抗鼠IgG-HRP(均1 ∶5000稀释),室温孵育1 h;TBST 洗膜4 次,10 min/次,用增强化学发光液(ECL)显色,Image J 对目的蛋白条带进行灰度分析。
1.13 p38MAPK/ERK 信号通路对炎性细胞因子分泌影响的检测 采用ELISA 法。将小鼠PMs 以3 ×106个/ 孔的密度铺至6 孔细胞培养板,贴壁后,分别用p38MAPK 抑制剂(SB203580,30 mmol/L)、ERK抑制剂(PD98059,40 mmol/L)或DMSO 预处理1 h,再用rGdTRX 孵育细胞24 h,设rGdTRX 单独刺激组。分别收集培养上清,用细胞因子ELISA 检测试剂盒检测IL-6、IL-12 和TNF-α 水平。
1.14 统计学分析 所有试验重复3 次。采用Graph-Pad Prism 软件对组内数据进行单因素方差分析,数据使用均数± 标准差(±s)表示,以P < 0.05 为差异有统计学意义。
2 结果
2.1 目的基因扩增产物及重组表达质粒的鉴定 1%琼脂糖凝胶电泳分析显示,GdTRX 基因扩增产物大小为372 bp,与预期一致,见图1。质粒pET28a-GdTRX经双酶切鉴定证明构建正确,测序结果与GenBank上登录的序列相符,见图2。
2.2 表达及纯化产物的鉴定 12% SDS-PAGE 分析发现,rGdTRX 在上清和沉淀均有表达,见图3。用His 标签蛋白纯化试剂盒纯化后,表达的rGdTRX 相对分子质量约20000,见图4;透析纯化后,12% SDSPAGE 及Western blot 分析显示,纯化的rGdTRX 相对分子质量约为20000,见图5 和图6。

图3 rGdTRX 表达的SDS-PAGE 分析Fig.3 SDS-PAGE profile of expressed rGdTRX

图4 His 标签蛋白纯化的rGdTRX 的SDS-PAGE 分析Fig.4 SDS-PAGE profile of rGdTRX purified with His tag

图5 透析纯化的rGdTRX 的SDS-PAGE 分析Fig.5 SDS-PAGE profile of rGdTRX purified by dialysis

图6 透析纯化的rGdTRX 的Western blot 分析Fig.6 Western blotting of rGdTRX purified by dialysis
2.3 rGdTRX对PMs 活力的影响 CCK-8 法检测结果显示,与空白对照组相比,rGdTRX 在50 μg /mL浓度下对PMs 活力无影响(F5,12= 3.780,P > 0.05),在80 μg/mL 下,对PMs 活力有轻微抑制(F5,12=3.780,P > 0.05),见图7。因此,选择浓度50 μg/mL 的rGdTRX 对PMs 进行刺激。

图7 rGdTRX 刺激PMs 的安全浓度筛选Fig.7 Screening of safe concentration of rGdTRX for stimulating PMs
2.4 rGdTRX 调控MAPK 信号通路对炎性细胞因子分泌的影响 ELISA 检测结果显示,与空白对照组相比,在6 h 内,rGdTRX 能够时间依赖性地促进IL-6、IL-12 和TNF-α 细胞因子的分泌,且在6 h 时分泌水平最高(F5,12分别为18.73、54.57 和240.0,P 均< 0.0001),见图8。表明rGdTRX 可诱导PMs中IL-6、IL-12 和TNF-α 的分泌。

图8 rGdTRX 诱导PMs 中IL-6(A)、IL-12(B)和TNF-α(C)细胞因子的分泌情况Fig.8 Secretions of inflammatory cytokines IL-6(A),IL-12(B)and TNF-α(C)inducted by rGdTRX
2.5 p38MAPK/ERK 信号通路激活情况 Western blot 分析显示,与PBS 对照组相比,rGdTRX 刺激PMs可引起p38MAPK 和ERK 的磷酸化(F8,18分别为81.79和158.7,P 均<0.0001);p38MAPK 2 h 和ERK 1 h的磷酸化水平达到峰值,之后随时间延长蛋白磷酸化水平逐渐恢复。见图9 和图10。表明rGdTRX 可激活PMs 的MAPK 信号通路。

图9 rGdTRX 对MAPK 信号通路激活的Western blot分析Fig.9 Western blotting of activation of MAPK signaling pathway by rGdTRX
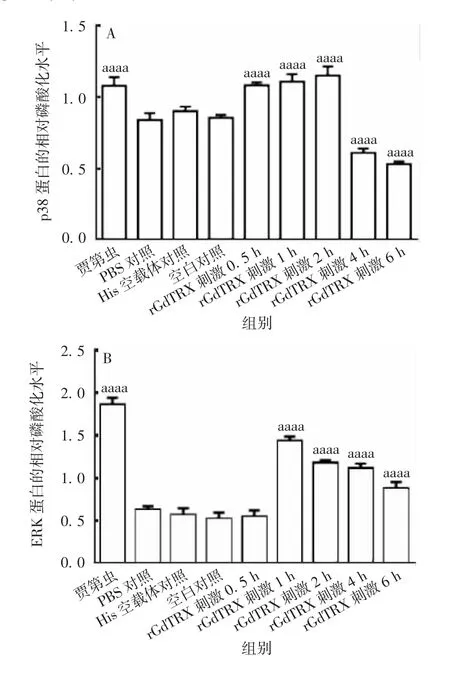
图10 p38MAPK(A)和ERK(B)的相对磷酸化水平Fig.10 Relative phosphorylation levels of p38MAPK(A)and ERK(B)
2.6 p38MAPK/ERK 信号通路对炎性细胞因子分泌的影响 ELISA 检测结果显示,与空白对照组、DMSO 组相比,rGdTRX 组IL-6、IL-12 和TNF-α 细胞因子的分泌量均显著升高(F4,10分别为23.52、26.82 和54.32,P 均< 0.0001)。与rGdTRX 单独刺激组相比,SB203580 预处理组IL-6 分泌量降低约2.3 倍(t = 3.434,df = 4,P < 0.05),IL-12 分泌量降低约3.5 倍(t = 4.448,df = 4,P < 0.05),TNF-α分泌量降低约1.8 倍(t = 4.124,df = 4,P < 0.05);PD98059 预处理组IL-6 分泌量降低约2.5 倍(t =3.754,df = 4,P < 0.05),IL-12 分泌量降低约2.9倍(t = 3.978,df = 4,P < 0.05),TNF-α 分泌量降低约1.7 倍(t = 5.267,df = 4,P < 0.01)。见图11。阻断p38MAPK/ERK 信号通路后,rGdTRX 介导的细胞因子分泌降低,表明rGdTRX 通过p38MAPK /ERK 信号通路调控宿主细胞炎性细胞因子IL-6、IL-12 和TNF-α 的分泌。

图11 p38MAPK/ERK 信号通路对IL-6(A)、IL-12(B)和TNF-α(C)炎性细胞因子分泌的影响Fig.11 Effect of p38MAPK/ERK signaling pathway on secretions of inflammatory cytokines IL-6(A),IL-12(B)and TNF-α(C)
3 讨论
宿主的先天免疫系统在抗寄生虫感染中发挥重要作用。贾第虫感染小鼠能够引起IL-6、IL-12、TNF-α 等多种细胞因子水平上调并发挥抗贾第虫感染作用[14-15],贾第虫分泌的胞外囊泡同样能够诱导小鼠PMs 分泌IL-6、TNF-α 等细胞因子,炎性细胞因子分泌是宿主抗贾第虫感染的重要手段之一。TRX是贾第虫胞外囊泡的重要组分[13,16],在贾第虫诱导的宿主免疫应答中可能扮演重要角色。本实验发现,rGdTRX 能引起PMs 炎性细胞因子IL-6、IL-12、TNF-α 的分泌,提示rGdTRX 在贾第虫激活宿主先天免疫应答过程中发挥重要作用。
TRX 在机体炎症反应、免疫反应、细胞增殖和存活等过程中发挥重要作用[17-18]。TRX 能够促进淋巴细胞增殖及IL-12 分泌,进而增强机体免疫反应,且能够通过JNK、p38MAPK 通路参与细胞凋亡等过程[4,19]。研究表明,MAPK 信号通路有调节细胞增殖、分化以及调控细胞因子分泌等作用[20]。本实验前期研究发现,贾第虫、贾第虫胞外囊泡均能激活宿主细胞p38MAPK 和ERK 信号通路,引起炎症反应的发生[13,16,21]。本实验发现,rGdTRX 同样可激活小鼠PMs 的MAPK 信号通路;p38MAPK/ERK 信号通路被抑制后,rGdTRX 引起的炎性细胞因子分泌显著降低,表明rGdTRX 诱导炎性细胞因子分泌能够通过p38MAPK、ERK 信号通路调控,本文为贾第虫激活宿主先天免疫反应中关键分子的研究提供了新的理论依据。另一方面,在阴道毛滴虫、疟原虫、阿米巴原虫的研究中,TRX 系统是其抗氧化应激反应的主要防线[22],也是阴道毛滴虫适应微氧生活的可能原因。贾第虫TRX 系统具有同等功能,然而其机制仍有待进一步研究[23]。
综上所述,rGdTRX 能通过p38MAPK、ERK 信号通路调控小鼠PMs 炎性细胞因子IL-6、IL-12 和TNF-α 的分泌,本实验为揭示rGdTRX 在贾第虫诱导宿主细胞先天免疫应答机制中起到的关键作用提供了重要理论支撑,rGdTRX 是贾第虫激活宿主先天免疫的关键分子之一。

