生物可降解锌合金的最新研究进展
夏亚茹,何学斌,吕 萍,马胜强,崔旭东,高义民
(1.西安交通大学 金属材料强度国家重点实验室,陕西西安 710049;2.陕西省四主体一联合锌基新材料校企联合研究中心,陕西西安 710049;3.陕西锌业有限公司,陕西商洛 726007)
0 引言
在过去的二十年中,生物可降解合金在临床应用尤其是骨钉、骨板、心血管支架等方面被广泛研究,以满足人体这些部位愈合及康复后必须再次取出永久性临床植入物的临床要求。镁(Mg)和铁(Fe)及其合金作为可吸收医学应用的候选材料被广泛研究。尽管镁基材料具有出色的生物相容性和低血栓形成性,但在生理环境中腐蚀速率较快,导致植入物的机械完整性在骨愈合早期就失效。同时,镁合金较快的腐蚀会产生大量氢气,释放在植入物周围或皮肤组织层而形成气泡,引发严重的细胞组织炎症和严重损伤。目前,可通过合金化、热机械加工和表面修饰技术来改善镁基材料的力学性能和腐蚀过快问题,但镁基材料仍远未达到可降解金属材料植入人体的愈合周期。与镁基材料相比,铁基材料具有优异的机械性能,但在生理环境中的降解速率过慢,导致植入物在达到服役目的后不能被降解,通常需要二次手术取出[1],而且铁的腐蚀产物在生理环境中趋于稳定,长期滞留在体内,可能引起代谢并发症及综合征[2]。
2013 年,锌(Zn)被引入作为Mg 和Fe 的替代品,主要是因为Zn 不仅是人体必需的元素,而且在模拟体液生理环境中的腐蚀速率适中且不会产生氢气[3]。Zn 的标准电极电位为-0.76V,介于Mg(-2.37V)和Fe(-0.44V)之间[4],从而为植入材料提供适宜的腐蚀速率。三种合金的机械性能及腐蚀速率比较如图1 和图2 所示[5]。纯Zn 的力学性能较差,抗压强度小于20MPa,延伸率仅为0.2%,远远达不到临床的需求[6]。据报道,理想的生物可降解支架材料及骨钉、骨板等医疗器械应表现出的拉伸强度和断裂伸长率分别超过300MPa 和25%[7]。研究人员通常利用合金化手段获得机械性能优异的锌合金,并进一步进行热机械加工来提高其综合性能。基于此,本文总结回顾了在生物医学领域中生物可降解锌及锌合金在人体的生物毒性、生物相容性、加工工艺、冶金学以及机械和腐蚀性能方面的最新研究进展,并且介绍了锌基材料在临床上的应用,分析了瓶颈及其发展趋势。

图2 三种合金的腐蚀速率比较[5]
1 锌的毒理学研究
锌是目前公认的人体最多的必需营养元素之一,它存在于所有器官、组织、体液和身体分泌物中。锌在人体的生化功能和生命代谢中起着重要的作用,例如,细胞分裂、生长、伤口的愈合和碳水化合物的分解[8],特别是锌参与人体生理活动的各种酶反应,因此,锌缺乏会引发人体多种健康问题。早在1961 年伊朗就发现,伊朗农民的饮食缺乏锌,导致伊朗农民患有一系列综合征,包括贫血、性腺机能低下和侏儒症等[3]。但需要注意的是,过量的锌会造成神经毒性和大脑损伤。锌主要以Zn2+形式存在于人体中,在人的真核细胞中的最佳浓度约为10ng/L,当Zn2+低于0.06ng/L 或高于60ng/L 时会触发细胞凋亡和诱导毒性作用[9]。因此,对于可降解锌合金植入物,其腐蚀引起额外的锌进入血液,要合理的控制其腐蚀速度和诱导Zn2+排泄,以避免Zn2+的累积而诱发全身毒性。
一般来说,摄入过量的锌会由肾脏以尿液、粪便等排泄物的形式代谢排出体外,但值得注意的是,当锌的摄入量超过正常所需量的10~20 倍时会对机体产生不利影响,超过40~50 倍时会出现急性中毒现象。有报道指出,人体对于锌的毒性耐受度要远小于对镁的毒性耐受度,如要将锌用于骨科内植入材料治疗骨科创伤,则需要避免局部锌合金内固定物降解导致高浓度Zn2+的聚集,从而减少其对机体产生毒性的影响,并保证其释放的Zn2+能保持成骨作用[28]。
2 锌合金的生物相容性
2.1 体内生物相容性研究
目前的体内研究主要使用的是动物,如老鼠和兔子等,也有少量使用猪作为研究对象来代替人模拟实验。众所周知,体内植入实验涉及成本较高、实验复杂,但是相比于体外生物相容性更具有研究价值。已有的动物研究表明,锌的植入物在骨骼和血管组织中具有出色的体内生物相容性。Xiao[10]等人对纯Zn 和Zn-0.05Mg(wt.%)进行了体内和体外实验,在植入兔股骨轴长达6 个月后显示出均匀的降解速率,并且没有出现炎症反应,同时在植入物和骨的界面处形成了新的骨组织,这表明,锌具有明显的刺激成骨的性能和优异的生物相容性。此外,锌对大肠杆菌和金黄色葡萄球菌具有很强的抗菌活性。Li[11]等人研究表明,Zn-1X(wt.%)(X=Mg、Ca、Sr)作为骨针植入到小鼠股骨,经过两个月的诱导成骨,发现在诱导期间基本保持了骨针的完整性,并且没有在手术部位及周围观察到炎症,这也进一步表明,锌具有良好的生物兼容性。而Jin[12]等人在评估体内可降解的血管装置时发现,在大鼠腹部动脉植入Zn-xMg(x=0.002wt.%、0.005wt.%和0.08wt.%)线长达11 个月后,锌合金中的Mg2Zn11颗粒物的体积分数随着Mg 含量的增加而增加,促进了巨噬细胞活性,从而降低了生物相容性。显然,金属间化合物Mg2Zn11颗粒物的存在不利于锌合金的生物相容性。此外,Su[13]等人报道了在兔子腹部主动脉植入锌支架1 个月后,支架表面和血管腔组织之间的降解层较为均匀,并未观察到其他结缔组织,表明锌支架具有优异的生物相容性。
2.2 体外生物相容性研究
一般来说,体外研究对于Zn2+浓度效应方面是一致的,体外细胞反应取决于许多外部因素,如细胞系、血清类型等,这使得锌及锌合金的体外细胞毒性实验的结果受到萃取介质的影响,因此在不同细胞活性的研究中结果可能不一致,应该重新审视用于细胞毒性评估的提取培养基的选择,以便于更为合理地评估可降解锌合金的生物相容性[14]。Ma[15]等人研究了Zn2+集中在人冠状动脉内皮细胞长达24h 的效果,结果表明,Zn2+的浓度低于80μM时促进细胞活性、增殖、黏附和迁移,而暴露于较高Zn2+浓度(80~120μM)表现出相反的细胞行为,不利于血管生成,容易引发炎症。
通过体内、体外研究表明,生物锌合金具有较为理想的生物相容性,避免了永久性植入物的应力屏蔽、组织周围金属堆积、二次手术等问题,在骨骼和血管方面具有较大潜力,但植入人体还需展开进一步的生物综合性能评估的研究工作。
3 生物锌合金加工技术
将液态合金浇注到所需零件相适应的铸型空腔内,使其凝固、冷却,这种生产零件(毛坯或成品)的过程称为铸造[16]。铸造可以分为砂型铸造、金属型铸造、熔模铸造、压力铸造、消失模铸造、低压铸造、差压铸造、定向凝固技术及其他铸造方法(陶瓷型铸造、离心铸造、挤压铸造和真空吸铸等)[17]。往往通过铸造将锌合金铸造成特定形状的医疗设备,比如骨固定螺钉、骨板或薄壁圆柱管,作为后期进一步机械加工的原材料。
锻造加工依靠施加外力来使金属发生塑性变形成为所需形状,包括挤压、拉拔、轧制和锻造。锻造工艺可以细化锌合金的微观结构,并通过激活塑性变形机制(位错滑移和堆积)来提高机械性能。锻造加工可以分为热加工和冷加工,这具体取决于金属的再结晶温度。对于锌合金,可以通过对圆柱形锭进行挤压、拉拔的形式进行加工,以形成血管支架等;也可通过平板轧制以形成骨板等。
先进加工技术也在锌合金的加工上展开应用。粉末冶金是指在等静压条件下对金属粉末进行压实,通过烧结实现致密化进而形成固体形状,包括热压和冷压。Hermawan[18]等人是研究粉末冶金技术制造可降解血管支架的先驱。严重塑性变形技术(SPD)中的高压扭转技术和等通道角压技术也被用于加工锌合金。增材制造(3D 打印)在生物医学领域也开始引起人们的关注,能够使用计算机辅助设计模型,以逐层顺序制造具有精确成分的复杂三维零件。电铸与电沉积原理相似,可以用来生产具有复杂结构的金属部件,在电铸过程中,通过电解将原子层堆叠在导电基板上形成金属部分,可以制造出具有高精度的几何形状,但是对于电铸制造锌合金支架仍然需要进一步研究。
4 生物锌合金的机械性能
4.1 合金化的影响
合金化是锌合金最有效的强化方式,经过研究者们几十年来的研究,合金化元素包括Mg、Ca、Li、Sr、Mn、Cu、Fe、Ag、Bi 等元素,其中除Cu 之外,其他元素在锌合金基体中的固溶度都很小。因此,起强化作用的往往是第二相析出强化方式,且析出相的分布、形态、尺寸和体积分数会对机械性能和腐蚀行为造成影响。另外,也有研究稀土合金元素的相关报道,在Mg 基合金中应用最广泛,如La、Ce、Pr、Nd、Pm、Sm、Eu、Gd、Tb、Dy、Tm 和Sc 等[25],可以细化晶粒、与杂质元素结合以减少缺陷、减少电偶腐蚀、形成致密的氧化膜等提高耐腐蚀性,通过固溶强化、分散强化等来改善机械性能,并且往往具有良好的生物相容性。而生物锌合金相关的稀土掺杂研究较少,特别是稀土锌合金的研究,也是未来的发展方向。
4.1.1 二元生物锌合金体系
常见的二元合金体系有Zn-Li、Zn-Mg、Zn-Mn、Zn-Cu、Zn-Ag、Zn-Fe 和Zn-Ca。相对于纯锌,当添加的合金元素量很小时,其拉伸强度和伸长率存在着显著差异。有研究对生物可降解锌材料进行了合金化设计,分析对比了纯锌和二元锌合金的机械性能,结果如图3 所示[19]。其中Li、Mg、Cu、Ag 和Mn 对纯锌表现出较显著的强化作用,其强度随着合金元素含量的提高而进一步提高,Li 的强化作用表现最为显著,例如,添加0.1wt.%Li 使得纯锌的极限抗拉强度从(166.79±6.36)MPa 增加到(431.27±5.89)MPa,而添加0.4wt.%Li的极限抗拉强度最大为(520.36±1.83)MPa。值得注意的是,延展性也会显著下降,但与纯锌相比,Zn-Cu、Zn-Ag 和Zn-Mn 合金保持了优异的延展性。Ga、Fe 和Sr 的合金化含量达到0.8wt.%时几乎对纯锌的抗拉强度无显著改善,但添加Ag 会导致抗拉强度降低。
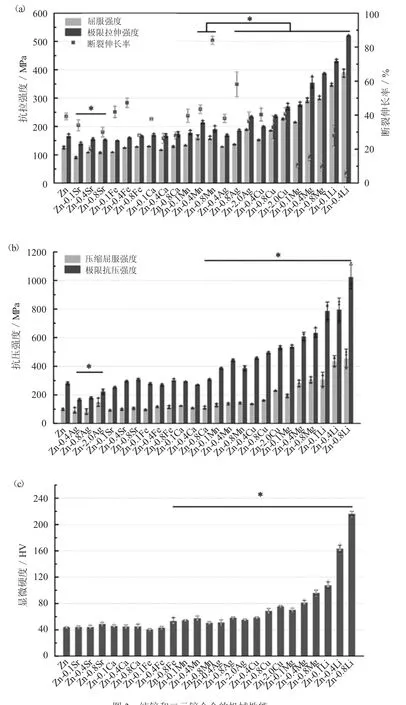
图3 纯锌和二元锌合金的机械性能
4.1.2 三元生物锌合金体系
目前被广泛研究的三元合金体系有Zn-Cu-Mg/Fe、Zn-Mg-Sr/Ca/Mn,也有Zn-Al-Mg体系。Liu[20]等人研究了Ca 和Sr 对低共晶锌镁合金的影响,发现组织中存在Mg2Zn11、CaZn13、SrZn13相,使得两种三元合金具有更细的晶粒尺寸和更均匀的微观结构。Tang[21]等人通过一系列Zn-3Cu-xMg 三元合金研究了Mg 添加到Zn-Cu体系中的影响,观察到了CuZn5和MgZn11,发现随着Mg 浓度的增加合金的晶粒尺寸细化、组织更加均匀。Yue[22]等人研究了Fe 在Zn-3Cu-xFe 三元合金中Zn-Cu 体系中的影响,发现FeZn13和CuZn5粗大颗粒的存在,导致微观结构均匀性被破坏,力学性能下降。
4.2 热机械加工对生物锌合金的影响
热机械加工也会改变合金的微观结构,如经过塑性变形后可进一步消除成分偏析和细化组织,从而改变合金的机械性能。对于可降解的医疗器械,如支架、缝合线、骨钉、骨板等其形状与机械性能的匹配度有较大的差异,因此,必须确定理想的机械性能范围,以用于特定的医疗应用。不同的合成路线和加工参数会显著影响晶粒尺寸、形状和织构特性,特别是生物锌合金基体内析出二次相的性质、含量、形状和分布。此外,随着植入时间的进行,可降解金属材料会发生腐蚀,机械性能下降。因此我们要对机械性能进行动态评估,包括在应力腐蚀、腐蚀疲劳以及愈合过程中。但对于可降解锌合金,这些信息较为缺乏,对于在特定种植体应用获得市场批准之前提供一套完整的设计要求至关重要。
5 腐蚀行为和生物降解性
可降解锌合金以及其他应用于生物医学上的材料的腐蚀状况评估,通常是在体外完成的,然后再进行复杂的体内植入评估。目前针对锌合金的体外评估采用的生理电解质环境主要为模拟体液和磷酸缓冲液等。Liu[23]等人证明了纯Zn 的腐蚀首先是从晶界处开始的,这主要是由于晶界内能、缺陷和杂质导致的,Zn 的腐蚀机理[20]如下:
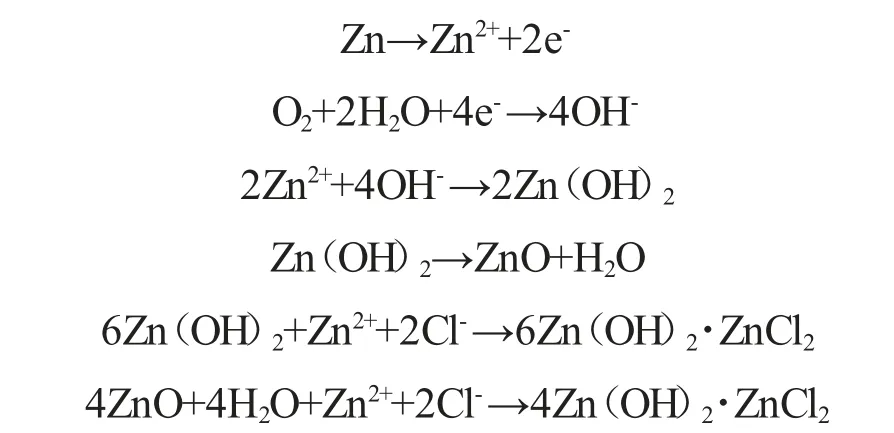
而对于锌合金,更多的是发生在析出第二相与基体界面处的电偶腐蚀,腐蚀状况往往取决于合金元素种类(如生成的氧化物膜不同)和第二相的形貌尺寸(如第二相细化和均匀分布可有效降低电偶腐蚀倾向)[24]。Zhao[26]等人制备了Zn-Li 系合金,在模拟体液环境下进行体外测试,发现当Li含量增加时(2at.%~8at.%)其腐蚀速率基本接近血管支架对腐蚀速率的要求,值得注意的是,到目前为止,没有研究发现完全满足腐蚀速率的可降解锌合金。针对体内研究,通过动物模型可以获得更具有代表性的方案来研究人体中可降解植入物的腐蚀反应。Guo[27]等人对用于胃肠道吻合手术的可降解Zn-Li-Mn 合金订书针进行了体外和体内研究,在浸泡到Hank's 模拟体液中的体外研究中,合金短纤保持了完整性没有断裂,在植入到猪肠道的体内实验中,合金短纤可保持8 周的机械强度,足以治疗伤口愈合,之后因为位于胃肠交界处,受到组织牵引和胃酸腐蚀,订书针才发生明显的退化,因此总降解周期可缩短至1 年左右。
6 应用及其发展趋势
生物锌合金目前还未实现在人体中的广泛应用,但被认为具有广泛医疗应用的潜力,如在药物输送、癌症治疗、骨科再生和心血管治疗等领域。
尽管大量的体内、体外研究表明锌合金极有希望作为骨骼和血管等植入物,如Zn-Mg、Zn-Sr等,但完全满足植入人体的条件之前,仍然存在一些挑战和问题需要解决。首先,绝大多数研究都集中在传统的加工技术上,如挤出和轧制,而其他先进的加工技术如AM(增材制造)尚未被充分探究,因此,继续研究对非传统工艺满足可降解金属植入物的条件是其中一个发展趋势。其次,如何保持锌合金植入物在降解过程中的机械性能稳定性问题,相关文献研究较少,是未来生物锌合金的发展方向之一。第三,缺乏对锌合金生物降解性和生物相容性一致性和可重复的标准方案,因此,建立生物锌合金的统一评价标准及生物评价测试方法是非常有必要的。

