化学反应中水分的控制方法
张全冰 丁现帅
(陕西汉江药业集团股份有限公司,陕西 汉中 723000)
随着国家对安全生产和药品质量要求的日益提高,在现阶段的化工或化学制药生产中,对化学反应的控制提出了更高的要求。在化工生产或化学制药中,有不少化学反应是需要严格忌水的,若反应体系中水分的含量到达一定水平,不但会导致目标产物的减少、杂质的生成,影响产品质量,还可能造成整批产品的报废甚至引发剧烈反应而导致冲料、爆炸等安全事故[1]。如下面2个化学反应(图1,2)。
图1所示反应为溴代反应,若有少量水存在,会生成其它的产物,影响目标产物的纯度和收率。
图2所示反应为甲酰化反应,若反应体系有少量水存在,则在反应过程中会生成杂质,导致后期产品分离困难,也会伴随出现剧烈放热现象,并有冲料的风险。
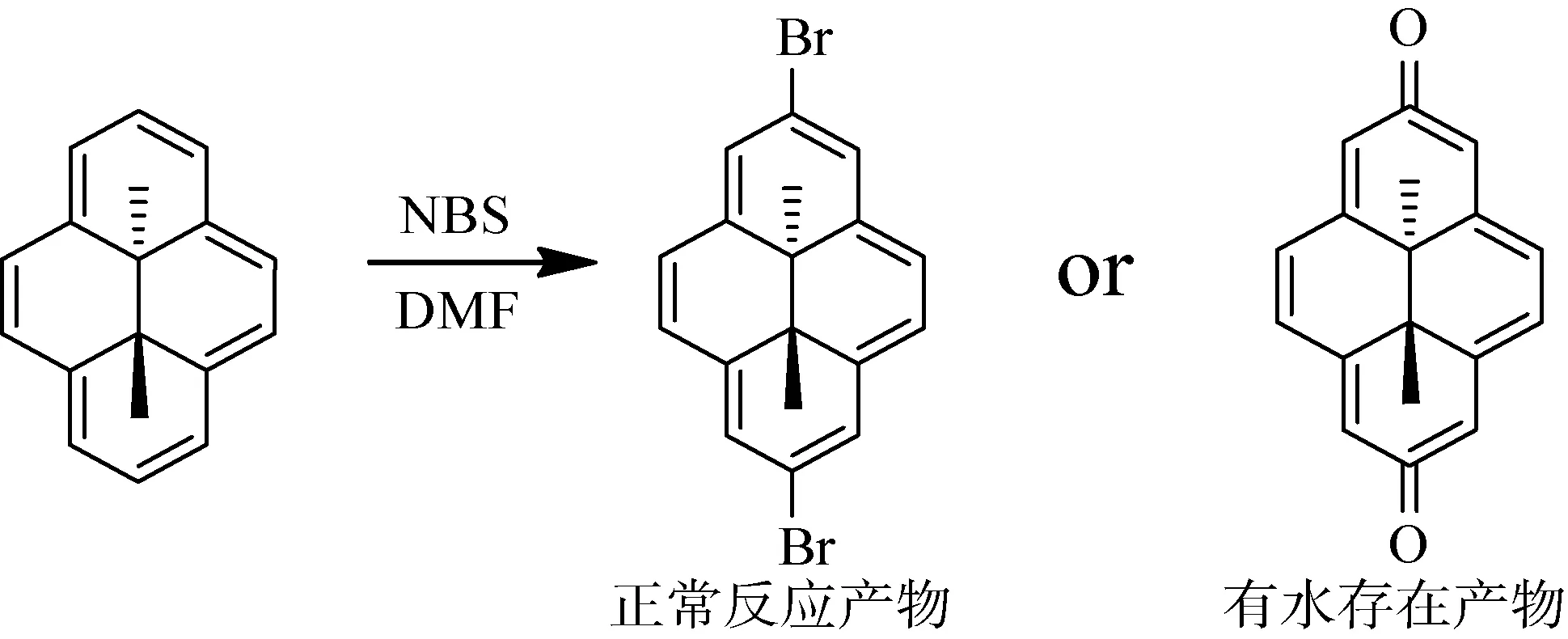
图1 反应方程式1
所以,针对此类忌水的反应,必须从多方面控制反应体系中的水分。在化学反应的过程中,尤其是反应体系比较大的反应设备中,对水的控制不容易做到位。水分可能由固体原料的水分,液体原料的水分,溶剂的水分,设备中的水分残留,空气中的水分或者化学反应生成的水分来进入反应体系。控制好水分,就能使化学反应正常进行,得到目标产物,因此,本文建议从以下几方面对水分的引入进行控制(表1)。
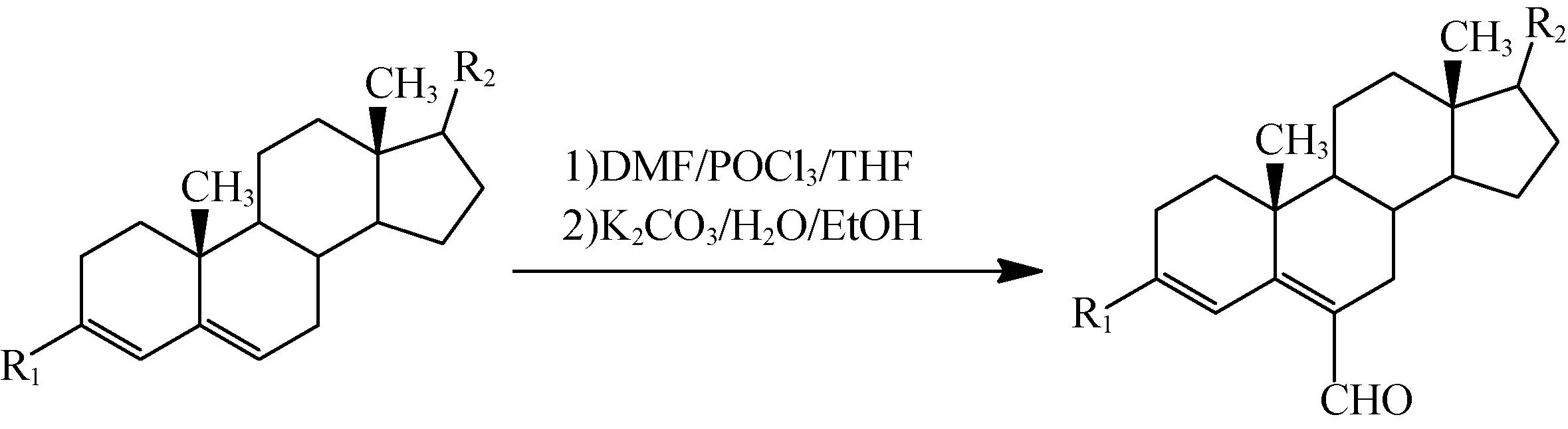
图2 反应方程式2
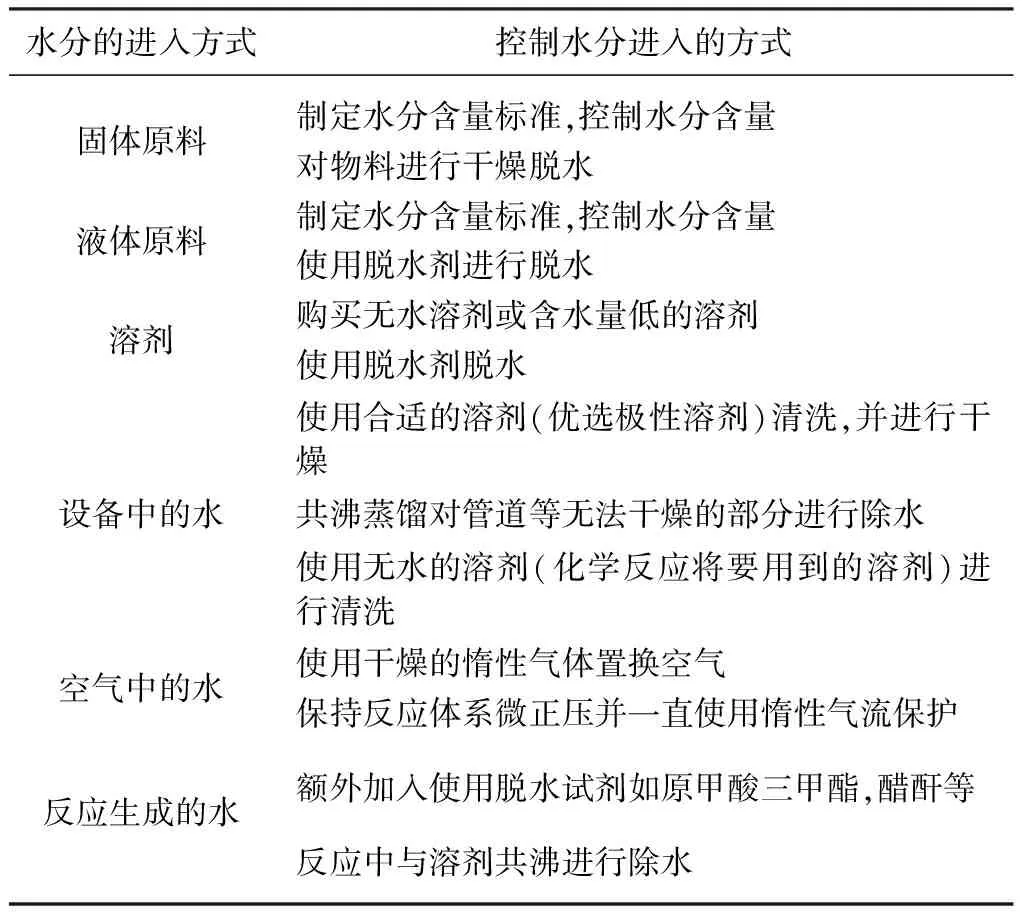
表1 水分的引入及控制方式
对于固体原料,首先需要对水分这一检验项目制定严格的含量标准。然后,对投料前的原料要进行水分的测定。另外还需要从固体原料的理化性质,生产工艺来进行判断:有些原料易于吸潮,在进行检测后,对该原料要密封保存,防止水分进入。有些原料在生产(析晶)的最后一步,使用了水做溶剂或在含水的溶剂体系中析晶,这些原料需更加严格地控制水分的含量。对于含有结晶水的化合物,在投料前,一定要认真识别,尽量选择无水化合物,防止结晶水影响化学反应。另外,在使用固体原料前,要观察物料状态,确定有无吸潮现象。必要时可对要使用的固体原料进行二次干燥。
对于液体原料,也需要制定严格的水分含量标准,并进行水分的测定。常规的一般可使用卡尔费休试剂进行水分含量滴定,对有些含酮基团的液体原料,还需要用专用醛酮试剂进行测定。对于含水量达不到要求的液体原料,可使用脱水剂进行脱水,要注意脱水剂的稳定性,不能与液体原料发生反应。对于使用的溶剂,优先购买无水溶剂或含水量较低的溶剂进行使用,对于溶剂中水分的去除,可使用脱水剂如氢化钙、分子筛等进行脱水,也可对特定溶剂如甲苯使用共沸脱水的方式进行脱水。
很多的液体原料易吸潮,如暴露在空气中或储存的容器密封不严或储存时间较长,都可能从空气中吸收水分,导致前期的检验结果和使用时实际含量不符。建议在实际的使用中,可在先把不相互反应的溶剂投入到反应体系中以后,再取样进行水分检测,若水分不合格,就不要使用或重新处理后再进行使用,防止在加入其它的原料后,由于溶剂或反应体系中的水分影响产品的反应进程。
对于设备中的水分,反应前要充分干燥,确保水分的残留在一定限度内。实验室用的反应容器较小,大部分是玻璃材质,易于观察,能发现水分的存在,容易清洗及干燥。但是在大型的反应釜或反应罐里面,做到无水的要求就比较难。建议使用相应的溶剂升温至回流进行清洗并干燥,保证管道、滴加计量罐、冷凝器等辅助设施均被清洗干净,必要时拆下易于拆卸的部分进行清洗干燥,尤其是U型管等不易干燥的部位,然后在干燥氮气的保护下进行干燥,防止潮湿的空气进入。
空气中的水分,也可能随着空气进入非封闭的反应体系。在20 ℃时,空气中的水分含量可达到20 g/m3,且随着温度和湿度的升高,空气中的含水量会大于该含量。
空气中水分计算公式可按以下经验公式计算:
Hs=η*(18/22.4)*Ps/(P-Ps)
其中:Hs——空气中含水量,kg/m3;
η——相对湿度;
Ps——对应温度下水的饱和压力;
P——标准大气压力。
在小试实验或工业化生产上,防止空气中水分进入反应体系的一种措施就是使用干燥的惰性气体进行保护。常见的可选择的惰性气体有氮气和氩气,气体密度如表2所示。在放大或工业化生产上,由于氮气的使用成本低,易于制造,安全性高,所以一般使用氮气进行保护。在使用氮气做保护气时,需要对进入反应体系的氮气进行脱水,常规的脱水方法为使用固体或液体脱水剂。固体可选择无水氯化钙、氢化钙等进行脱水,液体脱水剂可选择浓硫酸进行脱水,为保证脱水效果,也可以使用多级脱水。需要注意的是,要在进反应系统前,要设置缓冲或过滤设施,避免将脱水剂带入反应体系。在物料加入前,先用干燥的氮气对反应系统进行置换,将反应空间的含水的空气置换出来,加入物料后,若条件允许,可进行再次置换,易挥发的物料可先装入滴加设备中。二次氮气置换时,可先将这些物料隔离,置换完成后,进行滴加混合。在滴加物料或反应的过程中,氮气要始终开启,保持微正压,可通过流量计进行控制,直至反应结束。这样操作能有效防止空气中水分进入反应体系。

表2 气体密度对比表Tab. 2 Gas density comparison table
在小试实验中,对于常规的反应体系,优先使用氩气进行保护,氩气的密度较大,易于在反应体系内下部沉积,对于无气体生成的反应,可通过充满干燥氩气的气球对反应体系进行保护,先将固体物料和溶剂加入反应瓶中,将液体物料加入分液漏斗,反应体系抽真空,然后通过开关连接装有干燥氩气的气球,用气球里的干燥氩气对反应体系的空气进行置换,并保持相同的压力,再将滴液漏斗备好的物料加入反应体系,开始进行反应,反应过程中,气球开关一直开启,保持反应体系为微正压即可,直至反应结束。小试实验中,惰性保护气体仍然需要进行干燥,干燥方式可参考工业化氮气的干燥方法。
反应中生成的水分可能会抑制反应的进行,可使用共沸脱水或添加脱水剂的方式进行处理。有些反应可选用与水共沸的溶剂,通过回流共沸,将生成的水通过溶剂带出去,也可以加入乙酸酐、原甲酸三甲酯(如图3)等除水剂,让除水剂和水通过化学反应,生成不影响反应的化合物或溶剂,控制反应条件,将副产物进行蒸馏分离。如果反应中可使用廉价的原料把水处理掉,那参与反应的溶剂、固体原料、液体原料就可以把水分标准控制的宽一些。如在乙酰化反应中,加入乙酸酐来消耗反应体系中的水分及生成的水分。
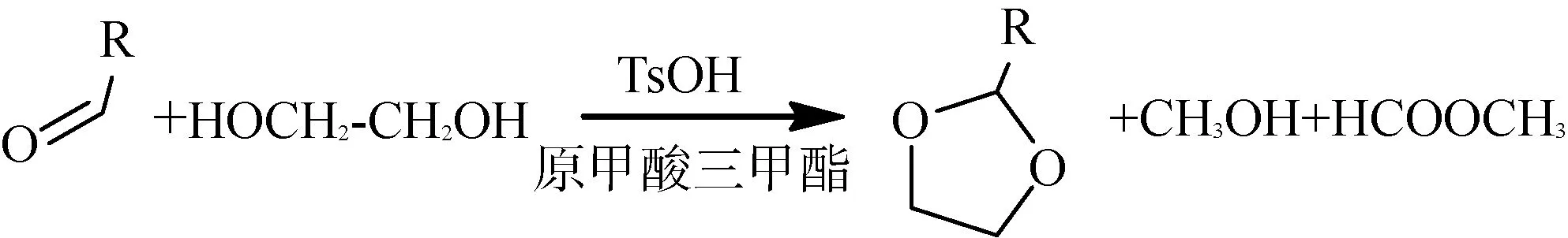
图3 反应方程式
从化学反应的本质来看,除水的主要原因是有些化学品会与水发生剧烈反应,生成其它物质,导致参与反应原料的变化,生成了其它物质;或者原料遇水大量放热,造成反应急剧进行,导致温度失控。如果做好控制原料的水分,使用惰性气体保护的控制空气中的水分,控制反应设备中残留的水分,控制反应生成的水分,以实现总水分的控制,是可以保证反应体系的水分在一个相对较低的水平的,是能够使用忌水的化学原料如金属钠,三氯化磷等顺利参与化学反应,并按照我们设定的目标来完成化学反应的。

