医疗器械包装材料的微生物屏障性能检测方法探讨
李冬梅 王丽洁 方菁嶷
1 苏州苏大卫生与环境技术研究所有限公司 (江苏 苏州 215000)
2 苏州大学医学部 (江苏 苏州 215000)
内容提要:微生物屏障性能是医疗器械包装材料的重要指标之一,目前其评价方法分为:适用于不透性材料的方法和适用于透气性材料的方法,但市场上仍有将这两种方法混用的情况。文章从材料的类别出发,针对不同材料的微生物屏障性能测试方法进行分类和总结,以便于供应商和检测机构根据自己的检测能力和包材类别选择合适的微生物屏障性能检测方法。同时给出微生物屏障性能的替代方法以期达到缩短实验周期的目的。
合格的医疗器械包装系统包含无菌屏障系统和保护性包装,其中,保护性包装主要是在产品运输及存储过程中提供物理保护,而无菌屏障系统的主要作用是保持产品的预期临床用途、货架有效期及方便临床的无菌取用。因此,许多国家及组织将无菌屏障系统纳入与医疗器械同等重要的行列。
微生物屏障是指无菌屏障系统在规定条件下防止微生物进入的能力[1]。任何一个无菌屏障系统都需要对其微生物屏障特性进行评价,这一点无论是在ISO 11607-1:2019这一体系标准还是《无源植入性医疗器械货架有效期注册申报资料指导原则(2021年修订)》征求意见稿里都有明确指出。根据ISO 11607-1:2019,当用物理学方法可以证明材料是不透性材料时,即该材料具备微生物屏障性能;反之,则需要用微生物学方法进行菌种挑战试验。因此,评价包装材料的微生物屏障特性时,可以根据材料的透气性,分别进行相应的方法学评价。
1.不透性材料的微生物屏障特性评价
对于不透性材料,其微生物屏障特性是按ISO 5636-5:2013即葛尔莱(Gurley)法进行透气度试验,其方法原理是空气是由浮动在液体中的垂直圆筒的重量来压缩,当测试样品与压缩空气接触时,圆筒稳定下降,测得的一定体积的空气通过测试样品的时间即为空气阻力,并由此进一步计算透气度(见图1)[3]。目前,国内大多数自动化的葛尔莱透气度测试仪根据此标准进行了改良,其工作原理是在一定的温度和湿度下,使试样两侧保持一定的气压差,通过测量试样低压侧气体压力的变化,计算出所测试样的透气度,同时遵循ISO 11607-1:2019附录C给出的不透性材料的判断准则—,即不少于1h后,内圆筒应无可见移动,允差为±1mm[1]。1mm的液体压强允差转换成自动化仪器(见图2)的气压变化为10Pa,因此可设置自动化仪器的测试停止压力(即下腔压力)为10Pa,记录测试时间。如测试时间可维持高于1h,则可证明该材料为不透性材料,如无法维持1h,则该材料需要用透气性材料的方法来证明其材料的微生物屏障性能。虽然也可使用其他测定透气度的方法,如消波尔法、本特森法等进行,且标准GB/T 5032-2002也给出了三种方法之间的换算,但是对于不透性材料而言,不需要测得其透气度,测不出才能证明其为不透性材料。
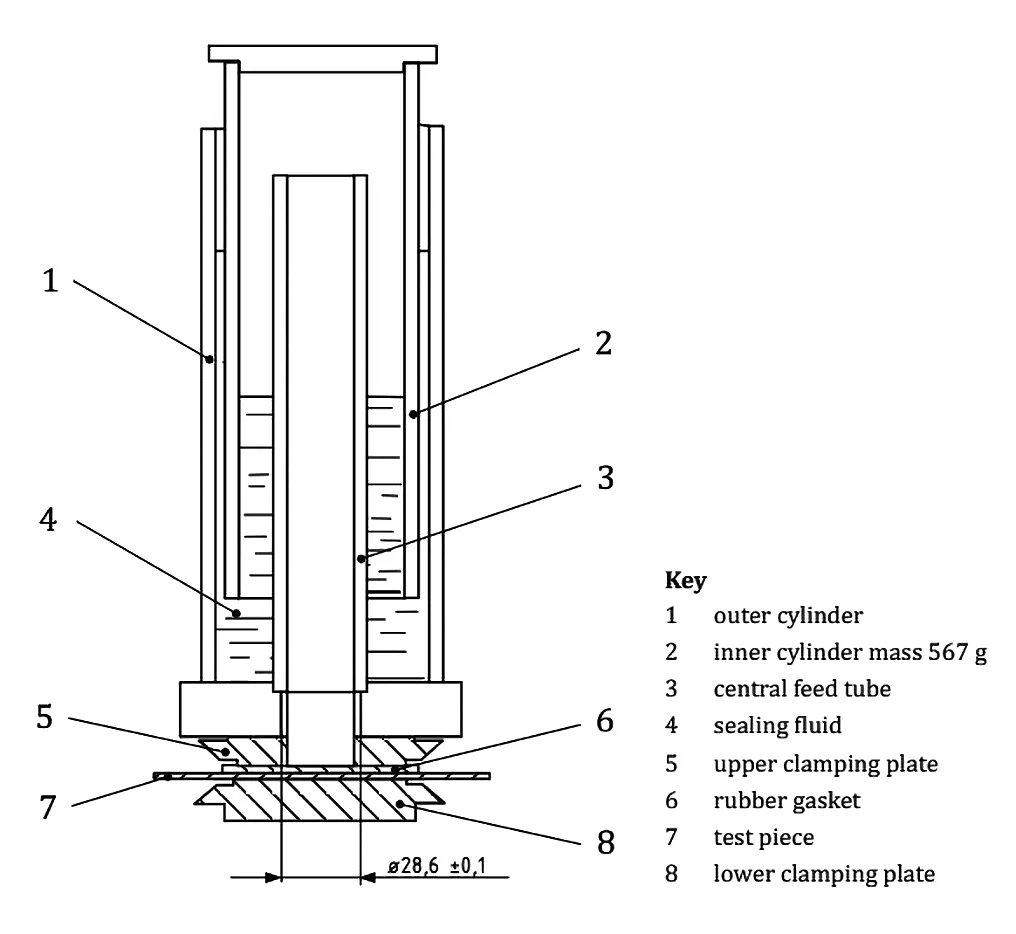
图1.手动透气度测试仪(Gurley)的结构简图

图2.自动葛尔莱法透气度测试仪
《消毒技术规范》(卫生部2002年版)中出了另一验证包装不透性的试验方法,即包装材料不透气性试验(染色渗透试验),该方法为定性测试,其方法是用一块吸收有1%苋菜红水溶液的海绵与测试样接触2min,通过检查试样反面接触的吸收纸的沾染颜料情况来判断是否为不透性材料。
两种方法各有优劣,仪器测试法更加精确,且对于透性材料可以得出透气度有利于制造商根据产品需求选择合适的材料,但由于其灵敏度高,想要证实其为不透性材料,在试验前,除了要保证材料没有皱折、针孔、污渍、均匀外,还需要材料本身具有一定的抗压能力才可保证材料在经至少1h的恒定压力下,允许低于1mm液体压强或10Pa的气压通过;而染色渗透法操作简单便捷,却灵敏度低,漏检率较高。证实了材料是不透性材料后,就意味着满足微生物屏障要求。
2.透气性材料的微生物屏障特性评价
由于医疗器械的形式多样,其透气性包装材料的品种也琳琅满目,因此目前尚无通用的证实各种不同材料微生物屏障特性的方法。ISO 11607-1在经2006年、2014年及2019年的这几版的标准年代更新及修订后,仅ASTM F1608、DIN 58953-6、ASTM F2101和SS876 0019这四个评价透气材料微生物屏障性能的标准方法保留至今,而ASTM F2638及BS 6256为微生物屏障性能的物理替代方法。标准明确指出,经确认的物理试验方法,只要与经确认过的微生物挑战法有对应关系,其所得的数据也可用于确定微生物屏障特性[1]。
方法一,ASTM F1608-16透气包装材料的微生物分等试验标准方法(试验箱法)。此方法是将透气材料样品置于试验箱内,使其经受萎缩芽孢杆菌(ATCC 9372)芽孢气溶胶的攻击,试验样品的芽孢通过分析滤膜收集并计数,最后比较穿透试验样品的芽孢数量对数与最初挑战芽孢数量对数,包装材料微生物屏障能力用Log降低值(LRV)表示[4]。该方法是较通用的一种方法,可以将市售的大部分透气包装材料在同一试验条件下进行分级,以便于比较材料的相对好坏[5]。缺点是该测试周期较长,且试验相对繁琐,还需要经过芽孢的转移和稀释,最终会导致菌落计数的误差,且该方法中所依赖的设备要求相当高,不仅需要提供稳定、等量和规定粒径的芽孢数去攻击试验样品,且需要有很好的生物安全防护设备以防止气溶胶外溢的危害发生(见图3)。他的结果只是一个分级或者是芽孢截留率,而并非合格与不合格,这会让很多制造商在进行选材时存在疑惑。在《消毒技术规范》(卫生部2002年版)对医疗用品分为低、中、高危险性物品。其中,低危险性物品2级微生物屏障即可满足要求,中危险性物品2.5级微生物屏障可满足要求,高危险性物品要3级以上微生物屏障,植介入类产品应采用4级以上为好。一般要求最低的无菌医疗器械使用的包装材料的微生物屏障分级应在2.5级以上。

图3.微生物分等试验仪的试验箱
方法二,DIN58953-6:2016透气包装材料在湿性和干性条件下的微生物屏障试验标准方法。该方法的在湿性条件下,是指将金黄色葡萄球菌(ATCC 6538)菌悬液滴加到试验样品上,液滴干燥后,将未接触菌液一侧与特定的培养基接触,经微生物培养后,测定是否有微生物穿透到试验样品的另一面。若穿透的菌落数少于规定数量则该试样的微生物屏障性能良好(见图4)[6]。在干性条件下,是将试验样品密封于微生物屏障装置中,里面的空气进行反复“加热-冷却”循环5次,使试验样品两面之间形成压力差,包装材料上的萎缩芽孢杆菌(ATCC 9372)芽孢的染菌石英粉,会随着试验样品孔径的热胀冷缩,通过空气流穿过试验样品,收集到特定的培养基上,通过对穿透的菌落数进行计数来评价其微生物屏障性能(见图5)。通过本实验室日常检测包材样品发现,穿透后的菌落通常成片生长,不合格试样培养结果的菌落数通常难以精确计数。该方法同ASTM F1608方法相比,虽然同为微生物方法,但是此操作相对简单许多,不需要复杂的操作设备,试验条件要求相对较低,成本合理,且标准给出了合格与不合格的判断标准,因此这一方法也是目前制造商在进行微生物屏障性能评价时较为青睐的方法。需要强调的是,在湿性条件下,由于受湿度影响,对于本身就不耐湿、克重不够、纤维简单较简单的包装材料来说,属于加严条件下试验,相较干法而言,更容易出现试验样品阳性情况。因此建议制造商可以根据自己材料本身特点及实际运输、存储和使用中可能出现的临床风险,合理的选择测试条件,规避风险。
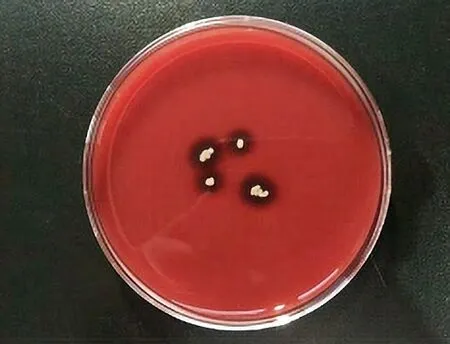
图4 .DIN 58953-6:2016的阳性结果(在湿性条件下)

图5.DIN 58953-6:2016的阳性结果(在干性条件下)
方法三,ASTM F2101-19用金黄色葡萄球菌气溶胶评估医用口罩材料的细菌过滤效率的标准方法,该方法的原理是将样品置于六级冲撞式采样仪与雾化室之间,使用金黄色葡萄球菌悬液(ATCC 6538)这一临床上的主要感染源经雾化后进入喷雾室,六级冲撞式采样仪将气溶胶吸入医用面罩材料,并使用6个琼脂平板收集穿透过材料的气溶胶。空白对照组将不放样品而直接测得雾化产生气溶胶的浓度,通过微生物分析,试验样品组平板与空白对照组平板的菌落数比值为该测试样品的细菌过滤效率(见图6)[7]。该测试方法主要适用于手术衣、手术巾、口罩材料等的微生物屏障性能的评价,该方法操作相对ASTM F1608省去了稀释计数的步骤,从而也避免了菌落数量的遗失,且由于该试验方法里的测试条件都是基于临床,如气溶胶流经样品的流速设定为28.3L/min,正是基于人体正常呼吸速率以及六级冲撞式采样仪的流速。但其对气溶胶发生设备的要求较高,标准里明确指出细菌气溶胶的平均颗粒直径(MPS)应为(3.0±0.3)mm,细菌气溶胶分布的几何标准差应不超过1.5。此项技术也是目前设备制造商的攻克难题。

图6.细菌过滤效率(BFE)试验仪的试验箱
方法四,SS 876 0019保健、纺织品的阻湿态细菌渗透标准方法。此标准为瑞典标准,且已被废除,现行的是ISO 22610:2018用于患者、医护人员、医疗设备用手术铺单、手术服和清洁空气服阻湿态细菌渗透标准方法。该方法目的是用于测定材料在经受机械摩擦时,试验材料对液体携带细菌穿透的屏障特性。其试验原理是将试验样品放于琼脂板上,菌片(染菌面向下)放于试验样品上面,再盖上一片高密度聚乙烯(HDPE)膜,将三层材料卡在一起,并施加一定的力,使试验样品与琼脂接触。外部施加的力通过外向轮驱动的旋转杆在15min内以能在整个培养皿表面上移动的方式作用于材料。最后采用微生物计数法,以累计的形式估测试验样品上面的细菌污染情况,以表征材料的屏障性能和总时间内的穿透性[8]。该方法的技术难点在于测试环境的监测,包括制备菌片过程、干燥过程、试验过程中都需要进行监测环境中的沉降菌,防止环境污染给试验带来的影响或试验过程给环境带来的生物危害,以及菌片的制作,这一技术对实验员的操作技能和环境的防护要求都非常严格,且目前没有市售的这一型号菌片。
方法五,ASTM F2638-18该方法是用直径1.0mm聚苯乙烯小球代替细菌芽孢形成气溶胶测量透气材料的过滤效率。把试验样品放入持样器,带有悬浮微粒的气溶胶以一定的流速攻击试验样品表面,激光微粒计数器分别记录穿透过试验样品后的气溶胶微粒数和初始挑战的气溶胶微粒数。穿透率即用两者的比值来计算(见图7)。在本试验所用一系列压差下,样品两侧的压差与通过材料的气流流量成正比,可获得一个典型的过滤效率曲线(即穿透率与气流流量关系图),最大的穿透率和其对应的流量可通过曲线的峰值来确定[9]。通过找到的最大穿透率来确定其微生物屏障性能。由于在测试过程中没有使用细菌芽孢,因而无需灭菌、接种或培养等一系列微生物操作过程,可以在任何地方进行实验,提高测试效率,且这种物理测试方法可根据试验样品具体的临床预期用途模拟不同的配送周期和处理条件。但是此方法不适用于评估本特森法测得的透气阻力高于400mL/min的最大渗透点的材料,且目前国内仅有几家实验室具备该方法的能力[10]。

图7.微生物屏障测试仪(气溶胶过滤法)的双粒子计数器结构简图
3.小结
随着医疗器械行业的迅猛发生,最终灭菌医疗包装系统的形式也层出不穷,因此对检测行业的要求也越来越高,需要实验人员能够紧跟技术潮流,熟知各种无菌屏障系统的特性,根据制造商需求、临床预期用途、运输和存储等各个流通环节,选择其最适合的微生物屏障性能的检测方法。

