国际牙科学标准体系及其转化应用的研究分析与借鉴
周良彬 陈淑贞 裴晓辉 袁秦 计雄飞
1 广东省医疗器械质量监督检验所 (广东 广州 510663)
2 中国医疗器械行业协会 (北京 100022)
3 国家市场监督管理总局国家标准技术审评中心 (北京 100088)
内容提要:对国际牙科学标准体系及其在欧美日等国家地区的转化应用情况进行汇总整理和对比分析,探讨各国国际标准化接轨和自身标准体系建设的工作思路,为我国提升标准化开放程度的相关工作提供参考。
2021年10月,国务院印发了《国家标准化发展纲要》[1],其中明确提出到2025年的标准化发展目标,其中明确要显著增强标准化开放程度,深入拓展标准化国际合作,使我国标准制定透明度和国际化环境持续优化,国家标准与国际标准关键技术指标的一致性程度大幅提升,国际标准转化率达到85%以上,在提升标准化对外开放水平方面,提出了深化标准化交流合作、强化贸易便利化标准支撑、推动国内国际标准化协同发展的具体发展思路。在我国大力提升标准化开放水平的政策背景下,针对国际标准体系以及各国转化应用情况进行整理分析,有助于借鉴其他国家标准体系建立思路,为我国标准体系与国际标准接轨的相关工作提供参考资料和研究素材。本文以牙科学标准体系为题材,在整理分析国际标准组织标准体系的基础上,进一步探讨欧盟、法国、德国、美国、日本的标准转化、制定和应用情况,这些国家地区在该领域标准化和监管工作方面经长期实践积累了较为丰富的经验,对我国标准化工作具有较高的参考价值。
1.国际标准组织(ISO)及其标准体系
1.1 组织构架
国际标准组织(International Organization for Standardization,ISO)的牙科学方面的标准技术委员会为ISO/TC 106 Dentistry(以下简称,ISO/TC 106)。和其他ISO技委会一样,该技委会的结构层级为技委会(Technical Committee,TC)下设分技委SC(Subcommittee,SC),分技委下设工作组(Working Group,WG)。TC/SC/WG的成员联络、项目跟进协调、会议组织等日常工作由秘书处负责,这些秘书处通常由代表各个成员国的国家标准化组织承担。ISO/TC106 Dentistry的具体SC和WG名称及秘书处详见表1,这些分技委和工作组涵盖了牙科学的各个细分领域,其中大部分为医疗器械,同时也包含了一些非医疗器械产品,如SC7的日常用的口腔护理产品等[2,3]。
如表1所示,ISO/TC 106各级组织秘书处共设有64个,承担工作的各国标准化工作组织有(由多到少排列):美国国家标准学会(American National Standards,Institute,ANSI),22个秘书处;德国标准化学会(Deutsches Institut für Normung,DIN),18个秘书处;日本産業標準調査会,日本工业标准委员会(Japanese Industrial Standards Committee,JISC),8个秘书处;法国标准化协会(Association Francaise de Normalisation,AFNOR),5个秘书处;韩国技术标准局(Korean Agency for Technology and Standards,KATS),4个秘书处;加拿大标准委员会(Standards Council of Canada,SCC),3个秘书处;标准挪威(Standards Norway,SN),比利时标准化局(Bureau de Normalisation,NBN),英国标准协会(British Standards Institution,BSI),巴西技术标准协会(Associação Brasileira de Normas Técnicas,ABNT),各1个秘书处。
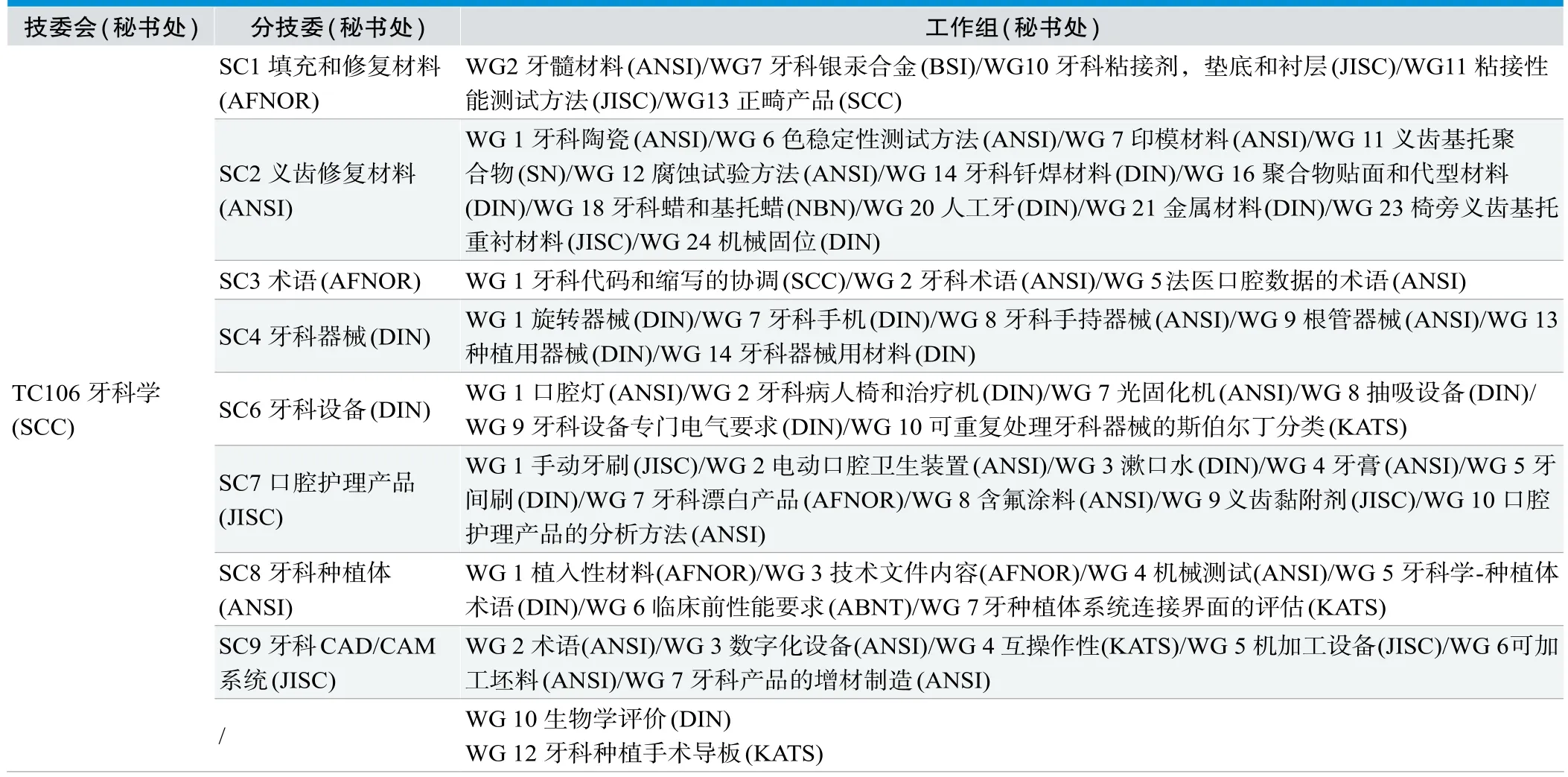
表1.ISO/TC106 Dentistry组织构架
1.2 标准概况
统计ISO/TC 106及其各个分技委的标准数量,可以看出SC4牙科器械类产品的标准数量明显多于其他分技委,占整个TC106标准数的41%[2]。这是因为该类产品种类繁多且历史悠久,在牙医行业出现之初就出于临床需求开发出了一系列口腔专用的手术器械,且由于应用情景和设计思路的差异,其种类数量相当大,与之形成对比的是SC8牙科种植体和SC9牙科CAD/CAM系统类产品,作为近年行业新技术发展的产物,能够形成行业共识进而制定标准的内容相对较少,或相关标准项目尚在研制中,因此发布的标准数量较少。
通过对ISO在欧盟、法国、德国、美国、日本的转化情况进行统计,可以分析ISO/TC 106在这些国家地区的转化应用情况[4-8]。如表2所示,ISO/TC 106各个分技委标准的平均被转化率由高到低依次为,SC2≈SC7≈SC6>SC1≈SC4>SC8>SC9>SC3,可见在所统计的几个标准系统中,义齿修复材料、口腔护理产品、牙科设备领域的标准较为协调一致,和ISO标准体系接轨程度较高,充填修复材料、牙科器械领域应用面相对略窄,在牙科种植体、牙科CAD/CAM系统、术语领域,各个标准系统的转化情况差异较大,整体来说和ISO接轨程度略低。

表2.ISO/TC 106标准发布和转化情况
2.欧盟标准体系
2.1 欧盟标准体系
2.1.1 基本情况
欧盟负责牙科标准化工作的对口组织为CEN/TC 55 Dentistry,其工作范围为:适用于牙科学所有分支中使用的材料、仪器、器具和设备的术语、测试方法和规范的标准化[4]。该技委会下设两个WG:CEN/TC 55/WG 3 Classification(分类)和CEN/TC 55/WG 7 Steering Committee(指导委员会)。WG3专门负责制定并维护牙科器械的分类指南(CEN/TR 12401:2009)这一标准,WG7负责其他牙科学EN标准的制修订。CEN/TC 55成员有AFNOR、DIN、BSI、NBN等34个国家标准组织。CEN/TC 55官网上,正式发布的标准文件共有181份,来自ISO的175份,自主制定6份[4]。
2.1.2 ISO/TC 106标准的转化
EN转化ISO标准通常都是等同转化,在所转ISO标准号前直接加EN形成欧盟标准号(前缀为EN ISO)。EN所转化ISO标准都是目前最新版本,而且基本上都是当年转化(转化时间小于一年)。ISO/TC 106发布的186个标准文件中,未成为EN标准的,一共17个,主要为TR或TS文件(有14个)。EN的标准体系与ISO保持了基本一致。
2.1.3 自主标准的制订
目前CEN/TC 55发布的自主标准文件共计6份,如表3所示,前4份分别为器械、设备、材料、牙科种植体方面的协调标准(见2.1.4),另外两份为牙科器械的分类指南和技工室处理甲基丙烯酸酯类材料的指南[4]。

表3.CEN/TC 55自主标准
CEN/TR12401:2009是与原有欧盟医疗器械监管基础法规指令93/42/EEC相适应的,目前该指令已经被法规EU 2017/745所替代,因此CEN/TR 12401也在修订中,作为新法规下牙科器械类产品管理分类指导文件,这也是目前CEN/TC 55唯一一份起草中的自主制定标准文件。
由此可见,欧盟的EN标准体系基本上都转自ISO标准体系,没有自行制定的产品标准,自主标准的制定主要是为了衔接标准体系与法规要求。
2.1.4 标准的应用
协调标准是根据欧盟委员会和欧洲自由贸易协会授权CEN、CENELEC等标准组织制定的,其目的是提供一个符合相关医疗器械法规基本要求的途径。当在欧盟官方公报上根据该指令引用了相应协调标准,并至少在一个成员国中作为国家标准实施,则在标准适用范围内符合协调标准中指定条款要求,就可以认为已满足了对应的法规基本要求(对应关系列通常列于标准附录Z)。
协调标准是以自愿采用为原则的,制造商、其他经济运营商或合格评定机构可以使用协调标准来证明产品、服务或流程符合相关的欧盟法规。
应用于牙科医疗器械的欧盟标准,设计上分为三个层级:1级:医疗器械通用要求;2级:某类牙科医疗器械的要求;3级:牙科医疗器械特定种类的具体要求。
目前,没有专门针对牙科医疗器械编写的1级标准。某类牙科医疗器械方面的协调标准一共有四份(上表序号1~4),分别针对牙科的器械、设备、材料、牙科植入物类医疗器械在符合欧盟医疗器械指令93/42/EEC相关基本要求方面明确了要求。现有的四个协调标准是适用于某类牙科医疗器械的2级标准。3级标准则在适用的情况下,于协调标准中被规范性引用并列明,以涵盖特定种类产品的所有具体要求。
四份协调标准里面规范性引用文件共148份次(四份标准里面引用的标准有重复,此处以份次代表标准被引用情况),其中129份次来自ISO,98份次标准来自ISO/TC 106,非ISO来源的标准中EN自主起草13份,IEC来源6份,所引用的非ISO/TC 106来源标准,主要是一些通用的基础标准,如EN ISO 14155-1,Clinical investigation of medical devices for human subjects —Part 1: General requirements[9-12]。其监管中使用的标准,来自转化ISO/TC106的EN ISO标准占大部分,这些标准主要是针对特定种类的具体产品标准(上文所说的3级标准)。
协调标准规范性引用3级标准中,ISO/TC 106来源的欧盟EN标准共81份。未被引用的ISO/TC 106标准共105份,其中协调标准制定时(2009年及以前)就存在的标准仅37份,68份为协调标准制定后(2010及以后)才首次制定的ISO标准[2]。考虑到协调标准制定时间较早,且是针对医疗器械指令93/42/EEC制定,而ISO/TC 106或EN标准体系中部分产品并不是医疗器械,例如SC4的部分技工室产品或SC7的口腔护理产品,因此整体而言,上述数据表明协调标准覆盖的医疗器械标准范围是相当广泛的。
2.2 法国标准体系
2.2.1 基本情况
法国国家层面的牙科学对口标准组织为AFNOR,具体负责为其下设的S91X Médecine bucco-dentaire,未下设工作组,共有成员40人,来自各公司(如SEPTODONT)和社会团体(如ADF—ASSOCIATION DENTAIRE FRANCAISE)等。S91X负责标准化领域为牙科器械(Médecine Bucco-Dentaire),对口ISO/TC 106和CEN/TC 55,具体负责的工作包括参与CEN和ISO相关会议、标准项目管理等,标准项目包括牙科学中的生物相容性、CAD/CAM系统等内容[12]。该领域适用的欧盟监管法规为医疗器械指令93/43/EEC(新修订为EU2017/745)。其制定的标准经AFNOR批准成为法国国家标准之后,在标准号以NF前缀予以标识,如转化来源于其他标准组织的标准(如EN或ISO),则通常在原标准号前加NF形成法国国家标准的标准号。
目前AFNOR所发布标准共196份,ISO来源183份(含171份EN ISO标准(除了EN转ISO/TC 106的169份标准,还有一份非ISO/TC 106的EN ISO和一份已作废的EN ISO标准),直接转化自ISO的标准11份),EN自主来源标准6份(见表3),自主制定7份[5]。这些标准中,大部分标准会同时提供法语和英语版本,但7份自主标准在内的少部分标准仅提供法语版本。
2.2.2 ISO/TC 106标准的转化
AFNOR在转化EN ISO标准的基础上,还直接转化ISO标准,转化率比EN略高。大部分所转化为最新版本(175份),极少数转化为旧版本(5份)。包含四份协调标准在内的EN的六份自主标准(见表3)也都已予以转化。
转化一致性程度基本上均为等同,所转化标准都是最新版本的ISO标准,基本上都是当年转化(转化时间小于一年)。ISO/TC 106发布的186个标准文件中,未成为NF标准的,一共6个,主要为TR或TS文件(有5个)。NF的标准体系与ISO和EN基本保持了一致。
2.2.3 自主标准的制定
自主制定标准都是早期标准(见表4),可见近年来S91X的标准化工作思路主要是参与和跟进国际标准体系,并较好地与之保持了协调一致[5]。

表4.S91X自主标准
2.2.4 标准的应用
四份欧盟协调标准均已转化为NF标准,作为产品符合相关监管法规的指引和参考[5]。
整体而言,法国作为欧盟成员国,已采用欧盟指令93/42/EEC作为其医疗器械监管要求,且已转化了欧盟的协调标准和相关EN标准,因此其标准应用情况也与欧盟保持了基本一致。
2.3 德国标准体系
2.3.1 基本情况
代表德国参与ISO/TC 106的标准组织为DIN,具体对口的技委会为其下设的德国牙科标委会(DIN Standards Committee Dentistry,NADENT,编号NA 014,NA014),由其负责牙科领域所有的标准化活动,该标委会由制造商、研发者、使用者、公共部门构成[3]。其制定的标准经DIN批准成为德国国家标准之后,在标准号以DIN前缀予以标识,如转化来源于其他标准组织的标准(如EN或ISO),则通常在原标准号前加DIN形成德国国家标准的标准号。
NA014下设16个技委会(Committee),根据各自工作领域细分,部分技委会设置了分技委(Sub-Committee,共计29个),NA014官网上标明了其技委会和分技委与CEN/TC55、ISO/TC 106的各个工作组的对口关系。
NA014所发布的现行标准共188份,其中来自ISO的标准172份(EN ISO标准167份,直接转化自ISO的标准5份),转化EN自主标准6份(见EN自主标准表),DIN自主制定标准10份。这些标准中,部分标准提供德语和英语两个语种版本,但10份自主标准在内的少部分标准仅提供德语版本。
2.3.2 ISO/TC 106标准的转化
和AFNOR情况类似,DIN在转化EN ISO标准的基础上,还直接转化ISO标准,因此对ISO/TC 106标准的转化率比EN略高。DIN所转化的ISO/TC 106标准文件共175份,其中大部分均转化的是ISO最新版本(共172份),基本上都是当年转化(转化时间小于一年)。转化一致性程度基本上均为等同转化。包含四份协调标准在内的EN的六份自主标准(见上表)也均已予以转化。
ISO/TC 106发布的186个标准文件中,未成为DIN标准的,一共11个,主要为TR或TS文件(有9个)。DIN的标准体系与ISO和EN基本保持了一致。
2.3.3 自主标准的制定
和法国自主标准都是早期标准不同,DIN自主标准仍有不少近期标准(见表5),不少标准工作走在了ISO的前面,为ISO相关工作提供了参考,如口腔数字观察仪的标准,DIN 19410:2018 Dentistry - Intraoral camera比ISO 23450:2021 Dentistry - Intraoral camera早了三年,ISO/TC 106/SC 4/WG 7开始启动ISO 23450项目时,调研显示成员中仅DIN制定发布了该产品的标[3]准。

表5.NA014自主标准
2.3.4 标准的应用
四份欧盟协调标准均已转化为DIN标准,作为产品符合相关监管法规的指引和参考[3]。
整体而言,德国作为欧盟成员国,已采用欧盟指令93/42/EEC作为其医疗器械监管要求,且已转化了欧盟的协调标准和相关EN标准,因此的标准应用情况也与欧盟保持了基本一致。
3.美国标准体系
3.1 基本情况
ISO/TC 106中代表美国的是ANSI,具体对口的标准组织是美国牙科协会(American Dental Association,ADA),相关标准工作是由ADA完成,经ANSI批准成为美国国家标准。ADA下设两个技委会,即Standards Committee on Dental Products(SCDP)和Standards Committee on Dental Informatics(SCDI)负责具体的标准制修订工作[13]。这两个技委会中又根据工作细分划分成若干的工作组,如SCDI又分为信息交换(7个工作组)、法医牙科信息学(3个工作组)、临床信息学(7个工作组)、知识管理(10个工作组)四个大组27个工作组。ADA制定的标准,其标准号前缀为ADA予以标识,其中经ANSI批准成为国家标准的,则在ADA前再加以ANIS。
ADA标准共186份,来源于ISO的114份,AAMI(Association for the Advancement of Medical Instrumentation,美国医疗器械促进协会)的2份,自主制定70份[7]。
3.2 ISO/TC106标准的转化
ADA整体转化ISO/TC 106情况如表2所示,整体转化率为50%,其中SC3、SC4、SC8、SC9四个分技委标准转化率较低。
114份ISO来源的ADA标准中,IDT转化标准为76份,MOD为38份,比例为2:1。和上述国家转化标准都是一对一的情况不一样,有6份ADA标准都转化了两份ISO标准,如ANSI/ADA 139-2020 Dental Base Polymers修改采用了ISO 20795-1:2013 Dentistry —Base polymers —Part 1: Denture base polymers和ISO 20795-2:2013 Dentistry —Base polymers—Part 2: Orthodontic base polymers两份标准。
所转化的93份ISO/TC 106标准文件中,21份标准文件为旧版本。比较ADA标准发布时间和其转化的ISO标准发布时间,平均时间差约为4年。
3.3 自主标准的制定
ADA自主制定标准共70份,在ISO标准体系的基础上,根据行业需要较大程度上补充了标准体系[7]。
SCDI起草的自主制定标准共40份,主要是关于信息数字化、信息安全、信息交换等方面内容,ADA标准体系中这方面的标准基本上都是自主制定的,因目前ISO/TC 106在牙科信息化方面开展的标准化工作相对较少;SCDP起草的自主标准共30份,针对器械、材料、设备、基础(如术语、命名、程序等)四个方面进一步补充健全标准体系。

表6.JISC部分转化标准对应ISO标准情况
3.4 标准的应用
为在监管工作中提供更为明确的产品质量保障和证明方面的依据和指引,FDA通过对各个标准组织制定的标准进行认可,建立了FDA认可的共识标准数据库。虽然共识标准的使用时自愿的、推荐性的,但其作为经FDA认可的质量证明途径,往往在FDA相关文件中被广泛引用,因此其对于医疗器械监管具有重要技术支持作用。FDA认为,共识标准的使用有助于提高产品质量的可预测性,有助于审评流程化和标准化,提供更清晰的监管预期。
FDA认可共识标准数据库中,认可了包含ANSI、ASTM、ISO、IEC等31个美国国内、国际标准组织的标准,其中共认可ANSI标准则268份,ASTM标准451份,ISO标准531份,IEC标准156份,认可国际标准的幅度较大[14]。被认可的牙科学方面的共识标准共104份,其中直接认可ISO标准54份,认可ADA标准50份,两个标准体系被同步认可的情况有27项(项下ADA标准和ISO标准一致性程度为IDT),单独认可的23项ADA标准中大部分为自主起草(10份)或修改采用ISO标准(9份)。
4.日本标准体系
4.1 基本情况
代表日本参与ISO/TC 106标准化工作的是JISC,具体对口的标准组织是牙科材料器械研究协会(日本歯科材料器械研究協議会,Japan Research Council on Dental Products)[15],后者具体负责关于牙科产品的国际标准化工作,包括组织参与ISO会议、ISO标准投票、组织ISO年会等,具体的标准制修订工作和国际标准化工作的实际开展则通常由日本牙科材料制造商协会(日本歯科材料工業協同組合,Japan Dental Material Manufacturers Association)和日本牙科器械制造商协会(日本歯科器械工業協同組合,Japan Dental Machine Manufacturers Association)组织行业有关方面进行[16,17]。其制定的标准经JISC批准后,标准号前加以JIS前缀予以标识,并由日本标准协会(日本規格協会,Japanese Standards Association,JSA)予以发布。
JSA网站查询齿科相关现行标准共136份,这些标准中转化自国际标准组织的有107份,自行起草的29份[8]。转化的标准来自ISO和IEC,其中ISO为绝大多数,有104份,IEC标准仅3份,主要为牙科射线类产品电气安全方面专标。
4.2 ISO/TC 106标准的转化
日本针对ISO/TC 106系列标准的整体转化率51%,和美国接近。ISO/TC 106各个SC的标准中,JISC未转化SC3和SC9的标准,转化SC7和SC8的标准也较少。
在一致性程度方面,等同转化(IDT)的标准有10份,修改采用的标准有94份,非等效(NEQ)的标准为3份。和欧美多为等同转化不同,JISC修改采用ISO标准的情况较多。整理这些标准对应的JISC标准,对比上述国家一对一转化标准的一般做法,除了存在类似ADA转化一对二的情况,还存在多份标准转化自同一份ISO标准的情况(均为修改采用),以及转化ISO标准草稿的情况(具体情况见表6)[8]。
分析国际标准出版时间和JISC标准出版时间,统计两者时间差,平均时间差约为5年。另一方面,其转化的标准并不全是最新的版本,107份转化标准中,55份JISC标准转化的国际标准为旧版本,52份转化的为最新版本。
4.3 自主标准的制定
JISC自主起草的29份标准均为产品标准,其中器械类产品标准9份,材料类产品标准20份[8]。这些自主起草标准有力地补充了其牙科器械标准体系。
在JSA官网上,有8份自主标准同时提供英文和日文版本。
4.4 标准的应用
作为医疗器械认证依据,日本独立行政法人医药品医疗器械综合机构(Pharmaceuticals and Medical Devices Agency,PMDA)所发布的各个医疗器械认证基准中,引用各种标准作为证明产品质量的技术指引[18]。PMDA网站共998件医疗器械基准,引用标准来自JISC、IEC、ISO和国际无线电干扰特别委员会(International Special Committee on Radio Interference,CISPR)四个标准组织,其中引用JISC标准的基准有973件,引用IEC标准的有62件,引用ISO标准的有70件,CISPR标准的有4件。基准引用的标准大多数为日本本国的JISC标准,所引用的国际标准通常为通用型的电气安全、风险评估、体系方面标准。JISC牙科学标准中被基准引用的共有65份(其中转化自ISO的44份,转化自IEC的4份,自主起草17份),ISO/TC 106标准仅有6份。这些基准所涉及产品的管理类别基本都是Ⅱ类。
5.分析与借鉴
5.1 国际标准工作与思路
通过对国际标准组织ISO以及欧美日等国家地区的牙科学标准体系的信息进行整理分析,对各国基本情况分析总结如下。
5.1.1 标准组织结构
ISO的牙科学技委会ISO/TC 106共总分为三级结构,依次为技委会TC、分技委SC、工作组WG,所负责的标准化领域逐步细分,美国/德国的标准组织结构与此基本类似,欧盟和法国的组织构架相对简单,未多作细分,日本的情况较为复杂,其标准组织部门、国际标准归口部门、具体标准化工作部门均为相对独立的协会,通过项目分工协作的方式完成各自负责的标准化工作。
5.1.2 标准体系概况
总体而言,ISO、CEN、DIN、AFNOR、ADA的牙科学标准数量较为接近,在180~200份范围内,JISC标准数量相对较少,约为前者的2/3。CEN、DIN、AFNOR的标准多直接或间接来源于ISO,占比90%以上;ADA的标准中,来自于ISO的约占60%,自主起草标准约占40%,JISC标准中来自于ISO的标准约占75%,自主标准约占21%。可以这样认为,欧美日的牙科学标准体系基本上都是在参考转化ISO/TC 106标准体系的基础上建立起来的。
5.1.3 国际标准转化
分析欧美日转化ISO/TC 106标准体系的转化情况,可以看出:欧盟(含德法)转化率高(都高于90%),一致性程度高(通常都是IDT),转化周期短(通常小于一年),与ISO标准保持了非常良好的协调一致,双方标准体系互相融合,这是欧盟及德法等欧盟国家长期在ISO标准化工作中积极参与、沟通、协调的结果;和欧盟相比,美日的转化率(均为50%左右)较低,一致性程度较低(都有相对比例标准为MOD),转化周期较长(约为4~5年),美日相较而言,美国IDT标准的数量和比例都高于日本,一致性相对较好。
5.1.4 自主标准制定
与转化标准形成互补的是自主标准的起草,和欧盟(含德法)标准体系基本上为转化标准,只有十份左右的自主标准不同,美日自主标准较多,日本为29份,美国更多达70份。这些自主标准在转化标准的基础上有力地补充健全了本国牙科学标准体系,特别是美国,在ISO/TC 106标准体系框架的基础上,在牙科信息学领域积极开展标准化工作,制定发布了40份标准,在这一细分标准化工作领域树立了较强的领先优势。
5.1.5 标准实施应用
应用方面,各国标准都是自愿采用的,但同时,各国监管者也都在监管实践中以不同方式利用标准的技术支撑作用:欧盟(含德法)主要通过制定协调标准建立起监管法规与标准之间的关联,使标准成为证明产品符合法规基本要求的一个可选的成熟、公认途径;美国以建立认可共识标准数据库的方式,将标准应用于监管实际中,作为一个明确的质量证明途径,以提高监管效率;日本通过在医疗器械认证基准引用标准,将标准作为满足认证要求的技术指引。各国牙科学标准在监管中被引用的比例,欧盟(含德法)约40%~50%,美国约30%,日本约50%。除了引用本国标准之外,美国和日本还直接引用了ISO/TC 106的ISO标准,其中美国多达54份,超出了引用本国标准的数量,日本较少,仅6份。整体来看,在监管实践中,欧盟(含德法)在标准体系与ISO保持高度一致的基础上,基本上都是引用自身标准体系作为法规的技术支撑,日本认证基准所引用的标准,也大部分都是本国标准(其中包含转化标准和自主标准),美国认可的牙科学方面共识标准中,则直接认可了较大占比的ISO/TC 106标准,体现了美国FDA在监管实践中应用标准的思路与上述国家地区有所不同。
综合分析,欧盟(含德法)与ISO标准体系一致性高,一来是语言基础好,英语在这些国家应用基础好;二来是一直以来和ISO保持良好沟通,标准工作思路保持协调一致;三是其参与ISO标准程度较高,一些标准化思路直接通过参与ISO工作体现在ISO标准之中。从这几个方面看,美国的情况实际上是一样的,但一致程度较低,是因为其直接在监管中大量使用ISO标准(同为英语国家,具有直接使用ISO标准的语言基础),其系列自主标准更多的是体现需要自己制定、有别于ISO的标准化思路,以此作为转化标准体系的补充。这两种标准工作思路的区别在于,欧盟建立自己的完整的系统,法律框架上独立完整,可以相对较小程度受ISO修订的影响,而FDA直接认可ISO标准,一来直接利用ISO标准资源,可以减小了标准化工作负担,二来FDA监管对象、市场组成都比较国际化,自身定位也是全球定位、引导全球,两者各有取舍利弊。
5.2 对我国工作的一些思考
分析各国牙科学标准体系,以下内容可以作为我国开展相关工作的借鉴:①标准组织的构建方面,注重细分领域标准工作的专业化,以技委会组织形式为主,与社会团体开展合作,广泛借助行业各方面力量,依靠行业服务行业;②转化接轨国际标准方面,参考借鉴美日转化标准的多元化制定工作思路,切实从行业实际和监管需求出发,灵活制定转化标准制修订工作思路,接轨国际标准体系;③标准体系的建设健全方面,建立以转化标准为主体框架,自主标准为补充的标准体系,参考美日系列自主标准,如美国SCDI制定的系列标准,进一步拓宽我国自主标准的制修订思路;④标准的实施应用方面,除了涉及基本安全的个别强制性标准强制实施之外,在监管实际中选择性地引用推荐性标准,作为产品质量证明的优先选择,可有助于充分利用标准资源,提高监管效率和科学性。特殊情况下,可以考虑直接引用国际标准,以便于应对国际市场的多元化需求。

