不同来源的外泌体对特发性肺纤维化的免疫调节作用
吴佳敏 张炜 张兴 陈麒
【摘要】 特发性肺纤维化(IPF)是一种慢性进行性的间质性肺病,其发病机制目前尚无定论。成纤维细胞直接参与IPF过程的理论已被广泛接受,同时研究认为IPF的形成、发展与炎症、免疫息息相关,主要表现为免疫细胞与成纤维细胞间的相互作用。外泌体是细胞间进行生物信息通信的重要载体,不同细胞来源的外泌体携带着不同的信号因子,可作为免疫细胞与成纤维细胞的桥梁,在IPF的炎症反应和免疫调节中发挥作用,同时外泌体或将成为临床诊断和治疗IPF的重要方法。该文就不同细胞来源的外泌体在IPF中的研究进展进行综述,以了解外泌体作为细胞间信息交流的载体在调节IPF的形成与发展中的作用。
【关键词】 特发性肺纤维化;外泌体;炎症;免疫;成纤维细胞;间质性肺炎
【Abstract】 Idiopathic pulmonary fibrosis (IPF) is a chronic progressive interstitial lung disease. The pathogenesis of IPF remains elusive. The theory that fibroblasts directly participate in the IPF process has been widely accepted. Moreover, studies have demonstrated that the incidence and development of IPF is intimately related to inflammatory and immunity, which is mainly manifested with the interaction between immune cells and fibroblasts. Exosomes are important carriers for biological information communication between cells, and exosomes from different cell sources can carry different signal factors, which serve a bridge between immune cells and fibroblasts, and play a role in the inflammatory response and immune regulation of IPF. Therefore, exosomes may become a vital pattern for clinical diagnosis and treatment of IPF. In this article, research progress on the roles of exosomes from different cell sources in IPF was reviewed, aiming to understand the roles of exosomes, as the carriers of information communication between cells, in regulating the incidence and progression of IPF.
【Key words】 Idiopathic pulmonary fibrosis; Exosome; Inflammatory; immunity; Fibroblast; Interstitial pneumonia
特发性肺纤维化(IPF)是一种慢性进行性的间质性肺病,其主要特点是肺部纤维化、呼吸困难加重、肺功能下降以及病死率高[1]。目前认为IPF的发病机制主要与上皮细胞的反复损伤、异常组织损伤修复导致纤维化和胶原蛋白的积累等相关,研究表明炎症细胞与成纤维细胞间的相互作用可促进IPF的发生与发展[2]。此外,作为信息交流载体的外泌体在IPF过程中的作用越来越受到研究者的关注,其可通过炎症反应或免疫调节传递抑制或促进纤维化的物质来参与IPF的发展。为了解外泌体在调节IPF的形成与发展中的作用机制,本文就不同细胞来源的外泌体在IPF中的研究进展进行综述。
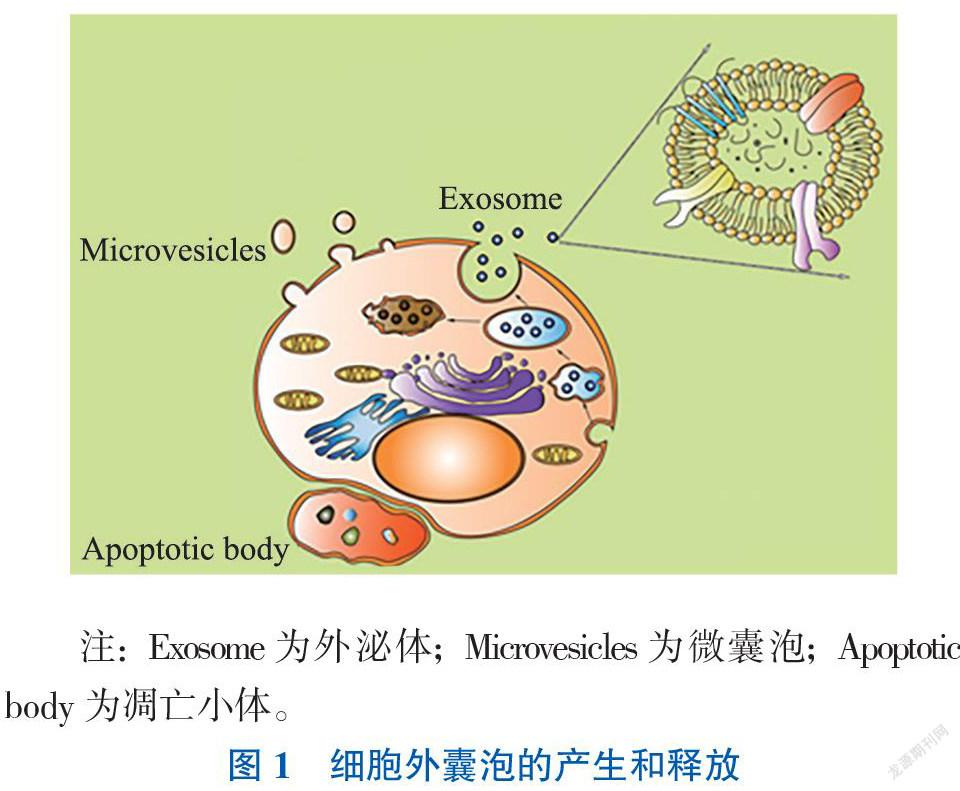
一、外泌体的形成和功能
目前细胞外囊泡根据其生成方式主要分为3大类:外泌体、微囊泡和凋亡小体[3]。其中外泌体是由细胞膜向内生成内吞的囊泡,随后形成囊泡腔,并在囊泡腔中形成体积更小的腔内囊泡,这些囊泡或是在细胞中降解、或是通过胞吐的方式释放于细胞外(图1)[4]。外泌体的膜结构中包含一系列特殊的表面蛋白,如膜转运/融合蛋白、热休克蛋白和四跨膜蛋白等[5]。免疫功能是外泌体所执行功能中的一个重要方面,在不同的病理因素刺激下,細胞产生的外泌体中所携带的物质和执行的功能皆会发生变化,呈现出一定的特异性,就目前的研究而言,这一形成过程的具体机制还有待进一步挖掘。
二、IPF的炎症免疫反应
成纤维细胞参与IPF过程的理论已被广泛接受,由于抗炎药物及免疫抑制剂在IPF治疗过程中疗效欠佳,有研究者认为炎症免疫机制可能并非是导致IPF的直接机制[6]。但也有研究者发现免疫细胞通过与成纤维细胞相互作用从而影响IPF的形成与发展[2]。IPF患者肺部2型辅助性T淋巴细胞(Th2)产生的细胞因子(如IL-4、IL-5和IL-13) 增多,其中IL-4和IL-13可促进巨噬细胞活化,诱导巨噬细胞Fra-2的表达[7]。Fra-2是人类IPF的致病因素之一[8]。另外,炎症因子可刺激成纤维细胞的增殖及胶原蛋白的合成,从而加速IPF的进程[9]。免疫细胞与肺成纤维细胞的作用呈双向性,被激活的纤维细胞可分泌促炎因子(IL-11、IL-6和TGF-β)和趋化因子刺激免疫细胞介导免疫反应[10-11]。炎症细胞与成纤维细胞的相互作用过程中,外泌体作为信号载体,也参与了细胞间的信息交流,从而调节IPF的形成与发展。
三、不同细胞来源的外泌体对IPF的作用
近年来,外泌体在纤维化疾病中的作用越来越受到学者们的重视,通常不同细胞分泌的外泌体携带各种信息,包括炎症因子、微RNA(miR)和基质蛋白等,参与IPF的各个过程。
1. 肺成纤维细胞来源的外泌体对IPF的作用
IPF表现为成纤维细胞样细胞外基质(ECM)的扩展以及正常肺结构和功能的丧失[12]。成纤维细胞转化为肌成纤维及ECM积累是造成IPF的直接因素,而肺成纤维细胞衍生的外泌体可影响肺部其他细胞,从而促进IPF[13]。目前研究显示,激活Wnt蛋白介导的信号通路(如Wnt/β-catenin)也可促进IPF[14]。人肺成纤维细胞来源的外泌体富含Wnt5A,其可诱导肺成纤维细胞增殖[15]。转化生长因子-β(TGF-β)作为关键的纤维化细胞因子,可刺激肺成纤维细胞中Wnt分泌所需的穿梭蛋白G蛋白偶联受体177(GPR177)生成增加,进一步诱导Wnt5A分泌增多。肌成纤维细胞可产生载有TGF-β和Wnt/β-catenin信号分子的外泌体将纤维化信号传至成纤维细胞,诱导其向肌成纤维细胞转化[16]。此外,外泌体还可通过激活Wnt/β-catenin信号通路调节巨噬细胞活化从而促进IPF发生发展[17]。
2. 巨噬细胞来源的外泌体对IPF的作用
巨噬细胞是人体内固有免疫细胞之一,巨噬细胞在IPF过程中的作用受到了广泛关注。一方面,巨噬细胞可分泌多种促进纤维化的细胞因子(如TGF-β和IL-13)[9]。另一方面,其与成纤维细胞的相互作用,被认为是IPF的“调节者”[18]。在急性肺损伤(ALI)过程中,巨噬细胞是肺泡灌洗液中外泌体的重要来源,而外泌体中携带多种促炎因子,其可激活嗜中性粒细胞分泌携带IL-10的外泌体,而IL-10反过来刺激巨噬细胞极化,这可能是导致ALI后纤维化的原因[19]。携带miR是巨噬细胞来源外泌体的另一种重要的作用形式[20]。如富含miR-155的外泌体在巨噬细胞活化后明显增加,而这些外泌体可转移至成纤维细胞中,并促进成纤维细胞表达炎症因子(如IL-1β、IL-6和TNF-α等)[21]。巨噬细胞除了产生炎症因子诱导其他细胞增殖释放基质成分外,还可通过外泌体携带并分泌ECM。有学者用博来霉素建立IPF模型,其中巨噬细胞对于Fra-2和Ⅵ型胶原蛋白(ColⅥ)基因的表达上调,且巨噬细胞来源的外泌体中检测到ColⅥ的3条肽链(α1、α2和α3)[7]。无独有偶,Tsitoura等[22]通过免疫荧光法同样发现胶原蛋白1a主要在肺泡巨噬细胞中过度表达。由此可见,巨噬细胞来源的外泌体可携带趋化因子和炎症因子来募集成纤维细胞及其他炎性细胞,直接刺激成纤维细胞转化为肌成纤维细胞,甚至将胶原蛋白运输至细胞外。
3. 间充质干细胞(MSC)来源的外泌体对IPF的作用
目前IPF的治疗手段有限且预后差,因此学者在寻找更有效的治疗方式时将目光转向MSC移植[23]。MSC是一类具有自我更新和多向分化潜能的多能干细胞,具有减少胶原蛋白等的沉积,改善IPF的程度,降低肺部炎症指标等作用,并被应用于IPF的治疗[24-25]。现有研究表明,在IPF过程中,MSC可通过抑制Smad-3 /TGF-β介导的信号通路,下调炎症因子(TNF-α、IL-6)的表达来发挥抗炎作用[26]。MSC的具体作用机制被认为主要是细胞外囊泡(包括外泌体)的旁分泌[27]。目前研究表明,MSC可以分泌具有免疫活性的外泌体,并通过外泌体调节肺巨噬细胞表型,促炎性经典活化巨噬细胞受到抑制,而与之相互拮抗的替代性活化巨噬细胞得到激活,进而起到抑制肺部炎症和免疫反应的作用[23]。Mansouri等[28]研究也发现在博来霉素诱导的IPF模型中,MSC来源的外泌体(MEx)可使促炎性經典单核细胞比例减少,而非经典单核细胞比例增加,改善肺部形态,减少胶原蛋白沉积并恢复肺部结构,甚至MEx可直接干预骨髓来源的单核细胞向非经典单核细胞转变。目前多项体内、体外研究的数据均表明MSC可通过抑制促炎途径和上调抗炎途径来预防和治疗IPF,MSC在IPF患者的治疗中也表现出正面作用[29]。因此,MSC有望成为IPF患者安全有效的治疗方式之一。
4. 其他来源的外泌体对IPF的作用
肌成纤维细胞一直是IPF研究的关键点,周细胞是肌成纤维细胞的主要来源之一[30]。周细胞是存在于体内血管化组织中的多能细胞,参与免疫应答的调节。在炎性细胞因子的刺激下,周细胞可分泌大量趋化因子和细胞因子并将免疫细胞吸引至炎症部位,还可促进免疫细胞的跨内皮迁移[31]。在肺纤维的临床或实验研究中,肺微血管内皮细胞来源的外泌体中,miR-107均下调,并与周细胞诱导的纤维化相关[32]。另有学者在IPF模型小鼠的支气管-肺泡灌洗液中分离出含有let-7d的外泌体,可直接靶向和抑制TGF-β受体1,发挥其调节肺周细胞纤维化相关信号通路和基因表达的作用[33]。
四、小 结
体内大多数细胞均可产生外泌体,且可从各种体液中分离获得。外泌体被广泛认为是各种生理病理情况下细胞间信息传递的重要载体。在IPF过程中,根据不同细胞来源,外泌体可携带促进或者抑制肺纤维形成的物质,发挥截然相反的作用,这一功能尤其表现在免疫细胞之间或者其他细胞与免疫细胞之间。但是目前对于外泌体的研究并不局限于此,最新研究表明吸入肺干细胞来源的外泌体可促进IPF小鼠的肺修复[34]。随着对IPF研究的深入,外泌体或将成为临床治疗IPF的重要途径。
参 考 文 献
[1] Martinez F J, Lederer D J. Focus on idiopathic pulmonary fibrosis: advancing approaches to diagnosis, prognosis, and treatment. Chest, 2018, 154(4): 978-979.
[2] Heukels P, Moor C C, von der Thüsen J H, et al. Inflammation and immunity in IPF pathogenesis and treatment. Respir Med, 2019, 147: 79-91.
[3] 邊素艳, 刘宏斌. 细胞外囊泡的分离及鉴定方法. 新医学, 2019, 50(9): 658-662.
[4] Hessvik N P, Llorente A. Current knowledge on exosome biogenesis and release. Cell Mol Life Sci, 2018, 75(2): 193-208.
[5] Perez-Hernandez D, Gutiérrez-Vázquez C, Jorge I, et al. The intracellular interactome of tetraspanin-enriched microdomains reveals their function as sorting machineries toward exosomes. J Biol Chem, 2013, 288(17): 11649-11661.
[6] Ayed K, Serairi Beji R, Jameleddine S. Idiopathic pulmonary fibrosis: pathophysiological data. Tunis Med, 2017, 95(8/9): 756-766.
[7] Ucero A C, Bakiri L, Roediger B, et al. Fra-2-expressing macrophages promote lung fibrosis in mice. J Clin Invest, 2019, 129(8): 3293-3309.
[8] Eferl R, Hasselblatt P, Rath M, et al. Development of pulmonary fibrosis through a pathway involving the transcription factor Fra-2/AP-1. Proc Natl Acad Sci USA, 2008, 105(30): 10525-10530.
[9] Li D, Guabiraba R, Besnard A G, et al. IL-33 promotes ST2-dependent lung fibrosis by the induction of alternatively activated macrophages and innate lymphoid cells in mice. J Allergy Clin Immunol, 2014, 134(6): 1422-1432.
[10] Ng B, Dong J, Viswanathan S, et al. Fibroblast-specific IL-11 signaling drives chronic inflammation in murine fibrotic lung disease. FASEB J, 2020, 34(9): 11802-11815.
[11] Fernando M R, Giembycz M A, McKay D M. Bidirectional crosstalk via IL-6, PGE2 and PGD2 between murine myofibroblasts and alternatively activated macrophages enhances anti-inflammatory phenotype in both cells. Br J Pharmacol, 2016, 173(5): 899-912.
[12] Chanda D, Otoupalova E, Smith S R, et al. Developmental pathways in the pathogenesis of lung fibrosis. Mol Aspects Med, 2019, 65: 56-69.
[13] Kadota T, Yoshioka Y, Fujita Y, et al. Extracellular vesicles from fibroblasts induce epithelial-cell senescence in pulmonary fibrosis. Am J Respir Cell Mol Biol, 2020, 63(5): 623-636.
[14] Shi J, Li F, Luo M, et al. Distinct roles of Wnt/β-catenin signaling in the pathogenesis of chronic obstructive pulmonary disease and idiopathic pulmonary fibrosis. Mediators Inflamm, 2017, 2017: 3520581.
[15] Martin-Medina A, Lehmann M, Burgy O, et al. Increased extracellular vesicles mediate Wnt5A signaling in idiopathic pulmonary fibrosis. Am J Respir Crit Care Med, 2018, 198 (12): 1527-1538.
[16] van de Vlekkert D, Demmers J, Nguyen X X, et al. Excessive exosome release is the pathogenic pathway linking a lysosomal deficiency to generalized fibrosis. Sci Adv, 2019, 5(7): eaav3270.
[17] Feng Y, Ren J, Gui Y, et al. Wnt/β-catenin-promoted macrophage alternative activation contributes to kidney fibrosis. J Am Soc Nephrol, 2018, 29(1): 182-193.
[18] Hough K P, Chanda D, Duncan S R, et al. Exosomes in immunoregulation of chronic lung diseases. Allergy, 2017, 72(4): 534-544.
[19] Ye C, Li H, Bao M, et al. Alveolar macrophage - derived exosomes modulate severity and outcome of acute lung injury. Aging, 2020, 12(7): 6120-6128.
[20] Guiot J, Cambier M, Boeckx A, et al. Macrophage-derived exosomes attenuate fibrosis in airway epithelial cells through delivery of antifibrotic miR-142-3p. Thorax, 2020, 75(10): 870-881.
[21] Wang C, Zhang C, Liu L, et al. Macrophage-derived mir-155-containing exosomes suppress fibroblast proliferation and promote fibroblast inflammation during cardiac injury. Mol Ther, 2017, 25(1): 192-204.
[22] Tsitoura E, Wells A U, Karagiannis K, et al. miR-185/Akt and miR-29a/collagen 1a pathways are activated in IPF BAL cells. Oncotarget, 2016, 7(46): 74569-74581.
[23] Willis G R, Fernandez-Gonzalez A, Anastas J, et al. Mesenchymal stromal cell exosomes ameliorate experimental bronchopulmonary dysplasia and restore lung function through macrophage immunomodulation. Am J Respir Crit Care Med, 2018, 197 (1): 104-116.
[24] 郭春, 叶小康. 间充质干细胞胞外囊泡的研究及应用进展. 中国现代医学杂志, 2021, 31(6): 79-84.
[25] Zhang B, Yin Y, Lai R C, et al. Mesenchymal stem cells secrete immunologically active exosomes. Stem Cells Dev, 2014, 23(11): 1233-1244.
[26] Gad E S, Salama A A A, El-Shafie M F, et al. The anti-fibrotic and anti-inflammatory potential of bone marrow-derived mesenchymal stem cells and nintedanib in bleomycin-induced lung fibrosis in rats. Inflammation, 2020, 43(1): 123-134.
[27] Toh W S, Lai R C, Zhang B, et al. MSC exosome works through a protein-based mechanism of action. Biochem Soc Trans, 2018, 46(4): 843-853.
[28] Mansouri N, Willis G R, Fernandez-Gonzalez A, et al. Mesenchymal stromal cell exosomes prevent and revert experimental pulmonary fibrosis through modulation of monocyte phenotypes. JCI Insight, 2019, 4(21): e128060.
[29] Glassberg M K, Minkiewicz J, Toonkel R L, et al. Allogeneic human mesenchymal stem cells in patients with idiopathic pulmonary fibrosis via intravenous delivery (AETHER): a phase I safety clinical trial. Chest, 2017, 151(5): 971-981.
[30] Yamaguchi M, Hirai S, Tanaka Y, et al. Pericyte-myofibroblast transition in the human lung. Biochem Biophys Res Commun, 2020, 528(2): 269-275.
[31] Proebstl D, Voisin M B, Woodfin A, et al. Pericytes support neutrophil subendothelial cell crawling and breaching of venular walls in vivo. J Exp Med, 2012, 209(6): 1219-1234.
[32] Navarro R, Compte M, Álvarez-Vallina L, et al. Immune regulation by pericytes: modulating innate and adaptive immunity. Front Immunol, 2016, 7: 480.
[33] Xie H, Gao Y M, Zhang Y C, et al. Low let-7d exosomes from pulmonary vascular endothelial cells drive lung pericyte fibrosis through the TGFβRI/FoxM1/Smad/β-catenin pathway. J Cell Mol Med, 2020, 24(23): 13913-13926.
[34] Dinh P U C, Paudel D, Brochu H, et al. Inhalation of lung spheroid cell secretome and exosomes promotes lung repair in pulmonary fibrosis. Nat Commun, 2020, 11(1): 1064.
(收稿日期:2021-09-07)
(本文編辑:林燕薇)

