干旱胁迫下甜玉米对施氮的生长生理响应
李永靖



摘 要 为揭示氮元素对干旱胁迫下甜玉米的影响机制,以甜玉米为试验材料,分析了不同土壤水分条件(田间持水量为50%、65%、80%)下施氮对甜玉米生长生理的影响。结果表明:施加0.3‰尿素能有效改善轻度干旱胁迫(65%田间持水量)下甜玉米的生长状况,且脯氨酸与可溶性糖含量增加,过氧化物酶(POD)、过氧化氢酶(CAT)、超氧化物歧化酶(SOD)活性上升。初步认为,在干旱胁迫程度较轻的情况下,通过施加氮素能提升甜玉米的抗旱性。
关键词 抗旱栽培;甜玉米;氮肥;生长生理
中图分类号:S513 文献标志码:A DOI:10.19415/j.cnki.1673-890x.2022.07.021
玉米作为我国重要的粮食作物与工业原料,在我国农业经济建设与粮食安全保障中发挥着重要作用[1]。玉米生长发育过程中需要大量的水分,然而我國多个玉米主产区水资源匮乏,加上落后的灌溉条件、旱灾等影响,玉米产量不高[2-3]。甜玉米作为两广地区的一种主要农作物,其需水量极大,土壤水分条件对其产量与质量的影响显著[4]。氮元素是作物生长发育中的关键营养元素,玉米需氮量大,以往研究证明施氮能有效提升玉米的生长量[5],然而在干旱条件下施氮能否改善甜玉米的生长情况,以及其生理响应机制目前仍不明确。本试验以市售的广东省优良甜玉米品种为材料,研究不同土壤水分条件下,通过施氮与未施氮处理,甜玉米生长量、渗透调节物质及膜系统保护酶活性的变化,探究干旱胁迫下施氮对甜玉米生长生理的影响。
1 材料与方法
1.1 试验材料
甜玉米品种粤甜10号。
1.2 试验方法
试验采用盆栽的方法在防雨塑料大棚内进行。供试土壤为红壤,pH值5.2,有机质含量为12.3 g·kg-1,有效磷含量为3.2 mg·kg-1,速效钾含量为24.3 mg·kg-1,土壤最大持水量为16.8%。
将甜玉米播于装有红壤的塑料盆内,待玉米生长到4叶期时开始试验。共设置3个土壤水分和2个施氮处理:土壤水分处理包括W1(田间持水量80%,正常水分条件)、W2(田间持水量65%,轻度干旱胁迫)、W3(田间持水量50%,重度干旱胁迫);施氮处理为N1(CK,未施氮)、N2(0.3‰尿素)。其中,土壤水分控制采用称重法,施氮采用施基肥方式,即装盆时加入0.3‰尿素(1 kg土壤混0.3 g尿素),使用尿素的氮含量为46%。本试验共6个处理,每处理5次重复。待干旱胁迫与施氮处理试验结束后,采用随机取样的方式,进行生长生理指标测定。
1.3 检测指标
1.3.1 生长指标
将各处理植株地上部分经流水冲洗干净后,放入105 ℃烘箱内杀青30 min,然后在80 ℃条件下烘干至恒重,最后在电子天平上称量植株干物质重。
1.3.2 生理指标
过氧化物酶(POD)、过氧化氢酶(CAT)、超氧化物歧化酶(SOD)活性采用王相敏等的方法进行测定[6]。其中SOD活性测定方法略有修改,具体方法为:从低温冰箱中取出贮存的各处理新鲜叶片中,取每处理约0.25 g样于预冷的研钵中,加入5 mL预冷的提取介质[内含1%聚乙烯吡咯烷酮的磷酸缓冲液(50 mmol·L-1,pH=7.8)],在冰浴下研磨成匀浆后移入离心管,于4 ℃、10 000 r·min-1下离心15 min,上清液即为SOD粗酶液。SOD的反应体系:1.5 mL磷酸缓冲液(0.05 mol·L-1,pH=7.8)+0.3 mL甲硫氨酸(13 mmol·L-1)+0.3 mL氮蓝四唑(75 μmol·L-1)+0.3 mL EDTA-Na2(10 μmol·L-1)+0.3 mL核黄素(2.0 μmol·L-1)+0.1 mL粗提取液+0.5 mL水。对照管不加酶液,1.5 mL磷酸缓冲液(0.05 mol·L-1,pH=7.8),其他与上述反应体系相同。样品与对照管均为3次重复,将试管置于光照培养箱内反应20~30 min(要求各试管光照情况一致,反应温度控制在25~35 ℃,根据酶的活性高低适当调整酶的浓度和反应时间)。用U-2900分光光度计在560 nm波长下测定OD值。
[SOD活性=(OD0-ODs)×VT0.5OD0×FW×V1] (1)
式(1)中,SOD活性为每克样品含酶单位数,U·g-1;OD0为光照对照管的光吸收值;ODS为样品管的光吸收值;VT为样液总体积,mL;V1为测定时样品用量,mL;FW为样品鲜重,g。
脯氨酸含量采用磺基水杨酸法测定,可溶性糖含量采用硫酸蒽酮法检测[7-8]。
1.4 数据处理
数据采用SPSS 19.0统计分析软件对数据进行统计、方差分析。其中,3个干旱胁迫处理间的差异性检验采用Duncan新复极差法进行多重比较,2个施氮处理间差异性检验采用t-test(P<0.05)。
2 结果与分析
2.1 生长量变化
干物重是反映植株遭受胁迫伤害最客观、直接的指标。由图1可知,在不同干旱胁迫处理下,甜玉米单株干物重随着胁迫程度加剧而显著减小。其中,与田间持水量为80%的正常土壤水分处理(W1)相比,在田间持水量为65%的轻度干旱胁迫处理(W2)下,单株干物重降低了36.5%,而在田间持水量为50%的重度干旱胁迫处理(W3)下,单株干物重降低了77.6%。从施氮处理结果来看,与未施氮处理相比,正常土壤水分处理(W1)的单株干物重在施氮后并未明显增加,但在轻度和重度干旱胁迫处理(W2、W3)下施氮明显增加了单株干物重;且从3个土壤水分处理在施氮后单株干物重的差异性分析来看,W2与W1处理间单株干物重无显著差异。结果表明,本试验的供氮量水平(以0.3‰的尿素为基肥)能有效改善甜玉米在遭受轻度干旱胁迫时的生长情况。
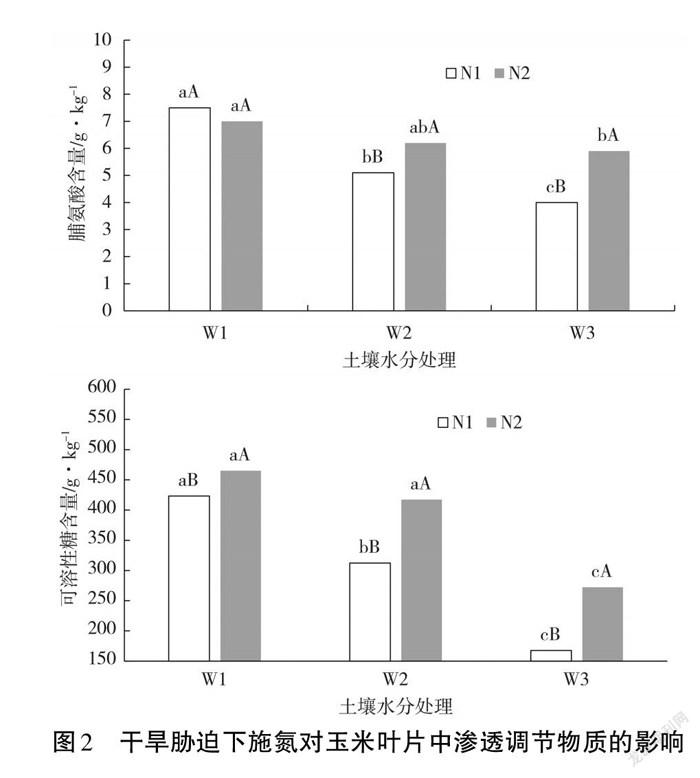
2.2 渗调物质变化
渗透调节物质含量的变化与植株受到的逆境胁迫伤害程度密切相关。通过检测甜玉米叶片中脯氨酸和可溶性糖含量发现,与正常土壤水分处理(W1)相比,干旱胁迫处理(W2、W3)下脯氨酸与可溶性糖含量均显著下降,且随着干旱胁迫程度加剧,叶片中二者含量的下降幅度越大(见图2)。进行施氮处理后,在正常土壤水分条件下,施氮前后脯氨酸含量无明显变化,但在干旱胁迫处理下施氮后脯氨酸含量明显增加,且施氮后轻度干度胁迫处理下叶片脯氨酸含量与正常土壤水分处理无显著差异。
从可溶性糖含量变化来看,受干旱胁迫影响,叶片中可溶性糖含量下降,且胁迫程度越重可溶性糖含量越低。施氮后,3个土壤水分处理叶片中可溶性糖含量均显著增加。这说明与胁迫程度无关,施氮均能有效提升甜玉米叶片中可溶性糖含量,从而反映了甜玉米对氮素的高需求量。但从甜玉米对干旱胁迫的生理响应角度来看,可溶性糖含量的变化不能作为甜玉米遭受干旱胁迫伤害的可靠生理指标。
2.3 保护酶活性变化
超氧化物歧化酶(SOD)、过氧化物酶(POD)、过氧化氢酶(CAT)是公认的反映植株遭受生物或非生物胁迫伤害的重要指标。从表1可以看出,与正常土壤水分处理相比,受到轻度和重度干旱胁迫时,甜玉米叶片中SOD、POD和CAT 3种膜系统保护酶活性均显著降低。进行施氮处理后,正常土壤水分处理下3种酶活性无明显变化,说明本试验中W1处理下植株生长状况正常,未遭受到任何胁迫伤害,满足作为对照处理的要求,本试验处理的设置是科学可靠的。而在轻度干旱胁迫W2处理下,通过施氮叶片中SOD、CAT、POD活性均显著上升,但在重度干旱胁迫W3处理下,施氮处理的POD、CAT活性均高于未施氮处理,而施氮与未施氮处理间SOD活性无明显变化。从施氮后3个土壤水分处理间3种酶活性变化来看,POD和CAT活性大小为W1>W2>W3,SOD活性大小为W2>W1>W3,表明SOD活性变化与植株在干旱胁迫与施氮处理后生长变化情况的高度相似性。这说明,在所检测的3种膜系统保护酶中,SOD灵敏性高于POD、CAT。
3 结论与讨论
干旱作为影响玉米生长发育最主要的逆境胁迫,遭受干旱胁迫时,玉米通过自身的生长生理上变化应对干旱[2-3]。本试验结果证明,干旱能导致供试甜玉米生长量下降,但在轻度干旱胁迫下,通过施用0.3‰尿素能显著改善其生长情况。但考虑到正常水分条件下,施氮与未施氮处理间生长并无差异,说明本试验中供氮水平可能偏低。是否在重度干旱胁迫下,通过增加施氮量(>0.3‰)能提高甜玉米的生长量有待进一步研究。
渗透调节物质是植物为适应逆境胁迫伤害的重要代谢产物,其含量变化是植物对逆境胁迫作出的响应。通常,植物通过在体内增加渗透调节物质能减轻干旱胁迫产生的伤害,但遭受胁迫程度较为严重时,植物将丧失这种自我调节能力[9]。在本研究中,干旱胁迫下甜玉米叶片中脯氨酸与可溶性糖含量均下降,说明50%~65%田间持水量均对甜玉米造成了较为严重的干旱胁迫伤害。相较于可溶性糖,脯氨酸含量变化趋势与植株生长情况变化较为一致,可作为判断甜玉米受干旱胁迫伤害的早期生理指标之一。
在干旱胁迫条件下,植物体内活性氧类物质(ROS)将大量积累,从而破坏细胞膜系统,SOD、POD、CAT等膜系统保护酶活性将增加,减少细胞内ROS含量,维持膜稳定性。因此,SOD、POD、CAT活性变化被视为鉴定植物早期抗旱性的关键指标[9-10]。在供试土壤水分条件下,本试验中甜玉米叶片中3种膜系统保护酶活性显著降低,说明膜系统稳定性已遭到破坏,在65%田间持水量条件下,通过施氮均能提高3种酶活性;但田间持水量仅为50%时,施氮提升了POD、CAT活性,而SOD活性变化不明显。因此,认为以SOD作为判断干旱胁迫下甜玉米膜系统遭受损伤的指标更为可靠。
参考文献:
[1] 吴子恺.玉米抗旱育种[J].玉米科学,1994,2(1):6-9.
[2] 田山君,杨世民,孔凡磊,等.西南地区玉米苗期抗旱品种筛选[J].草业学报,2014,23(1):50-57.
[3] 刘雅楠,曾孟潜.十个玉米推广种抗旱力的分析[J].华北农学报,1995,10(1):45-50.
[4] 李余良,郑锦荣,胡建广,等.广东甜玉米不同品种耐旱性鉴定试验[J].中国农学通报,2007,23(8):171-175.
[5] 朱琳,李玉玺,王寅,等.苗期干旱胁迫下施氮对玉米氮素吸收和土壤生物化学性质的影响[J].水土保持学报,2021,35(4):267-274.
[6] 王相敏,曹丽茹,鲁晓民.脱落酸对干旱胁迫下玉米幼苗生长和生理生化特性的影响[J].分子植物育種,2021,19(21):7193-7201.
[7] COLLINO D J, DARDANELLI J L, SERENO R, et al. Physiological responses of argentine peanut varieties to water stress[J]. Field Crop Research, 2011, 70(3): 177-184.
[8] YEMM E W, WILLIS A J. The estimation of carbohydrates in plant extracts by anthrone[J]. Biochemical Journal, 1954, 57(3): 508-514.
[9] 李广敏,唐连顺,商振清,等.渗透胁迫对玉米幼苗保护酶系统的影响及其与抗旱性的关系[J].河北农业大学学报,1994(2):1-5.
[10] 郭金生,鲁晓民,曹丽茹,等.不同生育时期干旱胁迫下玉米自交系生理指标与产量的关系及抗旱性评价[J].河南农业科学,2018,47(11):24-30.
(责任编辑:刘宁宁 丁志祥)

