基于超高效液相色谱-四极杆-静电场轨道阱质谱的结直肠腺瘤患者血清代谢组学研究
杨 宝,梁运啸,黄宗声,涂 星,周昌园,胡泽华,文德鉴,张淇淞
(1.湖北民族大学 医学部,湖北 恩施 445000;2.广西大学 医学院,广西 南宁 530004;3.广西壮族自治区人民医院 消化内科,广西 南宁 530021;4.湖北民族大学 化学与环境工程学院,湖北 恩施 445000;5.湖北民族大学 武陵山中药材检验检测中心,湖北 恩施 445000)
结直肠癌是一种常见的消化系统恶性肿瘤,是癌症导致死亡的第二大原因[1]。随着生活水平的提高和饮食习惯的改变,结直肠癌在我国的发病率和死亡率呈逐年上升趋势,且较多患者在确诊时已处于中晚期,错过了最佳的治疗时间[1]。结直肠癌主要由“腺瘤-癌”途径发展而来[2]。结直肠腺瘤发展成结直肠癌一般需要较长时间,大多数结直肠腺瘤的治愈率较高且预后良好[2]。因此,筛查结直肠腺瘤是降低结直肠癌死亡率的有效途径。目前临床上常用的“金标准”是结肠镜检,虽然准确度高,但患者对这种侵入性检查的依从性差,且早期诊断较为困难,限制了其在筛查中的广泛应用。相比较而言,单次采血检测肿瘤标志物具有简便和依从性好的优势,尤其是目前多种高灵敏度检测技术的出现,促进了血液肿瘤标志物在早期筛查中的广泛应用。
检测内源性代谢物的水平能够快速和准确地反映机体的状态,目前已证实了肿瘤与机体异常代谢密切相关[3]。代谢组学是从整体和多角度研究机体的内源性代谢变化,阐明疾病发生发展过程的一种高通量技术[3-6]。代谢组学在肿瘤早期筛查中表现出巨大潜力,是近年来的研究热点。基于代谢组学的结直肠腺瘤筛查及诊断具有取样简单、非侵入性、依从性好、灵敏度高的特点,非常适合大规模应用[4,7]。目前,国内外学者主要集中于结直肠癌的代谢标志物研究,而对于结直肠腺瘤的研究比较少[8-10]。本课题组前期从代谢组学方法学角度报道了17 例结直肠腺瘤病人的血清内源性代谢特征[11],但存在病例数少、代谢物检测不全面的问题,尚不能较为全面地表征结直肠腺瘤患者的内源性代谢特征。基于此,本文在扩大样本量的基础上,采用更高灵敏度的超高效液相色谱-四极杆-静电场轨道阱质谱(UHPLC-Q Exactive-Orbitrap HRMS)较为全面地检测了结直肠腺瘤患者的血清内源性代谢物,并采用多元统计方法筛选肿瘤标志物,以期为其早期筛查提供参考。
1 实验部分
1.1 仪器与试剂
UltiMate 3000 超高效液相色谱仪和四极杆-静电场轨道阱质谱(美国赛默飞世尔科技公司);高速冷冻离心机(湖南湘仪实验仪器有限公司);密理博超纯水系统(美国密理博公司);乙腈(色谱纯,德国默克集团有限公司);甲酸(质谱纯,美国赛默飞世尔科技有限公司);D4-脱氧胆酸、他莫昔芬(美国Sigma-Aldrich公司)。
1.2 样本来源及处理
46例结直肠腺瘤患者(年龄57.8±10.7岁)和45例健康人(年龄54.4±8.2岁)血清样本收集于广西壮族自治区人民医院,并经广西壮族自治区人民医院伦理委员会批准(伦理号KY-DZX-202008),所有患者均签署知情同意书。
吸取50 μL室温下解冻的血清样品,加入200 μL预冷却的乙腈,涡旋3 min后于4 ℃下以13 000 r/min离心10 min,吸取全部上清液并真空干燥。用100 μL 75%乙腈-水(含0.5 μmol/L D4-脱氧胆酸和他莫昔芬)复溶,涡旋3 min 后于4 ℃下以13 000 r/min 离心20 min,吸取全部上清液用于血清代谢组学分析。各待测样品吸取5 μL上清液混匀后作为质控样本。
1.3 色谱与质谱条件
色谱条件:Waters Acquity UPLC HSS T3 色谱柱(100 mm×2.1 mm,1.8 μm);流动相:正离子模式为0.1%甲酸乙腈(A)-0.1%甲酸水(B),负离子模式为0.01%甲酸乙腈(A)-0.01%甲酸水(B)。洗脱程序为:0.0~2.0 min,2% A;2.0~13.0 min,2%~100% A;13.0~18.0 min,100% A;18.0~20.0 min,100%~2%A。柱温为40 ℃,流速为0.4 mL/min;进样量为5 μL。
质谱条件:电喷雾离子源,辅助气流速为10 μL/min,鞘气流速为40 μL/min,离子传输管温度为320 ℃,雾化温度为400 ℃,喷雾电压为3.50 kV(正离子)或2.80 kV(负离子);数据采集模式为full scan+ddms2,一级扫描范围为m/z100~1 200,一级和二级质谱的分辨率分别为70 000和17 500。
1.4 质谱数据处理及代谢组学分析
采用Compound Discovery 3.1软件对质谱数据进行峰对齐和归一化处理,得到质荷比、保留时间和峰强度配对的数据文件。将数据文件导入Simca-P 14.0软件中进行主成分分析(PCA),基于质控样本聚合情况考察仪器方法的稳定性,以及样品的分布趋势和异常点;随后进行正交偏最小二乘判别分析(OPLS-DA),采用200 次置换检验考察模型的可靠性和适用性,以变量权重投影值(VIP)大于1.50、火山图中变化倍数小于0.67或大于1.50且p<0.05为标准筛选生物标志物。根据精确分子量、自带数据库(mzCloud)、HMDB 数据库(https://hmdb.ca/)鉴定生物标志物。采用MetaboAnalyst 软件富集代谢通路,应用受试者工作特征曲线(ROC)对生物标志物进行最终筛选与评价。
2 结果与讨论
2.1 血清的典型总离子流图
在前期研究[11]基础上,本实验采用上述方法分析了健康对照和结直肠腺瘤患者的血清样品,典型总离子流图见图1,可见分离度及响应较好。两组的总离子流图存在一定差别,推测在两组中部分血清代谢产物的浓度存在差异。提取健康对照组、结直肠腺瘤组、质控组中D4-脱氧胆酸和他莫昔芬的保留时间和峰面积,计算相对标准偏差(RSD)分别小于3.0%和10%,表明整个测试过程中仪器的稳定性良好。
图1 健康对照组(A、C)和结直肠腺瘤组(B、D)血清样品的总离子流图Fig.1 Total ion chromatograms of serum samples from healthy control(A,C)and colorectal adenoma(B,D)A and B:in positive ion mode;C and D:in negative ion mode
2.2 数据分析
2.2.1 主成分分析 对健康对照组(NG)、结直肠腺瘤组(CAG)、质控组(QC)在正、负离子模式下进行PCA 分析,并考察仪器方法的稳定性和样品的分布趋势。由图2A 和2B 可知,质控样本的聚合情况良好,说明仪器方法的稳定性良好,测试数据准确可靠,满足进一步分析的要求。NG 和CAG 组分别位于得分图两侧,区分较为明显且无异常点,说明健康对照组和结直肠腺瘤组的血清代谢谱有显著差异。
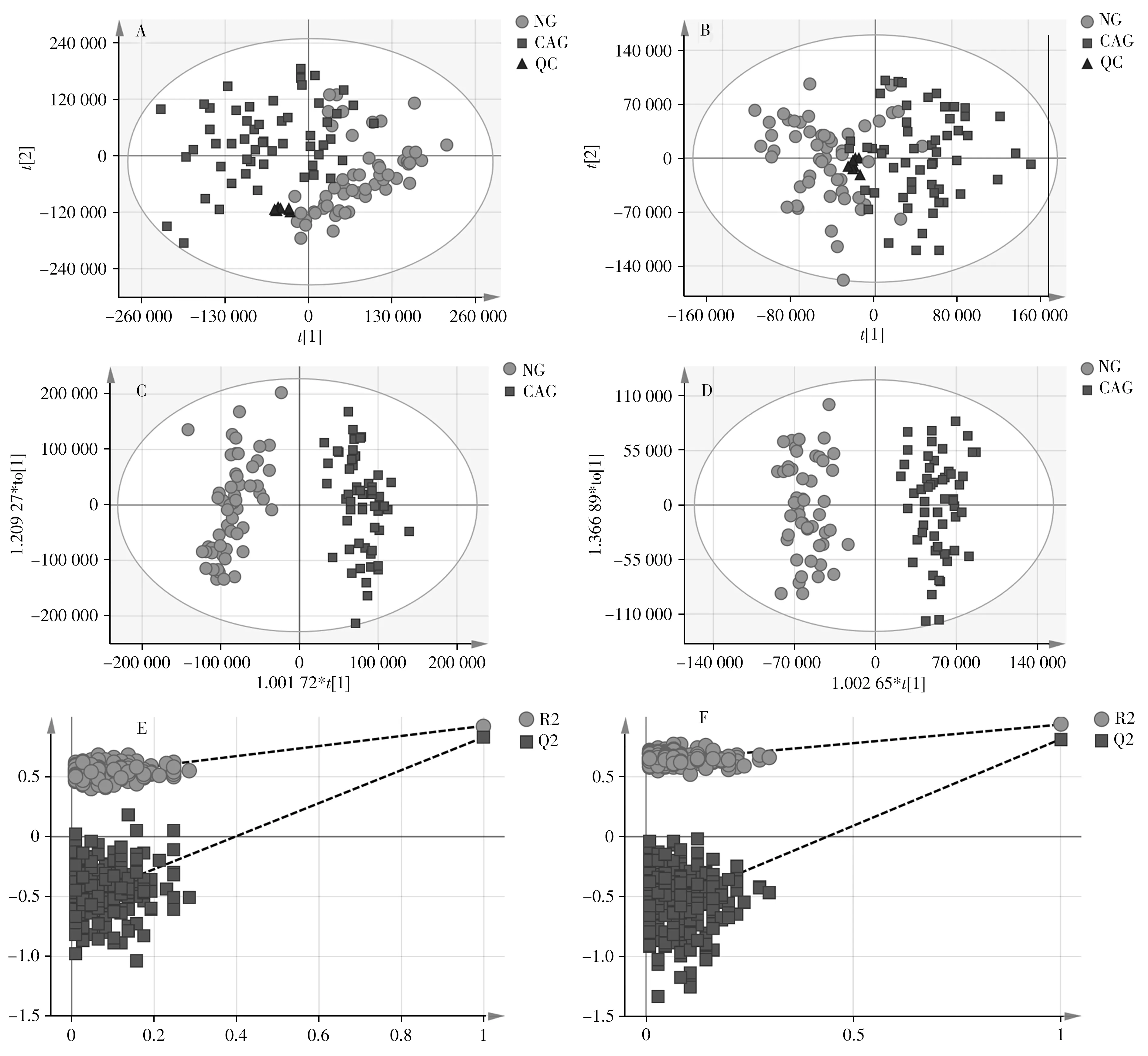
图2 健康对照组(NG)、结直肠腺瘤组(CAG)、质控组(QC)的PCA得分图(A、B),健康对照组和结直肠腺瘤组在正、负离子模式下的OPLS-DA得分图(C、D)及置换检验图(E、F)Fig.2 PCA score plots(A,B)for the NG,CAG and QC groups,OPLS-DA score plots(C,D)and corresponding permutation tests(E,F)between the NG and CAG groups A,C and E:in positive ion mode;B,D and F:in negative ion mode
2.2.2 正交偏最小二乘判别分析在PCA分析的基础上对NG组和CAG组进行OPLS-DA分析,筛选生物标志物。OPLS-DA 得分图见图2C 和2D,NG 组和CAG 组的血清代谢谱差异显著。正离子模式OPLS-DA 模型的R2X、R2Y、Q2 值分别为0.62、0.93、0.83;负离子模式的R2X、R2Y、Q2 值分别为0.55、0.94、0.81,说明所建立模型的数据描述和预测能力良好。正离子模式200 次置换检验(图2E)R2和Q2的截距分别为0.50和-0.55,负离子模式(图2F)的分别为0.63和-0.63,且200次置换检验的R2和Q2值均小于原始值,提示所建立模型的预测能力较好且未过拟合。
2.2.3 生物标志物的筛选与鉴定根据两组间变化倍数和t检验统计值,制作上述标准化质谱数据的火山图(图3),筛选出变化倍数小于0.67 或大于1.50,且p<0.05 的代谢物。在火山图分析的基础上结合VIP值大于1.50确定生物标志物,根据精确分子量、自带数据库、HMDB 数据库鉴定出20个生物标志物,结果见表1。以正离子模式m/z132.076 7(tR= 0.69 min)和负离子模式m/z327.232 3(tR=13.22 min)为例说明生物标志物的鉴定过程(图4),质谱图中横线上侧为实测值,下侧为仪器自带数据库理论值,两者完全一致,2 个生物标志物分别确定为肌酸和二十二碳六烯酸,与标准品的质谱分析结果一致。其他生物标志物采用同法鉴定。生物标志物在2组中相对丰度的热图见图5A。
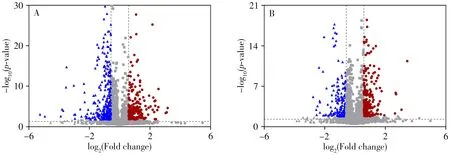
图3 健康对照组和结直肠腺瘤组在正(A)和负(B)离子模式下的火山图Fig.3 Volcano plots of NG and CAG groups in positive(A)and negative(B)modesthe red,blue and gray dots represent that the metabolites are significantly up-regulated,significantly down-regulated,and not significantly changed in CAG group,respectively
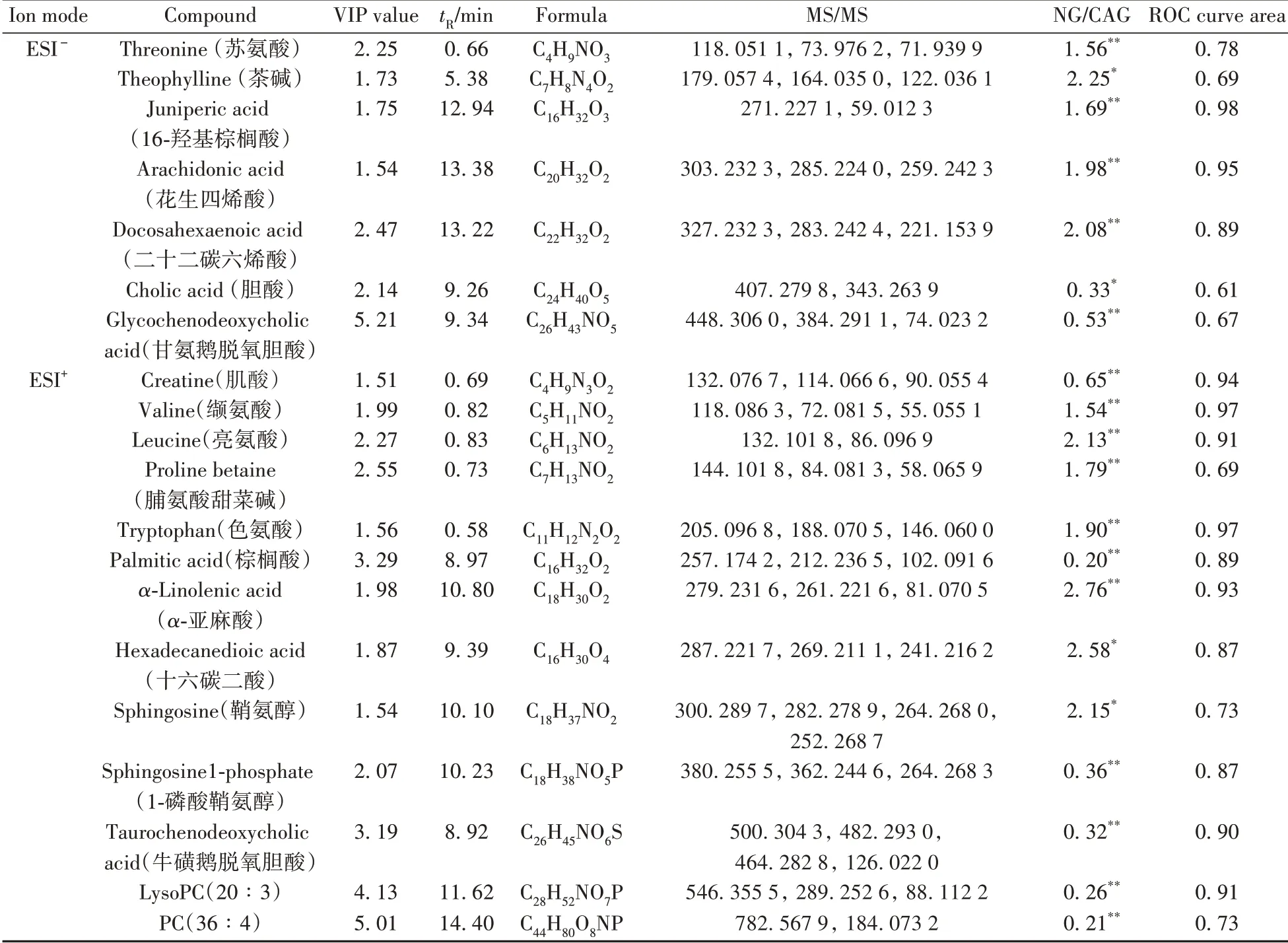
表1 结直肠腺瘤患者的血清生物标志物及ROC分析结果Table 1 Biomarkers identified from patients with colorectal adenoma and the corresponding ROC analysis results
2.3 代谢通路富集及生物标志物分析
采用MetaboAnalyst 4.0 软件富集代谢通路,以影响值大于0.1 为标准确定与结直肠腺瘤相关度最高的代谢通路(见图5B)。结果显示,缬氨酸、亮氨酸和异亮氨酸合成,花生四烯酸代谢、α-亚麻酸代谢、亚油酸代谢、氨酰-tRNA 合成、鞘脂代谢、甘油磷脂代谢以及色氨酸代谢对结直肠腺瘤的影响较大。
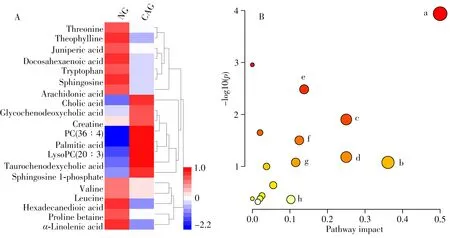
图5 健康对照组和结直肠腺瘤组中生物标志物的相对丰度热图(A)与代谢通路分析图(B)Fig.5 Heat map of 2 groups to visualize the abundance of biomarkers(A)and summary of pathway analysis(B)a:valine,leucine and isoleucine biosynthesis(缬氨酸、亮氨酸和异亮氨酸合成);b:arachidonic acid metabolism(花生四烯酸代谢);c:α-linolenic acid metabolism(α-亚麻酸代谢);d:linoleic acid metabolism(亚油酸代谢);e:aminoacyl-tRNA biosynthesis(氨酰-tRNA合成);f:sphingolipid metabolism(鞘脂代谢);g:glycerophospholipid metabolism(甘油磷脂代谢);h:tryptophan metabolism(色氨酸代谢)
正常和肿瘤细胞均需要大量的必须氨基酸维持基本生命活动,必需氨基酸不仅是合成核酸、蛋白质、脂质等生物大分子的原料,还是激活哺乳动物雷帕霉素靶蛋白(mTOR)通路的信号分子,而mTOR通路的异常激活与肿瘤的发生、发展及转移密切相关[12]。另外,能量代谢异常是肿瘤细胞最显著的特征之一,肿瘤细胞在快速增殖过程中需要大量的氨基酸来提供氮源和碳源维持其异常的能量代谢[12-13]。在本实验中,结直肠腺瘤组血清中苏氨酸、缬氨酸、亮氨酸、色氨酸的水平较健康对照组显著降低,提示肿瘤细胞正处在快速增殖过程中,需要吸收大量的必须氨基酸维持其异常的能量代谢。大量临床实验证实了n-3 多不饱和脂肪酸在促进机体健康和治疗部分疾病方面的特殊功效,与肿瘤细胞的增殖和凋亡以及缓解炎症反应密切相关,且在癌症患者中的水平显著低于健康人[14]。相关研究报道,经常食用富含n-3 多不饱和脂肪酸食物的人群发生结直肠癌的概率明显降低[15]。在本实验中,结直肠腺瘤组血清中二十二碳六烯酸和α-亚麻酸的水平较健康对照组显著降低,与文献报道基本一致。鞘脂是真核细胞膜的主要成分,且能代谢产生多种重要的信号分子,参与细胞生长、分化、凋亡等生理活动。1-磷酸鞘氨醇是由磷酸化的鞘氨醇激酶催化鞘氨醇合成得到,其通过调控炎症反应与癌症的发生发展密切相关[16-17]。在本实验中结直肠腺瘤组血清中鞘氨醇的水平显著降低,1-磷酸鞘氨醇的水平显著升高,提示结直肠腺瘤患者自身大量合成了1-磷酸鞘氨醇,并可能通过调控炎症反应缓解结直肠腺瘤的发展。磷脂是细胞膜结构的重要组成部分,LysoPC(20∶3)和PC(36∶4)在结直肠腺瘤组血清中的水平较健康对照组显著降低,可能是由于肿瘤细胞正处在快速增殖过程中。胆汁酸的种类和水平与结直肠癌密切相关,部分胆汁酸可能通过诱导DNA 和蛋白质损伤以及粘膜细胞增殖和炎症导致结直肠癌的发生[18]。一项569 例结直肠癌病例的前瞻性研究表明,胆酸、甘氨鹅脱氧胆酸、牛磺鹅脱氧胆酸的水平与结直肠癌的发病率显著正相关[18],本实验中结直肠腺瘤组血清中上述3 种胆汁酸的水平显著升高,与文献报道基本一致。
本实验还采用ROC曲线法考察了生物标志物对结直肠腺瘤的诊断效能(表1),结果表明16-羟基棕榈酸、花生四烯酸、肌酸、缬氨酸、亮氨酸、色氨酸、α-亚麻酸、牛磺鹅脱氧胆酸、LysoPC(20∶3)的特异性与灵敏度较高,其ROC 曲线面积(AUC)均大于0.90,对于结直肠腺瘤筛查具有较高的诊断价值,但后期还需采用临床大样本的靶向代谢组学方法进行验证。
3 结 论
筛查结直肠腺瘤是降低结直肠癌发病率和死亡率的有效途径,代谢组学技术在肿瘤早期筛查中表现出巨大潜力。本文利用UHPLC-Q Exactive-Orbitrap HRMS 技术的高通量、高分辨率优势,结合多元统计分析从结直肠腺瘤患者血清中筛选了20 个生物标志物,包括必须氨基酸、不饱和脂肪酸、鞘脂、胆汁酸等。经过ROC 分析,筛选16-羟基棕榈酸、花生四烯酸、肌酸、缬氨酸、亮氨酸、色氨酸、α-亚麻酸、牛磺鹅脱氧胆酸、LysoPC(20∶3)作为区分结直肠腺瘤患者和健康人的生物标志物。本实验为深入研究结直肠腺瘤的代谢特征提供了基础数据,对于结直肠腺瘤的临床筛查具有较高的参考意义。

