术中超声引导脑深部海绵状血管畸形手术的疗效分析
骆 慧,刘 宁,尤永平,王彬彬
南京医科大学第一附属医院神经外科,江苏 南京 210029
脑内海绵状血管畸形是一种常见的脑血管畸形,发病率为0.4%~0.8%[1]。多数患者无明显的临床症状,常于体检时偶然发现[2],通常采取随访观察即可。然而对于表现有头痛、局灶神经功能障碍以及癫痫等临床症状的海绵状血管畸形患者[3],往往需要积极的手术干预。精准定位并在保证脑损伤最小的情况下切除病灶是神经外科微创理念的体现。近年来关于神经导航协助脑深部海绵状血管畸形定位并切除取得良好疗效的报道越来越多[4],但是不可避免术中发生“脑漂移”情况[5]。然而颅脑术中超声则以其动态、实时的特点在一定程度上弥补了神经导航这一不足。本研究回顾性分析了南京医科大学第一附属医院神经外科2014 年1 月—2018年12月收治的45例脑深部海绵状血管畸形病例资料,探讨超声实时引导下深部海绵状血管畸形手术的临床价值,报告如下。
1 对象和方法
1.1 对象
纳入标准:①南京医科大学第一附属医院神经外科2014 年1 月—2018 年12 月收治的经手术病理证实的端脑或者小脑内海绵状血管畸形患者;②单一病灶且边缘距颅骨内板最短距离≥20 mm;③有相应的临床症状;④随访时间>1 年,影像学资料齐全。排除标准:①多发病灶者;②既往有严重系统疾病者;③失随访者。本研究经医院伦理委员会批准,取得患者及其家属的知情同意,并签署同意书。
本研究共纳入45 例患者,其中导航联合超声(超声组)26 例,单独使用神经导航(对照组)19 例。临床症状方面,超声组患者的首发症状为:头晕头痛8例,癫痫发作7例,眩晕行走不稳4例,肢体感觉或运动障碍2例,听力下降、运动性失语、视野缺损、阅读障碍、意识障碍各1 例;对照组的首发症状为:头晕头痛5例,癫痫发作8例,眩晕行走不稳2例,肢体感觉或运动障碍2 例,视野缺损2 例。其他基本资料详见表1。
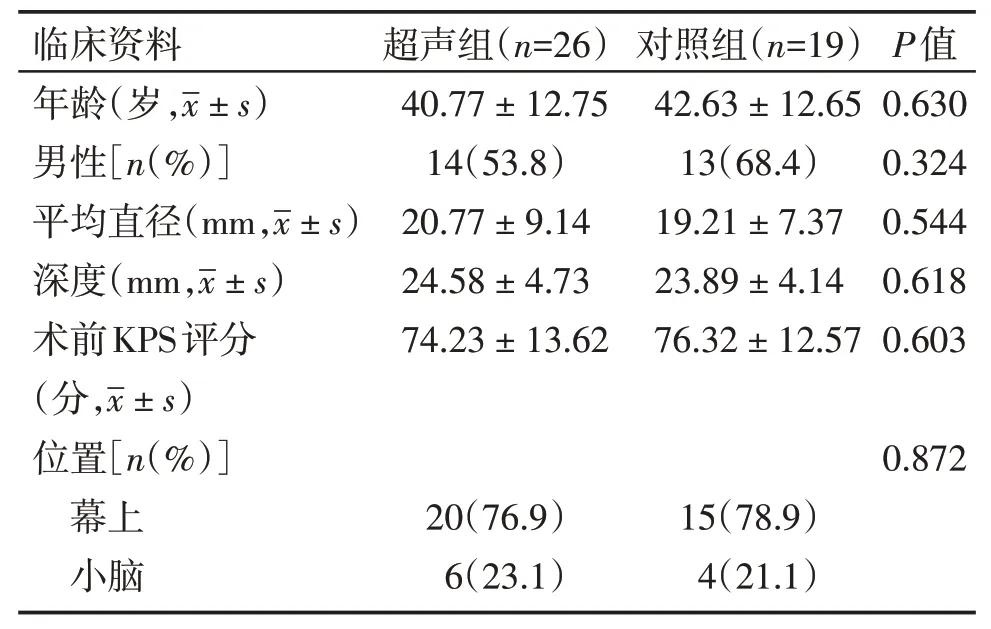
表1 脑深部海绵状血管畸形患者的临床资料Table 1 Clinical data of patients with deep⁃seated cere⁃bra cavemous vascular malformatig
1.2 方法
1.2.1 影像学检查
所有患者入院后常规行头颅CT、MRI 扫描,其中CT 提示超声组和对照组中合并钙化者分别为2例和1例,合并急性或亚急性出血者分别为7例和3例,其中MRA 或CTA 表现均为阴性。MR 的T2WI扫描是诊断海绵状血管瘤较为敏感的手段之一,多表现为“爆米花”样混杂信号,T1WI增强扫描未见病灶本身明显强化,但合并颅内静脉性血管畸形(ce⁃rebral venous malformation,CVM)则会表现为明显强化的放射状细小髓静脉汇入粗大的引流静脉,即呈典型的“海蛇头”或“水母头”样表现。其中超声组有3例合并CVM,1例位于幕上,2例位于小脑,对照组中有1例且位于小脑。
1.2.2 手术方法
全麻完成后,Mayfield 头架固定头部,两组患者均利用美敦力S7神经导航系统进行注册定位,该过程一般在5 min 内即可完成,注册误差在1.2 mm 左右。进一步勾画病灶、中央沟、外侧裂等体表投影,模拟手术径路,个体化设计手术切口。
对照组为全程利用神经导航进行病灶定位,打开骨瓣后根据导航指引进行病变探查,如过程中出现脑组织移位或者寻找未果,则及时引入术中超声进行实时纠偏,具体操作同超声组。
超声组在打开硬膜后,启动ALOKA Prosound SSD⁃α7 彩色超声诊断仪,将无菌超声探头(凸阵探头,型号:UST⁃9133,频率5~10 MHz)紧贴于脑组织表面,按照轴位、冠状位、矢状位标准切位进行连续扫描,探查病变,确认其脑表投影,测量病灶的深度和大小,并重点识别脑沟、脑室、大脑镰、胼胝体等相关参照结构。原则上对于非重要功能区,选择最近的脑沟或者皮层直达病灶,而对于功能区深部病变,则采取“舍近求远”策略,选择远隔的非功能区脑沟或者皮层潜行入路,在超声的实时引导下显露病灶。整个过程中可以借助脑针穿刺形成的通道或者脑棉等强回声材料作为实时参照,提醒术者及时调整手术的方向和角度。
病变的切除过程均在显微镜下进行,除切除海绵状血管畸形团块本身外,还需同时清除其周边含铁血黄素沉积带、钙化以及合并之血肿。此外术者应着重保护病灶周边伴行之粗大引流静脉。病变切除完毕后,在瘤腔缓慢灌注生理盐水作为介质,利用超声再次扫描明确病灶切除情况并排除继发性血肿形成。
1.2.3 术后随访
包括门诊随访和电话随访,随访时间至少1年。术后第1、3、7天分别行头颅CT检查,记录患者术前、术后1 周以及术后3 个月的卡氏功能状态(karnofsky performance status,KPS)评分,手术后3~6个月复查MRI,判断病变有无残留或复发等。指导合并癫痫患者用药,利用Engel 分级评价术后癫痫控制效果。
1.3 统计学方法
采用SPSS 21.0 统计软件对数据进行分析,计量资料以均数±标准差()表示,组间比较采用成组t检验;计数资料用例数(百分率)表示,组间比较采用卡方检验。P<0.05为差异有统计学意义。
2 结果
2.1 病理结果及切除情况
所有患者均经术后病理证实为海绵状血管畸形,术后3个月随访头颅核磁明确病灶得到全切,与术中判断一致。
2.2 超声影像学特征
脑深部海绵状血管畸形以及周围的解剖结构具有典型的超声影像学特征。二维灰阶超声显示病变大小为8~40 mm,深度20~38 mm,与磁共振测量基本一致。病变多呈蜂窝状改变,以高回声或强回声信号为主,与周边组织结构界限比较清晰,部分病灶内部回声欠均匀,2 例合并陈旧性血肿及囊变呈等回声或低回声,5例伴有新鲜血肿呈高回声,2 例合并钙化呈强回声光团,且其中1 例伴典型“彗尾征”,与CT 扫描结果相符。彩色血流相提示病变内部无血流信号或仅可见少许点状血流信号,而3例合并静脉畸形患者可见病变周边明显的彩色血流信号。周围结构如脑沟呈线样高回声,脉络丛呈条索样高回声,正常脑组织为等回声,合并水肿时为等高回声,脑室系统为低回声。病灶切除完毕后,术野灌注生理盐水并扫描,瘤腔呈“雪花征”,瘤壁呈锐利高回声,1例继发深部血肿为高回声,显微镜下予以清除。
2.3 超声引导不同手术入路
超声组定位的准确率为100%,其中经对侧大脑镰下入路1 例(图1),经脑沟入路14 例(图2),经皮层造瘘11例(图3)。对照组中经脑沟入路12例,经皮层造瘘7例,该组有2例出现明显脑移位,通过术中超声扫描及时纠偏,并顺利切除病灶。
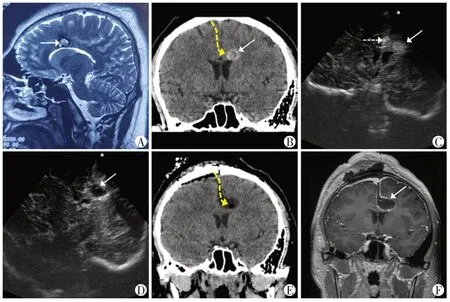
图1 超声引导经对侧大脑镰入路Figure 1 Ultrasound guided contralateral falx approach
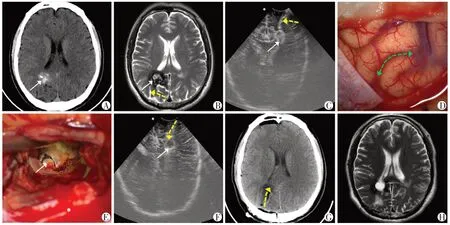
图2 超声引导经脑沟入路Figure 2 Ultrasound guided transsulcus approach

图3 超声引导经皮层入路Figure 3 Ultrasound guided transcortical approach
2.4 两组手术效果对比
超声组在显微镜下操作时间、术后平均住院天数以及术后1 周的KPS 评分方面显著优于对照组;但是在术后3 个月KPS 评分上,超声组和对照组并没有表现出统计学差异,(P>0.05,表2)。
表2 两组术中及术后资料对比Table 2 Comparison of information between two groups during and after operation ()

表2 两组术中及术后资料对比Table 2 Comparison of information between two groups during and after operation ()
2.5 新发神经功能障碍、癫痫控制情况
对照组中有1例患者术后出现短暂的运动性失语,另1例出现一过性肢体肌力下降,经过3个月的康复训练,二者均恢复到术前水平。超声组中有1例术后出现顽固呃逆3 d,1 例术后新发局灶性癫痫,药物控制良好。其余患者神经功能症状均有不同程度好转,继发性癫痫者Engel分级均控制在Ⅰ~Ⅱ级,无严重感染、再出血以及死亡等严重并发症。
3 讨论
脑海绵状血管畸形为先天性脑血管发育异常,由窦样扩张的血管腔构成,占颅内血管畸形的8%~15%[6]。随着核磁共振的普及,尤其是磁敏感(sus⁃ceptibility weighting imaging,SWI)序列的使用[7-8],无症状性海绵状血管畸形检出率越来越高。考虑到此类患者未来脑出血的概率较低且开颅手术本身存在一定的风险,所以大多数学者倾向于随访观察。然而以头晕头痛、癫痫发作、局灶性神经功能障碍为首发症状的症状性海绵状血管畸形则存在反复出血的倾向[9],严重影响患者的生活质量,建议以手术治疗为主。本研究中两组共15 例继发性癫痫患者术后症状均得到有效控制,也进一步佐证了精准的显微外科切除是目前该疾病最有效的治疗手段[10]。
那么,如何实现在脑功能保护的前提下做到病灶的精准定位和切除是神经外科永恒的主题。得益于神经导航这一智能化、无框架的立体定向系统的应用和普及,术者可以通过工作站进行影像学重建,对病灶及周围组织结构进行全方位的了解,并将其用于协助脑深部病变的术中定位。国内学者杜固宏[11]、孟祥辉等[4]早期报道了在神经导航指导下完成的海绵状血管畸形手术治疗的案例,并取得了非常喜人的疗效。但是在我们的临床实践过程中,常发现神经导航存在着系统误差、注册误差以及术中由于释放脑脊液、颅内压变化、脑组织牵拉等多种因素造成的“术中脑漂移”,因此它对脑实质深部的定位时会存在较大偏差。尽管可以通过术中CT或MRI来纠正术中脑组织移位,但是这二者因为造价昂贵、操作过程繁琐、耗时长,所以很难普及。
20 世纪80 年代,超声开始用于术中脑组织扫描,但是受当时超声探头工艺的限制,显示、成像的效果差强人意。随着近年来神经外科专用术中超声系统的不断改良,对于脑内深部病灶的辨识度越来越高,操作简便且可重复性强。因此术中超声技术在临床上广受神经外科医师的青睐,逐步用于指导脑深部病变的手术,成为弥补神经导航脑移位的重要手段。张岩等[12]报道了40 例经神经导航辅助下海绵状血管畸形切除手术,其中有4 例发生了明显的移位,需要术中超声来纠偏。本研究对照组的19 例患者在神经导航辅助下,有2 例术中发生了明显的漂移,寻找病变未果,及时使用超声进行扫描,顺利探查并切除病灶。
要想获得理想的手术效果,必须充分利用好术中超声,笔者总结了以下几点超声使用方面的经验:①首先操作者需要充分了解超声探头的性能特点、常用参数的调节,熟练掌握超声的使用步骤。以上这些需要一段时间的学习和摸索;②其次操作者需要熟练掌握如本文结果部分中所述的颅脑术中超声的影像学特征;③患者头位的摆放,需要将手术野尽可能置于最高点,以便在超声探查过程中更好地利用生理盐水作为超声波介质,充填操作路径,达到减轻气体干扰,优化图像质量的目的;④超声扫描时尽可能获得与磁共振轴位、冠状位或者矢状位一致的扫描切面,这样才能更好地匹配磁共振和超声影像,便于解剖结构的描述和理解;⑤详细记录病灶的深度、大小,以及周围的毗邻关系;⑥结合神经导航选择合适的手术径路,包括经对侧大脑镰入路、经脑沟入路和经皮层造瘘入路,原则上要尽可能利用自然间隙,以减少对正常脑组织的牵拉和移位。病变位于重要功能区时可经相对非重要区域潜行抵达病灶,路径需要反复探查扫描,及时纠偏;⑦脑棉、明胶海绵、金属钛夹等超声扫描呈高回声或强回声,可以利用它们作为参照标记物[13],协助术者判断病变的位置;⑧另外一种定位方法就是在超声监测下直接脑针穿刺直达病灶,术者沿穿刺道探查至病灶;⑨术中超声可实时获取影像数据,不存在脑漂移困扰,帮助手术者建立了强大的信心,本研究超声组的定位准确率为100%,减少了探查时间,显著缩短了术者显微镜下的操作时间,同样可以缩短患者的住院周期,有利于患者快速康复;⑩切除病灶完毕后,再次扫描术野可判断病变切除程度,以及排除继发性血肿的形成,进一步增加了手术的安全性。本研究两组患者切除率均为100%,超声组出现1 例瘤周继发性血肿,显微镜下予以彻底清除并严密止血。
除了影像学的正确引导之外,先进的病变切除理念以及娴熟的显微操作同样非常重要。术中一旦抵达病灶边缘,术者可以沿病灶与正常脑组织间黄染的胶质增生带进行分离切除。术中要注意动作轻柔,深部暴露时尽可能地减少脑组织挫伤。对于病变周边的小动脉分支处理需配合低功率电凝并锐性离断,切勿盲目拖拽。此外助手还应保证术野持续冲水,减少热传导损伤。值得一提的是海绵状血管畸形合并静脉血管畸形时的处理,原则上需要尽可能保留,这与有些研究的观点一致14-15]。对照组中有1 例病灶位于额叶深部,在探查时遭遇粗大引流静脉的活动性出血,予明胶海绵压迫止血满意,并生物蛋白胶水封固,而非直接电凝闭塞髓静脉,避免了术后严重脑水肿的发生。
利用神经导航完善手术的规划和设计,结合术中超声对脑组织、病变显示的特点,实时引导术者快速、精准地抵达病灶,能够显著缩手术操作时间、提高手术安全性,有利于患者术后快速康复,减轻其经济负担,符合现代微创神经外科的手术理念,值得推广和普及。

