四环素降解菌的筛选及降解特性研究
康宗利,刘爽,杨建,王新宇,靳雨松,杨玉红
(沈阳农业大学 生物科学技术学院,辽宁 沈阳 110866)
四环素是使用最广泛的抗生素之一[1],不仅大量用于人和动物的疾病治疗,也作为饲料添加剂在畜禽养殖中广泛应用[2-3]。四环素类抗生素在畜禽养殖业中广泛使用会引起药物残留,残留的四环素在环境中降解、迁移,最终会造成水资源和环境的污染,对人类健康带来影响[4]。清除土壤和水体中四环素类抗生素污染,减少其对生态环境和人体健康造成的危害,已成为目前迫切需要解决的问题之一[5]。生物修复技术的出现,为治理环境污染带来了希望[6]。微生物修复技术具有条件简单、容易控制、成本较低、专一性较强、降解彻底、无二次污染等特点,因此成为了现阶段处理抗生素污染的最理想的方法[7]。从90年代开始,微生物降解作为处理环境污染的一种新技术、新方向,在国内得到很好的发展,同时也取得了一些成果[8]。司美茹等[9]在油田的土壤中筛选出一株高效降解原油的菌株,在液体培养基中培养降解率可达到72.6%。李明石等[10]在长期受多菌灵农药污染的土壤中,以不同环境为介质富集筛选,获得1 株耐冷多菌灵高效降解菌,获得的降解菌可在100 mg·L-1的多菌灵中生长。陶美[11]从活性污泥中筛选分离得到了1 株对四环素具有降解能力的克雷伯氏菌(Klebsiella pneumoniae)。赵晨光[12]从新鲜猪粪及堆肥堆体中筛选出4 株四环素类抗生素降解菌:鹑鸡肠球菌、粪肠球菌、库特氏菌、屎肠球菌。从目前的研究成果可以看出,已报道的四环素降解菌种类较少,函需补充新的菌种资源。因此,开展四环素类抗生素污染的微生物修复技术研究,筛选不同类型的四环素类抗生素的高效降解菌株,扩大抗生素降解微生物菌种库是非常必要的。本试验将从长期受四环素类抗生素污染的土壤中,筛选分离出能够以四环素为唯一碳源的降解菌株,并对其生长和降解特性做全面的研究,为处理环境中四环素类抗生素污染的生物方法提供理论和实践依据。
1 材料与方法
1.1 试验土样
采自本溪市某制药厂附近污染场地,采用多点随机采样法取表层土(0~20 cm),采用四分法分别取1000 g 左右的污染土,用无菌袋盛装带回试验室,自然风干,去除土壤中水分,摊开压碎,剔除杂物,过20 目尼龙筛。
1.2 试验方法
1.2.1 四环素抗性菌株的筛选培养基
无机盐培养基:KH2PO4NaCl 0.2 g、(NH4)2SO42.0 g、MgSO4·7H2O 0.2 g、CaCl20.1 g、K2HPO40.5 g、MnSO4·H2O 0.01 g、FeSO4·7H2O 0.01 g、水1000 mL、pH 7.0。
富集培养基:配制四环素终浓度为20、40、60、80、100 mg·L-1的培养基。
筛选培养基:在灭菌无机盐培养基和LB 中加入四素类抗生素、使其抗生素浓度为20、40、80、100 mg·L-1的培养基。
1.2.2 四环素母液配制
在100 mL 灭菌的水中加入四环素药品1 g 溶解,得到浓度10 g·L-1的母液。
1.2.3 菌种的富集培养
称取10 g 土壤,添加到250 mL 的锥形瓶中,加入无菌水100 mL,制成土壤悬液,摇床转速100 r·min-1震荡培养1~2 d。
1.2.4 四环素降解菌的筛选驯化
取5mL 富集培养后的菌悬液接种到100 mL四环素为20 mg·L-1的LB 培养基中,摇床培养5 d,驯化,再取驯化后的菌液5 mL 于100 mL 四环素浓度为40 mg·L-1的LB 培养基中进行5 d 的驯化培养,以此类推直至四环素类抗生素浓度为80 mg·L-1。
1.2.5 四环素降解菌的分离纯化
取1 mL 四环素浓度80 mg·L-1的菌群培养液,加入到9 mL 的无菌水中,采用系列稀释倒平板法,培养、观察、纯化,最后用平板划线法在筛选培养基上进行分离,挑取平板上的纯菌落保存。
1.2.6 降解菌的复筛
分离纯化的单菌落起初是有可能不完全具备四环素的降解能力的,仍然需要进行检测菌株对四环的降解能力,再进一步的进行筛选从而选取最佳的高效的降解菌株,便于进行下一步的研究。在四环素浓度为60 mg·L-1的无机盐培养基中驯化培养,每天取样1次测OD365,并计算其降解率,其降解率按下式计算。

1.2.7 降解菌的四环素耐受能力检测
将菌悬液于离心后,用无菌水稀释104倍,得到最低浓度菌液。吸取降解菌菌悬液各300 μL 涂布 到 四 环 素 浓 度为20、50、100、150、200、250 mg·L-1的固体LB 培养板上,观察培养过程中的菌落情况。
1.2.8 抗性菌株对四环素降解的动力学曲线比较
将四环素抗性菌株分别接种于10 mL 80 mg·L-1的无机盐培养基中,培养后的第1 天开始取样,每天同时间同地点取4 mL 的培养液,测其OD365,计算降解率,其纵坐标为抗性菌株的降解率,取样时间为横坐标,绘制四环素的动力曲线,确定抗性菌株对四环素的最佳降解时间,同时设置空白对照组。
1.2.9 降解菌的形态观察
通过复筛得到具有最佳降解能力的四环素菌株,观察菌落形态,并参照《微生物实验技术》进行革兰氏染色,通过显微镜观察细胞形态等。
1.2.10 降解菌株的分子鉴定
细菌基因组DNA 的提取:采用SDS-CTAB改良法。
细菌基因组PCR 反应条件如表1。

表1 PCR 扩增反应体系Table 1 PCR amplification reaction system
PCR 产物经电泳后,送样测序,测序由北京诺赛基因组研究中心有限公司完成。所得测序结果进行Blast 比对分析,构建系统发育树。
1.2.11 菌株干重标准曲线制作
取活化后的菌悬液离心、洗涤3次后,在紫外分光光度计测定其吸光度,配制得到OD600为0.4、0.6、0.8、1.0、1.2 的菌株悬液,取每种OD 值分别对应的菌株悬液各100 mL,4000 r·min-1离心沉淀后放入烘箱,60 ℃、24 h 烘干后称重,测得OD 值与对应的菌体干重建立坐标,绘制标准曲线。
1.2.12 菌株在四环素培养基上生长曲线的测定
在四环素浓度为80 mg·L-1的无机盐培养基中,接种肠杆菌种子液,放入恒温振荡培养箱中培养,转速180 r·min-1,观察其生长情况。每天取5 mL 的培养液,以无菌水为参比,在OD600下测定吸光度。
1.2.13 不同条件对阴沟肠杆菌去除四环素作用的影响
以基础培养基为对照,对影响发酵的各个条件进行优化,优化每个成分时,将其设成几个浓度,其他成分不变,接种后摇床培养,取未加入阴沟肠杆菌的培养基为空白对照,每24 h 取4 mL 的培养液分别在OD365和OD600测定四环素浓度及细菌生长量。
基 础 培 养 基:(NH4)2SO42.0 g、K2HPO40.5 g、KH2PO4NaCl 0.2 g、MgSO4·7H2O 0.2 g、CaCl20.1 g、MnSO·H2O 0.01 g、FeSO4·7H2O 0.01g、四环 素80 mg,水1000 mL。 不 同 因 素、水 平 见下表。
1.2.14 扫描电镜观察
参考黎昀昀[13]的方法,样品经洗涤、固定、脱水、置换、干燥,于电子显微镜下观察。
2 结果与分析
2.1 四环素抗性菌株的初步分离筛选
经过几周的富集培养、筛选和驯化,可以明显观察到富集液中菌株的生长(图1)。4种菌对四环素表现出很好的抗性,在四环素浓度为80 mg·L-1的培养基上生长良好。

图1 4 株四环素抗性菌株的菌落形态Fig.1 Colony morphology of 4 tetracycline resistant strains
2.2 菌株的复筛结果
对初筛得到的4个菌株进行复筛(图2),可以看出Ly-1507 和Ly-2507 菌株对四环素的去除效果 好 于Ly-3507 和Ly-4507;菌 株Ly-1507、Ly-2507 在以四环素做唯一碳源时去除率分别从最开始 的29.60%、27.35% 到 第7 天 的73.59%、67.47%,降解效果明显。Ly-3507、Ly-4507 的去除率只有53.26、48.64%。说明菌株Ly-1507 和Ly-2507 具有更好的四环素去除能力。

图2 4 株菌株对四环素的去除结果Fig.2 Removal results of tetracycline by 4 strains
2.3 菌株的四环素耐受能力测定结果
所筛菌株在四环素浓度分别为20、50、100、150、200,250 mg·L-1的LB 培养基平板上检测菌株完全被抑制的浓度经2 d 培养观察,结果如表2所示,菌株Ly-1507 在四环素20、50、100、150 mg·L-1浓度下菌落生长快速旺盛,在四环素浓度为250 mg·L-1时才被抑制生长,出现较为明显的菌落数量削减。说明菌株Ly-1507 具有更强的四环素耐受能力,因此本文选择菌株Ly-1507 进行后续研究。

表2 不同条件的因素和水平Tab.2 Factors and levels of different conditions

表3 菌株对不同浓度四环素的耐受结果Table 3 Tolerance results of strains to tetracycline at different concentrations
2.4 菌株Ly-1507 对四环素降解的动力学曲线比较
如图3所示,在试验中发现随着培养时间的延长,四环素抗性菌株对四环素的去除率出现先增大后平稳的趋势。当达到第7 天时,菌株Ly-1507对四环素的降解率为75.85%,7 d 后增长的趋势相对平缓,因此,菌株Ly-1507 的最佳降解时间是为7 d。

图3 抗性菌株对四环素降解的动力学曲线Fig.3 Kinetic curve of tetracycline degradation by resistant strains
2.5 菌株Ly-1507 分子鉴定
2.5.1 菌株Ly-1507 的电泳检测结果
以菌株的基因组DNA为模板,经PCR 扩增后,进行电泳,结果如图5所示,可以看出提取的菌株DNA 的特异性条带,得到1 条1400 bp 左右的基因片段,说明核苷酸序列约为1400 bp。

图4 Ly-1507 菌株电泳图Fig.4 Electrophoretic map of Ly-1507 strain
2.5.2 构建系统发育树和种属分析
经测定所获得的目的片断长1400 bp,序列如图5。

图5 Ly-1507 目的片断基因序列Fig.5 Ly-1507 objective fragment gene sequence
测序后序列在Genbank 中,进行BLAST 程序比对,采用MEGA 软件构建系统发育树(图6)。由图6可以看出,菌株Ly-1507 与阴沟肠杆菌(登录号:KX233847.1)相似度达98%,鉴定菌株Ly-1507为阴沟肠杆菌,命名为阴沟肠杆菌(Entero⁃bacter cloacae)Ly-1057。

图6 菌株Ly-1507 系统进化树Fig.6 phylogenetic tree of strain Ly-1507
2.6 菌株对四环素吸附性能的测定
2.6.1 菌株干重的标准曲线
以吸光度为纵坐标,菌株干重为横坐标绘制菌株干重标准曲线如图所示,菌株Ly-1057 的回归方程为y=8.893 9x+0.009 2,相关系数R2=0.999 3;
2.6.2 菌株Ly-1057 在四环素培养基中生长曲线的测定
当四环素作为唯一的碳源时,阴沟肠杆菌Ly-1057 随时间的生长情况如图8所示。当接种后的第1 天内肠杆菌Ly-1057 生长速率较缓慢,造成这一原因可能是菌株对新的生长环境需要一定的时间去适应。在完成适应周期后,2~7 d 便开始大量代谢繁殖且菌株干重增长较为迅速,处于对数期,当第8 天菌体进入稳定期,生物量趋于平缓;8 d后,生物量基本保持不变,进入衰亡期。可以认为前7 d 是四环素的最佳降解时间和菌株生长的最佳时间。

图7 菌株Ly-1057 生物量的标准曲线Fig.7 Standard curve of dry weight of myceliu
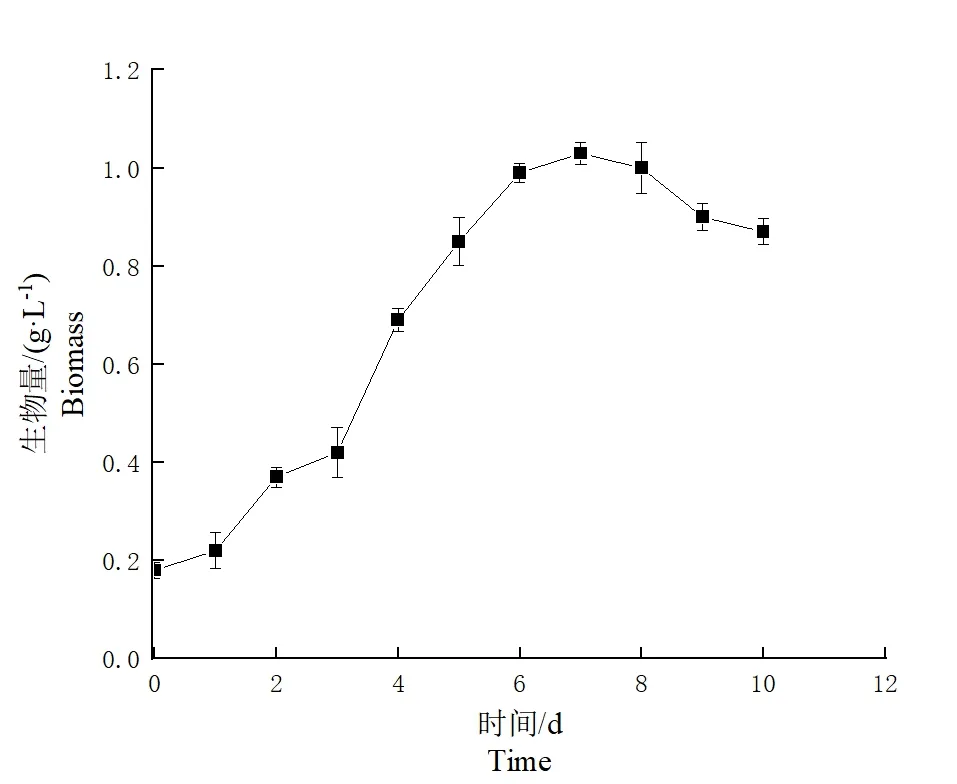
图8 菌株Ly-1057 的生长曲线Fig.8 Growth curve of strain Ly-1057
2.6.3 不同pH 条件对菌株Ly-1057 去除四环素作用的影响
pH 值是微生物降解四环素的重要环节之一,在参与降解酶的活性和菌株的稳定性发挥着重要的作用。pH 也会影响细胞膜蛋白及胞外水解酶的活性,从而影响营养物质的正常吸收和运转[14]。由图9可知,当pH 值为4~7 时,菌株对四环素的去除率和生物量均随着pH 值的增加而上升,且当培养基初始的pH 值为7.0 时对四环素的去除效果较好,在7 d 时达到了最大值75.53%。当pH 值为8.0 时、生物量和四环素去除率均出现下降趋势。这表明酸性和碱性条件都会影响菌株的稳定性或者影响菌株降解酶的活性。
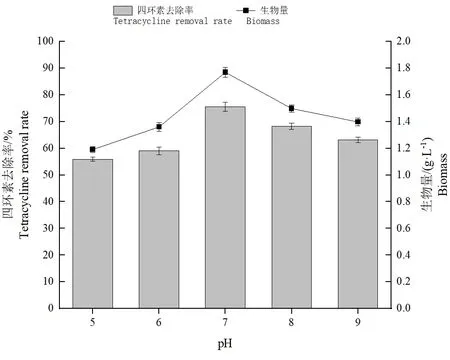
图9 不同的pH 条件对菌株Ly-1057 去除四环素作用的影响Fig.9 Effects of different pH conditions on tetracycline removal by Strain Ly-1057
2.6.4 不同接种量对菌株Ly-1057 去除四环素作用的影响
由图10可知,随着接种量的逐渐增加,菌株干重也呈现增加的趋势,菌种的去除率也随之增加。3%的接种量时,四环素的去除效果最好,去除率为75.32%,生物量为1.297 g·L-1。阴沟肠杆菌Ly-1057 对四环素的去除率和生物量的增长呈现先增大后减小的趋势,当接种量为4%,菌株对四环素的去除率为70.07%,生物量为1.26 g·L-1。随着接种量的增加反而生物量也是有所下降,这种情况的出现可能是由于培养基中的碳源、氮源或其它因素导致的,接种量取决于四环素的种类和菌体的性质,菌体的自身的能力强,接种量就较少,最佳接种浓度为3%。

图10 不同接种量对菌株Ly-1057 去除四环素作用的影响Fig.10 Effects of different inoculum amount on tetracycline removal by STRAIN Ly-1057
2.6.5 不同底物浓度对菌株Ly-1057 去除四环素作用的影响
由图11可知,不同的初始底物浓度对四环素菌株生长的影响,当无机盐培养基中底物浓度为80 mg·L-1时,四环素降解率达到最大,7 d 后的去除率为68.63%,在80 mg·L-1的底物浓度下生物量为1.56 g·L-1。生物量与去除率存在一定的相关性。当四环素浓度为40~60 mg·L-1时,菌株生物量由1.15 上升到了1.23,只上升到0.08。造成这一现象的原因可能是以四环素作为唯一的碳源,没有其它的碳源四环素对阴沟肠杆菌具有毒性,其碳源不能满足菌株快速繁殖的需求[15]。40~100 mg·L-1的生长量并不是随着底物浓度的增加而増加的。四环素浓度对菌株的去除能力有一定的影响,但是在100 mg·L-1和120 mg·L-1的四环素初始浓度下,菌株的降解能力以及微生物的活性被明显抑制。可见高浓度的四环素会导致菌株对四环素去除能力下降,菌株的降解特性是存在于一定的浓度限度内的,因此故选用四环素浓度达80 mg·L-1为最佳的底物浓度。

图11 不同底物浓度对菌株Ly-1057 去除四环素作用的影响Fig.11 Effect of different substrate concentrations on the removal of tetracycline by strain Ly-1057
2.6.6 不同可溶性淀粉浓度对Ly-1057 去除四环素作用的影响
由图12可知,当不添加可溶性淀粉作为碳源时,四环素的去除率为58.58%,当可溶性淀粉为10、20、30、40 mg·L-1的外加碳源时,去除率分别为60.38%、64.36%、74.58%、62.03%,可以看出肠杆菌在加入20 mg·L-1可溶性淀粉后菌株生长最优,菌丝干重达1.61 g·L-1。产生降解酶的数量多,其原因可能是加入少量碳源能够促进降解酶的产生数量和菌株增长,因而降解率增加[15]。这一降解结果与许晓玲的四环素降解菌的选育、鉴定及其降解特性的结果一致。

图12 不同可溶性淀粉浓度对Ly-1057 去除四环素作用的影响Fig.12 Effects of different soluble starch concentrations on the removal of tetracycline by Ly-1057
2.6.7 不同浓度酵母浸粉对Ly-1057 去除四环素作用的影响
从图13可以看出在不同浓度酵母浸粉条件下,四环素降解菌的降解效率有明显差异;在外加酵母浸粉浓度为20 mg·L-1时,肠杆菌的生长情况和对四环素的降解效率最优,对四环素的去除率达到75.09%,菌株增长量为1.43 g·L-1。这表明适量的酵母浸粉作为外加氮源有助于提高Ly-1057 对四环素的去除率。添加酵母提取物后降解率的显著提高可能是由于微生物产生某些有利于四环素降解的酶的存在[16]。
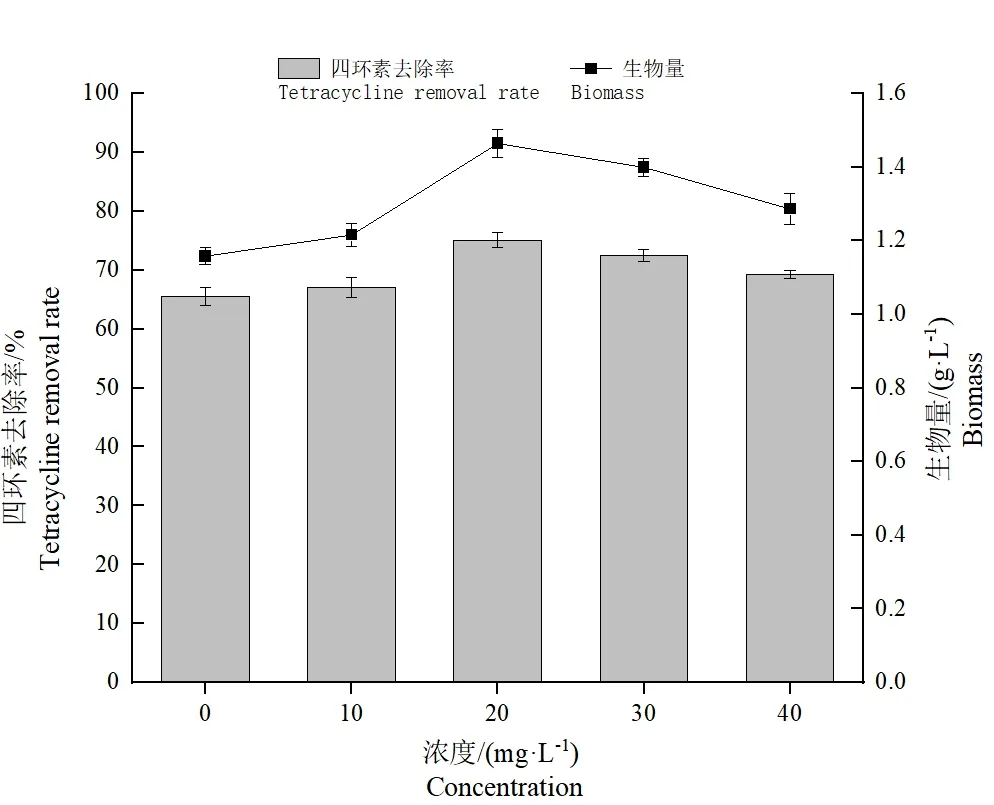
图13 不同酵母浸粉浓度对Ly-1057 去除四环素作用的影响Fig.13 Effects of different yeast extract concentrations on the removal of tetracycline by Ly-1057
2.6.8 扫描电镜结果
选择吸附效率最高的菌株阴沟肠杆菌Ly-1057 进行扫描电镜观察(图14)。由扫描电镜结果可看出,正常菌株菌体外形清晰,呈杆状,排列不规则,可清晰看到菌体的皱纹,表面粗糙,有大小不一的凹陷,这可以增大了四环素与菌体的接触面积,为四环素与菌体的结合提供更多的位点。在四环素浓度为80 mg·L-1的条件下,肠杆菌Ly-1057 细胞表面结构明显褶皱,细胞内陷产生形变,说明阴沟肠杆菌Ly-1057 吸附了一定量的四环素,且四环素对菌体表面结构产生了破坏作用。
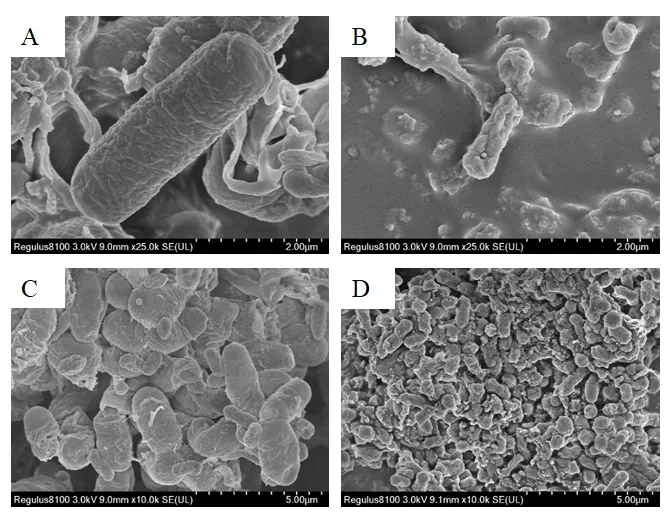
图14 阴沟肠杆菌(Enterobacter cloacae)Ly-1057 扫描电镜结果Fig.14 Sem results of Enterobacter Cloacae Ly-1057
3 讨论
抗生素是一类潜在的环境污染物,其残留会造成严重的生态污染,其中四环素在环境中的残留问题一直是近几年研究的热点。研究表明,每年有大量四环素以尿液或粪便的形式释放到水生环境中,增加了其微生物种群的抗生素耐药性,并产生毒性更高的副产物[16]。由于传统的废水处理方法不能有效地消除四环素,先进的氧化工艺(AOPs)已被应用,这些AOPs 包括光化学、电化学和光催化技术,然而,这些工艺流程的高成本限制了它们的使用[17]。生物处理作为废水处理领域的核心技术,操作简单、废水质量好、环境干扰低、成本低、矿化率高、对微生物适应性强,因而成为最适宜的处理方法。
好氧颗粒状污泥技术是一种新开发的生物废水处理方法,但通过这种工艺去除四环素的效果有限[18]。因此,筛选降解四环素的特异菌株,可为四环素污染的土壤和水体的生物修复及环境治理技术的研发提供理论依据。Migliore 等利用糙皮侧耳菌在实验室条件下实现了四环素类抗生素OTC 的降解,并通过质谱分析发现该菌通过菌丝吸收OTC 后再进行降解,推测OTC 中的酰胺基转化为乙酰基而成为2-乙酰基-2-去酰胺土霉素(ADOTC),该种产物比OTC 的抗菌性低,具有较高的亲油性,毒性相对较低[19]。真菌Pleurotus os⁃treatusmycelium 被证实能够将土壤中的土霉素转化为低毒或无毒产物,去酰胺土霉素可能为其主要降解产物[20]。除此之外,白腐真菌Trametes ver⁃sicolor表达的漆酶同样也可以降解四环素,并消除其生态毒性[21]。本研究从长期受四环污染的土壤中分离筛选到1 株降解四环素的菌株,结合菌落形态和分子鉴定,将菌株Ly-1507 鉴定为阴沟肠杆菌,命名为阴沟肠杆菌(Enterobacter cloacae)Ly-1057。阴沟肠杆菌应用于污染土壤的四环素的去除还尚未有报道,陶美、赵晨光等人报道文献克雷伯氏菌和大肠杆菌、变形杆菌对四环素具有较强的清除能力[11-12],阴沟肠杆菌与克雷伯氏菌和大肠杆菌都属于同一菌属。
培养条件对菌株的生长和对四环素的降解能力有至关重要的影响[22]。适当的碳氮源是共代谢所必需的主要能量材料,可以促进共代谢细菌对四环素的降解。本文研究了外加碳源-可溶性淀粉和外加氮源-酵母浸粉菌株的生长和四环素的降解情况。初始pH为7.0 和80 mg·L-1四环素下,添加碳、氮源后的第7 天,可溶性淀粉和酵母浸粉均为20 mg·L-1时,菌株对四环素去除效果最佳,进一步确定了菌株Ly-1057 表现出良好的四环素降解能力的最佳降解条件。
4 结论
本文筛选出了1 株降解四环素的菌株—阴沟肠杆菌(Enterobacter cloacae),并对其培养条件进行优化,为其应用于污染土壤的四环素去除提供了坚实的理论基础。

