作物纬度适应性的研究进展
邱蕾蕾,欧阳鑫昊
(厦门大学生命科学学院,细胞应激生物学国家重点实验室,福建 厦门 361102)
到2050年,世界可能面临人口破百亿和维持地球健康的巨大挑战,保证粮食安全至关重要.近几十年来,随着全球气候变暖,作物有向高纬度扩张的趋势,其中伴随的是作物对光周期敏感性(日长识别)的改变[1].日长是诱导植物开花的重要外在因素,据此植物可分为:长日照促进开花的长日照植物,如小麦(TriticumaestivumL.)、大麦(HordeumvulgareL.)、拟南芥(Arabidopsisthaliana)、油菜(BrassicanapusL.);短日照促进开花的短日照植物,如水稻(OryzasativaL.)、玉米(ZeamaysL.)、大豆(Glycinemax(Linn.)Merr.);对日长不敏感的日中性植物,如番茄(Lycopersiconesculentum)、黄瓜(CucumissativusL.)[2].在作物的选育过程中,合适的开花时间是粮食高产的保证:开花时间提前使作物营养生长期缩短,不能充分利用当地的光温条件;开花时间推后则作物不能在低温来临之前充分地灌浆结实.培育出适合不同纬度地区的作物品种对于粮食增产至关重要,可以从根本上解决部分地区的粮食危机.地球的公转和自转产生四季和日夜变化,也使得高纬度地区夏季日长更长,低纬度地区夏季日长更短.作物在响应日长变化的过程中,通过光周期基因直接或间接调控成花素基因表达,从而调节开花时间.当作物扩张至新的纬度环境中,一些重要光周期基因的自然变异使作物能够通过调整自身开花时间来适应新环境.全球气候变暖使不同纬度地区作物的生长季节得以延长,现有的轮作方式重新调整将有利于产量的最大化,这需要对作物进行纬度适应性选择,而光周期基因的不同组合是实现该过程的重要基础.研究作物的纬度适应性对于作物的品种选育与引种、杂交种制种和产量具有非常重要的参考意义.本文从植物光周期调控开花、光周期基因影响日长识别、纬度适应性选择3个方面对作物纬度适应性进行阐述.
1 光周期调控植物开花
1.1 拟南芥光周期途径调控开花
开花是植物从营养生长转变为生殖生长的重要体现,开花结实使植物可以将生命顺利延续给下一代.开花过程主要包括成花诱导、花发育和开花.植物作为固着式生长的生物,需要对周围环境的变化做出相应的生长调整,在适当时期开花是植物感知环境变化的一个重要性状.同时,开花时间由内源遗传成分和各种环境因素共同调控,如激素、日长、温度和胁迫等.在模式植物拟南芥中,开花调控途径研究得最清楚,主要可分为光周期途径、春化途径、赤霉素途径和自主途径[3].在1920年,美国学者Garner和Allard观察到一个烟草变种马里兰猛犸象(NicotianatabacumL.),其在华盛顿夏季时一直进行营养生长,而冬季放入温室可以开花,由此发现日长是影响烟草开花的主要因素,这是人们第一次提出光周期的概念,距今已经有100多年历史[2].
植物叶片通过调节自身成花素基因FT(floweringlocusT)的表达来响应感受光周期的变化,从而在合适的时间开花[2].在拟南芥中,叶片感知外界光照、温度等因素变化后,通过核蛋白GI(gigantea)、转录因子CO(constans)等传递信号,调控成花素基因FT的表达,随后FT蛋白从叶片经筛管运输到顶端分生组织诱导开花[4].拟南芥在长日照条件下可以诱导FT基因的高表达以促进开花,然而在短日照条件下FT基因的表达水平则很低[5].
CO是拟南芥光周期调控开花网络中的核心分子,具有明显的节律性表达:长日照下其信使RNA(messenger RNA,mRNA)水平晚间高于早晨,蛋白水平则在黄昏时达到峰值;短日照下其蛋白丰度远低于长日照下.在白天,CO基因的mRNA水平和FKF1(flavin-binding,Kelch repeat,F-box 1)-GI复合物密切相关;FKF1-GI复合物的形成依赖于蓝光的存在,该复合物可以调节CO基因转录抑制因子CDF(cycling dof factor)的降解,使得CO基因的mRNA水平可以在白天得到积累[6-7].CO蛋白的翻译后调控也是拟南芥光周期诱导FT基因转录的重要因素.不同光信号调节CO蛋白稳定性的机制不同,远红光和蓝光信号可以稳定CO,而红光则可以降解CO[8].红光受体PhyB(phytochrome B)、E3泛素连接酶COP1(constitutive photomorphogenic 1)、SPA(suppressor of PhyA-105)、HOS1(high expression of osmotically responsive genes 1)参与到CO的降解过程;同时PHL(phytochrome dependent late flowering)在红光下和PhyB相互作用,可以减弱PhyB抑制开花的活性[9].在长日照和短日照下的晚间,CO被SPA1-COP1复合物降解.FKF1、PhyA(远红光受体)和CRY(cryptochrome,蓝光受体),尤其是CRY2,参与调控CO蛋白的稳定性.在蓝光下,CRY2-COP1-SPA1复合物可以抑制COP1-SPA1活性以稳定CO,从而激活FT基因表达[2,8].除参与经典的光周期信号途径调控开花外,CO也可以和NF-Y(CCAAT-box-binding nuclear factor Y)共同通过染色质环的形式,将远端的增强子带到FT基因启动子附近并激活其表达[10].
1.2 水稻光周期途径调控开花
1.2.1 水稻的成花诱导
水稻是全球主要粮食作物之一,产量和抽穗期(开花时间)紧密相连.综合前人报道,参与水稻光周期调控抽穗的基因有50多个[11],如Hd1(headingdate1)[12]、DTH8(daystoheading8)[13]、DTH2[14]、Ghd7(grainnumber,plantheightandheadingdate7)[15]、Ghd7.1/DTH7/OsPRR37(pseudo-response-regulator37)[16]、Ehd1(earlyheadingdate1)[17]、Hd6[18]、Hd16[19]、Hd17/OsELF3-1(earlyflowering3-1)[20]和Hd18[21].上述光周期基因组成了一个非常复杂的光周期调控开花网络,这为选育适应不同纬度地区的水稻品种提供了非常重要的分子基础.水稻有两个成花素基因,分别是Hd3a和RFT1(ricefloweringlocusT1),Hd3a-RFT1双基因RNAi水稻在短日照条件下超过300 d不抽穗[22].所有光周期基因最终通过直接或间接调控水稻成花素基因Hd3a和RFT1的表达来影响抽穗.和拟南芥一样,水稻成花素也在叶片中合成,随后运输到顶端分生组织,Hd3a(或RFT1)和14-3-3蛋白在细胞质中结合,当Hd3a(或RFT1)-14-3-3复合物进入细胞核后,和碱性亮氨酸拉链型转录因子OsFD1形成成花素激活复合物(florigen activation complex,FAC),并激活花特征MADS-box转录因子基因OsMADS14、OsMADS15、OsMADS18和OsMADS34的转录,启始成花诱导[23-24].水稻的光周期调控开花途径主要有Hd1-Hd3a途径(和拟南芥CO-FT途径同源)和其特有的(Hd1/Ghd7/DTH8/DTH7)-Ehd1-Hd3a/RFT1途径.
1.2.2 水稻Hd1-Hd3a/RFT1途径对成花素基因的转录调控
20世纪90年代,日本科学家Yano利用日本晴和卡萨拉斯两个品种(两者光周期敏感性不同)杂交F2代的186个植株以及850多个分子标记构建近等基因系,发现Hd1是影响水稻抽穗的主效数量性状位点(quantitative trait loci,QTL);相比于日本晴,卡萨拉斯的Hd1第2个外显子有一个2 bp的缺失,导致两者光敏性不同[12].水稻Hd1基因和拟南芥CO基因同源,CO促进拟南芥开花,而Hd1则在水稻光周期调控开花中具有双重功能,短日照下促进开花,长日照下抑制开花;有趣的是Hd1基因的mRNA水平在长、短日照下差异不大,说明Hd1的功能反转并非由于mRNA水平上的差异[12].Hd1基因的表达受生物钟核心成分OsGI调控,且具有明显的昼夜节律,在长、短日照下,其mRNA峰值均出现在开灯后16 h[25].在短日照下,OsGI促进Hd1的转录,osgi突变体在短日照下比野生型晚抽穗,在长日照下则没有差别[26].水稻中LC2(leaf inclination 2)可以在短日照下结合开花抑制因子OsLF基因(典型helix-loop-helix结构域蛋白)的启动子区域,通过改变该区域H3K27me3甲基化水平抑制OsLF基因表达,而OsLF可以直接结合在Hd1基因启动子区域并抑制其表达,即LC2通过抑制一个开花抑制因子来促进水稻抽穗[27].
Hd1在长日照下功能反转为Hd3a基因表达的抑制因子,这一过程受到光敏色素尤其是光敏色素B的调控;光敏色素生色团生物合成缺陷的突变体se5(photoperiodsensitivity5)失去光周期敏感性,在长、短日照下抽穗时间几乎一致,且Hd1在长日照条件下不再抑制se5突变体抽穗[28-29].此外,Hd6在长日照下可能通过磷酸化一个未知因子加强Hd1在长日照下的抑制抽穗功能[8];OsK4在HDR1(heading date repressor 1)存在的情况下磷酸化Hd1,在长日照下促进Hd1基因表达、抑制Ehd1基因表达,从而降低Hd3a和RFT1的表达,延迟抽穗[30].在ghd7osprr37双突变体中,Hd1在长日照下转变为开花促进因子,然而ghd7和osprr37单突变体并没有这种现象[31].目前Hd1在长、短日照下具有双重功能的具体分子机制尚不清楚.
1.2.3 水稻(Hd1/Ghd7/DTH8/DTH7)-Ehd1-Hd3a/RFT1途径对成花素基因的转录调控
Ehd1基因是水稻光周期调控开花的重要枢纽之一,编码一个由341个氨基酸组成的B型反应调节子,蛋白中部有一个能与DNA结合的结构域[17].长、短日照下,Ehd1都能促进Hd3a和RFT1的表达,促进水稻抽穗,是独立于Hd1-Hd3a/RFT1的水稻光周期调控开花途径.然而,Ehd1的表达也受到很多上游光周期基因的调控,如Ehd2和Hd18上调Ehd1[21,32],Hd1和Ghd7下调Ehd1[33-34].除对抽穗期产生影响外,Ehd1对水稻株型也有影响,同时Ehd1可以使成穗相关基因提前表达,调控穗的发育,降低穗的一次枝梗数目,导致穗粒数减少(独立于开花途径),影响大田水稻的产量[35].
Ghd7基因在2008年被克隆,编码一个含有CCT(CO,CO-like,and TOC1)结构域的蛋白,在顶端分生组织、根分生组织、幼穗分枝原基、叶片、幼叶的叶鞘及茎的表皮层都有表达[15].在长日照下,Ghd7的表达延迟水稻抽穗,增加株高和每穗粒数,是这3个重要农艺性状的主效QTL[15].Ghd7在长日照下的表达量高于短日照下,且随着日长增加而增加,这一过程依赖于隐花色素,而红光可以诱导Ghd7的表达;同时,Ghd7在光照下的表达量高于黑暗下,尤其是在长日照下[15,33,36].Ghd7和Hd1在长日照下形成复合体,特异性结合于Ehd1基因的启动子区域而抑制其表达[34];在热诱导Ghd7基因表达的转基因水稻中,Ghd7的表达量升高后,Ehd1的表达量降低[33].此外,生物钟成分Hd17/OsELF3-1可负调控Ghd7的表达来促进水稻抽穗[20].
DTH8基因编码一个NF-Y的B亚基(NF-YB),在根、茎、幼叶、叶鞘及幼穗中都有表达[37].短日照下,DTH8对水稻抽穗几乎没有影响;长日照下,DTH8抑制Ehd1、Hd3a、RFT1表达,延迟水稻抽穗,同时DTH8也可以增加水稻株高、一级枝梗数、二级枝梗数和每穗粒数[13,37-38].DTH8的表达量随着日长增加而增加,dth8突变体中Hd3a基因位点的H3K27me3甲基化水平降低,促进抽穗[39].此外,DTH8可以和Hd1、OsNF-YC4形成异源三聚体,识别Ghd7基因启动子上的CCAAT盒,激活基因表达以抑制Ehd1基因的表达[40].
DTH7基因编码一个含有CCT结构域的蛋白,其亚细胞定位于细胞核,在根、茎、叶和幼穗中都有表达,且具有明显的昼夜节律,在白天的表达水平高于夜晚[16].DTH7可以通过控制穗的分化速率而非穗的发育时间来调控穗粒数,进而影响水稻的产量[41].DTH7同时也是一个控制水稻光周期敏感性和产量的关键基因,位于光敏色素B的下游,在phyb突变体中DTH7的表达量低于野生型;在短日照下,DTH7几乎不影响成花素基因Hd3a和RFT1的表达;但在长日照下,DTH7抑制Ehd1、Hd3a和RFT1的表达,从而导致水稻延迟抽穗[16].DTH7调控开花的分子机制目前研究得还不透彻.
2 光周期基因影响作物日长识别
2.1 水稻光周期基因影响日长识别与纬度适应性
在我国农业生产中,水稻是第一大口粮作物、第二大粮食作物,目前的栽培稻主要有籼稻和粳稻,由野生稻驯化而来[42].遗传学研究表明,粳稻起源于中国长江流域或珠江流域[42-43];考古学研究表明,水稻于8 000~10 000年前在中国南方的长江流域被驯化[44].另有研究显示,粳稻被驯化后向北传播,同时一支向南传播进入东南亚,与当地的野生稻杂交,经历了第二次驯化而产生籼稻品种[42].在全球范围内水稻的种植广泛,53° N~40° S都有分布[45].水稻作为典型的短日照作物,临界日长是13.5 h[33],但在全球水稻种植区域,大部分地区夏季的日长都超过13.5 h,尤其是在高纬度地区,如我国黑龙江地区夏季最长日长可达16 h,因此高纬度地区的栽培品种需要其光周期敏感性弱甚至没有光周期敏感性[46].在水稻的光周期基因中,DTH2、Hd1、Ghd7、DTH8、DTH7、OsMADS51、Hd6、Hd16等可以在长日照下影响水稻的光周期敏感性和纬度适应性.
DTH2基因编码一个CO-like蛋白,定位于细胞核且具有转录激活功能,是一个在长日照下促进水稻抽穗的微效QTL,独立于Hd1-Hd3a/RFT1和Ehd1-Hd3a/RFT1途径诱导成花素基因Hd3a和RFT1表达.研究表明:DTH2基因第25 位和第 1 721 位2个功能单核苷酸多态性(single uncleotide polymorphism,SNP)位点与水稻适应高纬度地区有关,第25位和第1 721位碱基都是G时更适合在低纬度地区种植,而第25位是A、第1 721位是T时更适合在高纬度地区种植;在水稻驯化或改良过程中,DTH2可能是人类选择水稻适应长日照条件的重要QTL,由此证明微效QTL在作物适应与育种中发挥重要作用[14].
Hd1基因是人类对栽培稻抽穗期多样性驯化过程中的一个重要选择目标,具有很多种自然突变形式[46].长日照下,Hd1抑制水稻抽穗,因此在高纬度地区,为了避免灌浆期遇到低温,自然突变形式的hd1被广泛选择[46-47].在温带的粳稻品种引种到热带地区时,由于光周期的缩短水稻会提前抽穗,功能性Hd1等位是导致这一现象的主要原因,然而无功能的hd1等位可以使温带粳稻在热带地区有很好的适应性[48].长日照下,Ghd7基因表达量上升,水稻抽穗延迟,而Ghd7基因功能减弱或缺失的自然突变体光周期敏感性弱,能够在高纬度地区种植.Ghd7是水稻适应高纬度时被广泛选择的位点,我国东北大多数粳稻品种的Ghd7等位是弱功能或无功能类型[15,46].Ehd1基因是长日照下水稻光周期开花调控网络的枢纽,也具有SNP位点,Ehd1蛋白中第219位甘氨酸残基突变为精氨酸残基会减弱其DNA结合活性并延迟水稻抽穗,但此类型的自然变异在水稻品种中比较少见;同时,对Ehd1基因启动子区域2 kb片段进行鉴定,发现有9种存在差异的核苷酸序列,但对Ehd1的表达并无影响[49].
DTH8基因在水稻光周期调控开花通路、产量和叶绿素合成等方面发挥重要作用,长日照下,DTH8延迟水稻抽穗,是育种过程中的一个重要靶标基因[37].DTH8也存在多种自然变异形式,可导致其功能丧失[46];然而,也有研究表明籼、粳稻的DTH8启动子存在差异,一个SNP位点使得粳稻亚种的DTH8表达活性更高,对寒冷环境的适应能力更强,大多数在高纬度地区的品种都携带有功能的DTH8[46,50-51].而DTH7/PRR37在长日照下是一个开花抑制因子,dth7ghd7双突变体在长日照下也是极早花,而北方积温少且日照长,需要水稻早抽穗,因此dth7ghd7双突变体可以适应于黑龙江省的水稻种植区(53° N)[51-52].
Hd1、DTH8、Ghd7和DTH7是水稻光周期敏感性的4个主效基因,也是调控水稻纬度适应性的主要位点.在ghd7dth8双突变体中,Hd1在长、短日照下都促进抽穗;Ghd7则在长、短日照下都抑制抽穗.长日照下,Hd1、Ghd7、DTH8可以两两互作,也可以形成三聚体,且三者都有功能时可以完全抑制Ehd1-Hd3a/RFT1开花信号通路,使水稻表现出极强的光周期敏感性;而其中任意两者互作时则可以部分抑制上述开花通路,使水稻产生不同程度的延迟抽穗,表现出中等的光周期敏感性;任意两个基因的双突变体或三突变体水稻提早抽穗,表现为弱的光周期敏感性[53].在短日照下,Ghd7基因表达低,Hd1可以和抑制复合体竞争,促进Hd3a和RFT1基因的表达,从而促进水稻抽穗[53].当Hd1、DTH8、Ghd7和DTH7都有功能时,水稻表现出极强的光周期敏感性,在长日照下甚至不抽穗;Hd1dth8ghd7dth7基因型水稻在长日照下最早开花,可能是由于DTH8、GHD7、DTH7这3个基因突变后完全解除了Hd1的抑制活性,使其变得和在短日照下一样促进水稻抽穗[53-54].
除上述4个主效基因外,还有很多其他微效基因在育种中得到应用.OsMADS51是一个开花促进因子,作用于Ehd1、OsMADS14和Hd3a基因上游并促进三者表达;且OsMADS51可能经历了密集的人工选择,在早季籼稻抽穗及灌浆阶段对高温的适应发挥重要作用[55].Hd16基因编码酪蛋白激酶CKⅠ(casein kinase Ⅰ),长日照下可以磷酸化Ghd7使其功能增强,抑制抽穗;日本晴和越光两个品种的Hd16基因存在一个SNP位点,导致两者功能存在差异,在日本晴中为有功能类型,而在越光中为无功能类型[19].在分析栽培稻的Hd16等位时,发现Hd16有两种自然变异类型,且只在温带粳稻品种中出现.这些结果表明,Hd16基因的自然变异促进水稻抽穗,提高了水稻在较冷、长日照条件的温带地区的适应性[56-57].
成花素基因RFT1和Hd3a决定水稻抽穗的早晚,其中Hd3a在短日照下起主导作用,RFT1则在长日照下起主导作用[58].在自然变异的等位中,RFT1蛋白的第105位谷氨酸残基突变为赖氨酸后功能减弱,而功能性RFT1基因是水稻适应高纬度所必需的,在纬度高于33° N的地区,籼稻与粳稻品种都携带有功能的RFT1等位;低纬度地区的栽培稻或野生稻存在携带无功能的rft1等位的情况[59].Hd3a基因的表达量和抽穗期紧密相关,在不同的品种中Hd3a基因启动子存在一些SNP位点,但Hd3a蛋白功能高度保守,目前未发现突变类型[49].
2.2 大豆光周期基因影响日长识别与纬度适应性
大豆是重要的粮食作物和经济作物,可以用来酿造酱油、制作豆制品、压榨食用油;大豆起源于我国,如今的栽培大豆从野生大豆经人工培育与驯化而来,已有5 000年的栽培历史[60].大豆是典型的短日照作物,在驯化过程中一些光周期基因的自然变异对于大豆品种的多样性发挥极大作用.开花抑制因子E1是大豆光周期调控开花网络的枢纽,通过抑制大豆成花素基因GmFT2a和GmFT5a来抑制开花[61].E2(GmGI)、E3(GmphyA3)和E4(GmphyA2)通过促进E1的表达抑制开花[62].温带品种引种到低纬度地区时,由于日长的缩短,大豆生育期过短,导致产量极低.2017年,孔凡江和刘宝辉团队的研究发现大豆J基因(与拟南芥ELF3同源)的突变可延长大豆的营养生长期,提高其在短日照下的产量,扩大了大豆在低纬度地区的种植范围,其分子机制是J基因通过抑制E1的表达促进大豆开花[63].得益于大豆在低纬度营养生长期的延长,巴西成为世界第二大的大豆种植国[62].ELF3是夜晚复合体(EC)的重要组分,在大豆中敲除EC的另外两个组分LUX1和LUX2基因,大豆则不开花,说明EC是大豆光周期调控开花网络的核心[64].近期,孔凡江和刘宝辉团队再次发掘了低纬度地区控制大豆开花的新位点Tof16(timeofflowering16),由LHY1a(lateelongatedhypocotyl1a)编码;Tof16结合在E1基因启动子上直接抑制E1表达,在短日照下Tof16功能缺失会延迟大豆开花和提高大豆产量;Tof16和J在大豆开花调控中是独立的,且二者具有加性遗传效应,80%大豆品种的Tof16和J都发生了不同类型的变异,可见Tof16和J的自然变异是大豆从温带地区向热带低纬度地区扩张的重要遗传基础[65].Tof11和Tof12与拟南芥的PRR3同源,二者的突变可以使得大豆更早开花与成熟;我国东北地区的栽培品种与野生大豆相比,无功能的tof12丰度更高,而突变形式的tof11和tof12可提高大豆对高纬度地区有限夏季生长期的适应[61].最新研究表明,一个新位点Tof5和大豆的纬度适应性相关,E1抑制Tof5表达,Tof5可直接结合在GmFT2a和GmFT5a基因启动子并激活二者的表达,Tof5的自然变异对于大豆向高纬度地区扩张至关重要[66].
大豆中有10个FT同源基因,在功能上存在差异,其中GmFT2a和GmFT5a作为开花促进因子,GmFT4和GmFT1a作为开花抑制因子,拮抗协调大豆的营养生长和生殖生长[67-68].这些FT同源基因在基因组序列水平上呈现多样性,存在一些自然变异,影响大豆的开花时间和成熟期;GmFT2a在短日照下对大豆开花的促进作用更突出,而GmFT5a在长日照下的促进作用更突出,可见GmFT5a对于大豆适应高纬度地区种植更重要[67,69].大豆ft2a和ft5a的单突变体可以互相补偿另一个缺失带来的影响,对开花时间影响较小;而ft2aft5a则表现出增长的营养生长期,在短日照下有利于增产[70].另外,GmGBP1(gibberellin-regulatedMyb-relatedtranscriptionfactorbindingprotein1)基因是GmFT2a和GmFT5a的正调控因子,在短日照下促进大豆开花,对278份大豆品种GmGBP1编码区和非编码区进行分析,发现GmGBP1启动子区域呈现多态性并影响其表达,说明GmGBP1也是人工选育过程中的一个重要位点[71].最新研究表明:大豆GmRAV(relatedtoabscisicacidinsensitive3/viviparous1)作为开花抑制因子,可以结合在GmFT5a基因启动子的CAACA基序上,抑制GmFT5a的转录;GmRAV启动子上6个SNP位点和大豆的花期和成熟期密切相关,不同类型的启动子可影响GmRAV的表达,对于大豆的纬度适应性起重要作用[72].
2.3 玉米光周期基因影响日长识别与纬度适应性
在我国的谷物类粮食作物中,玉米是主要口粮之一,在世界范围内广泛种植,主要种植国家有中国、美国、巴西、印度、阿根廷等[45].玉米由大刍草驯化而来,起源于约9 000年前的墨西哥南部,随后扩散到美洲地区[73].ZCN8(Zeamayscentroradialis8)基因和拟南芥FT同源,是一个可以整合玉米内源和光周期信号的成花因子[74].中国农业大学的田丰团队通过玉米自交系的关联分析,鉴定出ZCN8启动子区SNP-1245和InDel-2339的自然变异与玉米开花时间的相关性很强,这两种变异在玉米适应高纬度地区的过程中发挥重要作用[75].ZmCCT9、ZmCCT10基因和水稻Ghd7同源,在长日照下抑制ZCN8的表达并延迟玉米开花[76-77].ZmCCT9上游57 kb的Harbinger-like转座子抑制ZmCCT9的表达,使玉米早开花,该转座子在高纬度地区品种中比低纬度地区品种中丰度更高;ZmCCT10启动子区CATCA-like转座子的插入可影响该区域的甲基化水平,降低ZmCCT10的表达,使植株在长日照下早开花,这两个转座子加速了玉米向高纬度地区扩张[76-77].Vgt1(vegetativetogenerativetransition1)是一个位于开花抑制因子ZmRap2.7上游70 kb的调节序列,在Vgt1上一个微小转座子的插入与玉米提前开花高度相关,也是人工选育中玉米适应温带和高纬度地区的一个重要位点[78-80].ZmMADS69通过ZmRap2.7-ZCN8模块促进开花,群体遗传分析发现ZmMADS69基因启动子区一个转座子的插入使玉米晚开花,是人工选育的一个重要位点,这可能在玉米从热带迁徙到温带过程中发挥重要作用[81].
2.4 小麦和马铃薯(Solanum tuberosum L.)光周期基因影响日长识别与纬度适应性
小麦是世界三大谷物之一,起源于西亚,在我国北方地区广泛种植.目前种植的普通小麦是六倍体,起源过程大致可分为两个阶段:野生一粒小麦(AA基因组)和拟斯卑尔脱山羊草(AegilopsspeltoidesTausch,BB基因组)自然杂交,形成野生二粒小麦(AABB基因组),经驯化成为栽培二粒小麦;二粒小麦与粗山羊草(Ae.tauschii,DD基因组)自然杂交,产生六倍体普通小麦(AABBDD基因组)[45].小麦是一种典型的长日照作物,根据对春化要求的不同,可分为冬季型(需经历低温才能开花)和春季型.VRN1(vernalization1)和VRN2基因在小麦春化过程中发挥重要功能,春化诱导VRN1转录,VRN1通过结合在VRN2基因启动子上抑制其表达,VRN2则抑制小麦成花素基因VRN3转录[82].在小麦中,决定光周期敏感性的主要位点是PPD1(photoperiod1),分别在PPD-A1、PPD-D1、PPD-B1转录起始位点上游 1 085 bp 缺失、2 089 bp缺失、308 bp插入(自然变异),使小麦的光周期敏感性降低[2].Ppd-D1a和Ppd-D1b两个不同等位可使小麦开花时间产生10 d的差异;Ppd-D1a可以加速抽穗,在欧洲南部和日本的冬小麦中出现频率高,以避免炎热的夏季或当地的雨季[83-84].在我国的小麦品种中,Ppd-D1a的丰度从地方品种的38.6%增加到改良品种的90.6%;Ppd-D1b则在美国北部的春小麦品种中丰度较高,说明该等位基因在人工选育中被选择以提高小麦的纬度适应性[85-86].同时,马铃薯是全球第四大粮食作物,仅次于小麦、玉米和水稻,起源于南美洲安第斯地区,其块茎生成依赖于短日照,转录因子StCDF1的自然突变,促使马铃薯可以在原始种植区之外更广泛地被种植[87].
3 纬度适应性选择
全球气候变暖将使高纬度地区有望开发出新的农业生产基地,中低纬度地区温度的上升使得作物的种植时间延长,在环境影响及人工选育的情况下,低纬度地区种植的作物有向高纬度地区扩张的趋势.低纬度地区热带种质资源中蕴含着丰富的抗虫害、耐旱、耐贫瘠等优质基因资源,热带种质资源在温带利用是应对气候变暖、确保粮食安全的重要途径.从南往北引种需要对热带种质进行纬度适应性选择,从北往南引种也同样需要注意光周期大幅缩短带来的短日照作物生育期缩短,进而影响产量.在传统育种过程中,培育出一个优质品种需要8~10年[88],其中包括优化开花时间.当引种到另一个新的纬度时,其生育期不一定能够和当地生长季节匹配,因此育种家需要再花8~10年来重新优化开花时间.
不同的作物都是通过叶片感受外界光周期的变化,通过光受体传递给下游光周期核心基因,随后直接或间接调控成花素基因表达,诱导成花.虽然不同作物的光周期基因存在很大差异,但是最终信号途径都汇聚于成花素基因,通过调节成花素基因的表达来调节开花时间(图1(a)).最新研究表明[88]:基于日长识别的环境适应性模拟器(daylength-sensing based environment adaptation simulator,DEAS)将成花素基因转录作为一种下游特征,即使在上游光周期基因等位变异未知的情况下,通过检测作物在不同日长下的成花素基因表达(日长识别方式),预测不同纬度地区自然变化日长下的成花素基因动态表达,根据表达量高、中、低所需经历的具体天数判断作物的纬度适应性,为加速作物纬度适应性选择提供了新方法和新思路(图1(b)).DEAS具有较高的预测精确度且仅用时一个月左右,大大缩短了作物纬度适应性选择的周期,在将来作物育种过程中可用于检测选育品种的日长识别方式,并与特定地区的参考品种对比,判断选育品种的纬度适应性,省去一些繁琐的田间筛选工作.
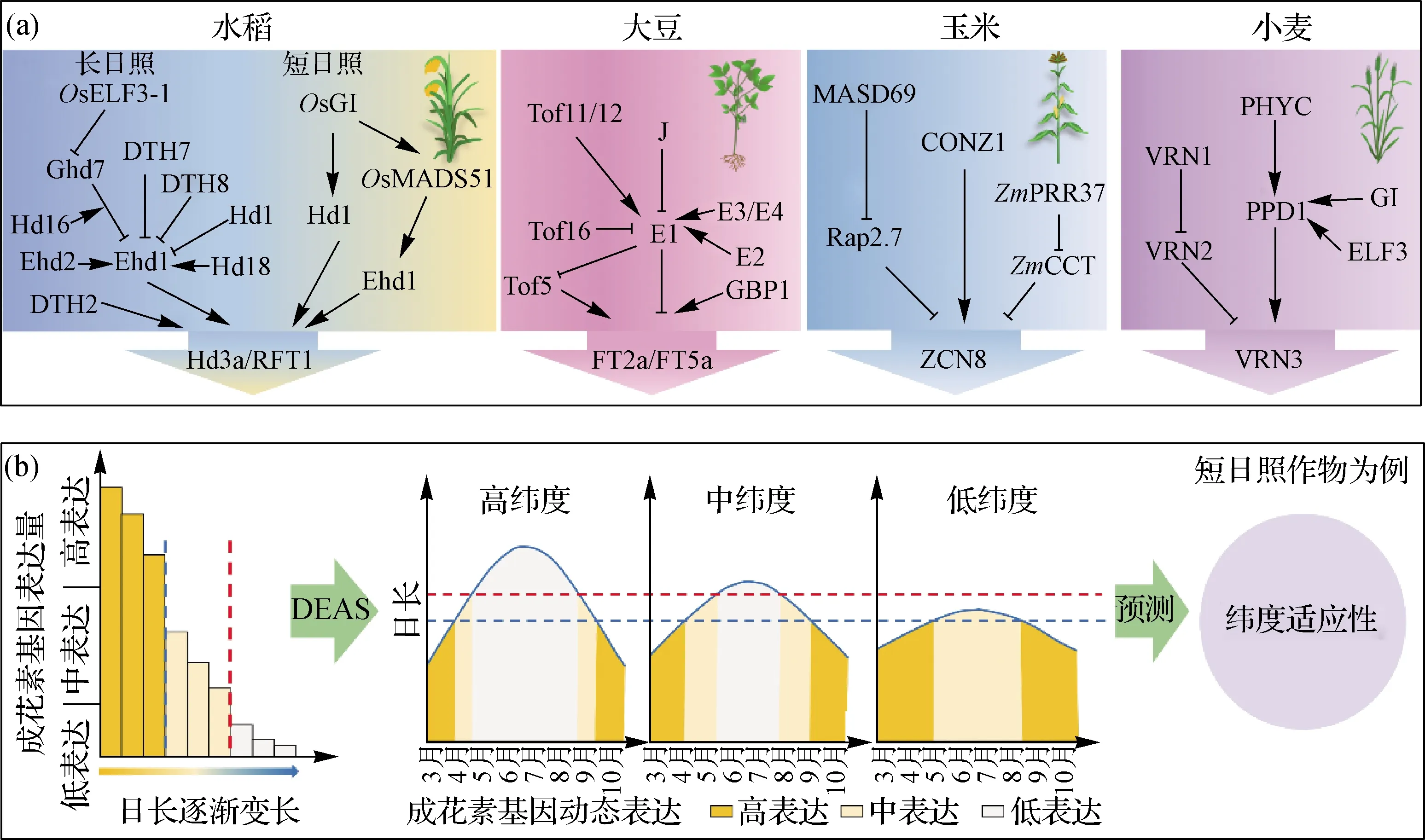
(a)水稻、大豆、玉米和小麦不同的光周期调控开花网络,表示负调控,→表示正调控;(b)基于DEAS预测作物纬度适应性,蓝色虚线代表区分中高表达的日长,红色虚线代表区分中、低表达的日长.
4 总结与展望
水稻、玉米、大豆已经有几千年的栽培历史,从起源地扩种到世界不同纬度地区,经过不断地驯化与改良,产量越来越高,保障了粮食安全,这也是人类文明的重要基础.在作物的扩张过程中,人类按照自身需求已经对作物进行了纬度适应性选择,其分子机制也陆续得到解析.随着对不同作物开花调控机制的不断探究,人们对作物纬度适应性的了解也将逐渐深入,有助于更加高效地进行作物的引种和育种.全球变暖、人口增长以及人们对美好生活的追求,带来了新的粮食安全问题,需要培育出高质高产且广适应性的品系来解决.与持续时间长、成本高的田间优化开花时间相比,DEAS 提供了一种快速有效的方法,通过对日长识别机制的快速选择,加速对作物的纬度适应性选择,为未来粮食安全和可持续性农业发展提供一种策略.在水稻等粮食作物中,许多光周期基因的功能已知,可以测序得知某一地区参考品种的基因型,并通过DEAS得到参考品种的日长识别模式.在水稻引种或育种过程中,可以通过成簇的规律性间隔短回文重复序列(clustered regularly interspaced short palindromic repeats,CRISPR)/Cas9 技术对目标选育品种的光周期基因进行特异性基因编辑(敲除或修复)[89],通过改变目标选育品种的基因型来改变日长识别方式,从而改变水稻的生育期,使其适应新的纬度.大豆在北种南引的过程中,光周期的变短使大豆生育期缩短,减产严重,可以通过CRISPR/Cas9敲除开花促进因子,增加大豆营养生长期以达到高产.DEAS在大豆和玉米中也具有很好的应用潜力[88],短日照下成花素基因表达量高,促进开花.在育种过程中,缩短每个世代的周期可以加速育种进程,通过缩短日长来缩短生育期则可以达到这一目的;反之,对于长日照作物小麦和大麦,则可以增加日长来缩短生育期[90].未来随着对作物开花调控网络的了解更加透彻,可以利用DEAS更准确地预测作物开花时间以及纬度适应性,加速作物的品种选育过程.

