大剂量甲氨蝶呤治疗骨肉瘤患者出现严重消除延迟异常一例报告
陈警之 胡宇贤 李海亮 王春楠 牛晓辉 徐海荣
骨肉瘤是最常见的骨原发恶性肿瘤,占原发骨肿瘤的11.7%,年发病率约为 2~3 / 100 万。发病年龄多在青少年时期。好发部位在机体长管状骨的干骺端,最常见发病部位是股骨远端和胫骨近端,其次是肱骨近端。早期临床症状多以局部疼痛为主,夜间痛明显。骨端近关节处可见局部肿大,可有触痛,硬度参差,局部皮温较高,可见静脉曲张,有时可触及异常搏动,可伴有病理性骨折出现。
骨肉瘤疾病常规一线化疗用药为甲氨蝶呤 ( methotrexate,MTX )、顺铂、多柔比星、异环磷酰胺。新辅助化疗 + 手术 + 术后化疗诊疗方案使骨肉瘤患者 5 年生存率提高至 60%~80% ( 原来单纯手术患者 5 年生存率约为10%~20%。1972 年 Jaffe 提出大剂量 MTX 加甲酰四氢叶酸解救法治疗骨肉瘤有效,被认为是骨肉瘤治疗史的一大进展。作为目前骨肉瘤化疗一线用药的 MTX 是一种干扰叶酸代谢的抗肿瘤药物,化学结构与叶酸类似,能够竞争性结合二氢叶酸还原酶,阻断叶酸转变为具有辅酶活性的四氢叶酸,不能提供含有甲基的嘌呤、胸腺嘧啶和蛋氨酸、丝氨酸等,影响细胞 DNA、RNA 及蛋白质合成,从而抑制细胞增殖与复制。MTX 化疗药物存在诸多常见副反应,如肝脏毒性、肾脏毒性、胃肠道反应、口腔黏膜炎、骨髓抑制以及神经毒性、心血管系统疾病等,严重的药物不良反应可能导致患者死亡。HDMTX 化疗中 MTX 使用剂量为致死量,增加细胞毒作用的同时也会出现极为严重的脏器损伤及骨髓抑制等。有研究数据显示 HDMTX 化疗出现肝脏损伤、肾脏损伤、恶心呕吐的发生率分别为 67.2%、28.0%、87.20%。检索文献提示MTX 延迟排泄存在不同的判断标准,大多数学者认为 MTX给药后 24 h、48 h、72 h 安全血药浓度为 < 10 μmol / L、1 μmol / L、0.1 μmol / L。目前我院 HDMTX 化疗实时监测药物血药浓度 ( C ):0 h C ( C0 h ) ≤ 1500 μmol / L、24 h C ( C24 h ) ≤ 5 μmol / L、48 h C ( C48 h ) ≤ 0.5 μmol / L及 72 h C ( C72 h ) ≤ 0.05 μmol / L 为相对安全范围。反之MTX 化疗出现排泄延迟,可能加重毒副反应发生,甚至危及患者生命安全。有研究数据显示 HDMTX 排泄延迟发生率约为 26.68%,部分存在严重排泄异常。因此常辅以全身水化碱化,亚叶酸钙 ( CF ) 解救,预防护胃止呕,加强保肝等临床治疗干预,降低不良反应的发生。
我院经治 1 例成人骨肉瘤患者 HDMTX 多次化疗后24 h 出现严重排泄延迟合并急性肝肾损伤的病例,现报道如下。
临床资料
一、一般资料
患者,女,25 岁,汉族,未婚,身高 160 cm,体重52 kg,体表面积 1.54 m。本次住院因“左股骨远端骨肉瘤术后定期化疗”于 2020 年 12 月 6 日入我院。患者 2019年 11 月,无明显诱因出现左侧大腿远端疼痛,夜间痛明显,NRS 评分:3 分,未予重视未行规范治疗。2020 年1 月 17 日,患者不慎扭伤后患肢疼痛剧烈就诊当地医院,行局部检查考虑“左侧股骨远端病变”,建议上级医院诊治。2020 年 3 月 16 日于我院行局部病变穿刺活检术,术后病理提示“参照患者年龄和骨肿瘤科提示普通骨肉瘤内缺乏瘤骨的区域”。术前患者在我院完成 4 个周期序惯化疗:MTX ( 15 g )、AP 联合化疗 ( DDP 125 mg +盐酸多柔比星脂质体 90 mg )、异环磷酰胺 ( 22 g )、MTX( 15 g )。2020 年 6 月 9 日,行“左股骨远端瘤段截除、人工关节置换术”,术后病理提示“符合左股骨远端骨肉瘤化疗后表现”。患者目前已完成术后 8 个周期序惯化疗( 异环磷酰胺-MTX-AP 联合化疗,因术前异环磷酰胺化疗后出现重度骨髓抑制,术后异环磷酰胺减量至 19 g,余化疗方案未出现严重不良反应,剂量同术前 )。
患者本次化疗前一般情况良好,生命体征平稳,常规化验检查提示大致正常范围,排除治疗前其它影响因素。2020 年 12 月 11 日,患者行 MTX 15 mg 静脉泵入治疗,泵速约为 140 ml / h,总时间约为 4 h ( MTX 总计量超过20 mg,静脉泵入总时间调整为 6 h 内 )。MTX 静泵结束后0 h、24 h、48 h、72 h 静脉监测血药浓度。MTX 静泵结束后 6 h 给予患者 CF 12 mg Q6 h 解救,直至 MTX 血药浓度降至安全范围。MTX 化疗前 1 天,开始给予患者常规水化、碱化尿液、预防护胃止呕、加强保肝等预处理,维持患者尿常规处于碱性状态 ( pH > 7.5 )。
患者 MTX 化疗当天出现明显恶心呕吐、严重腹泻等消化道反应,MTX 0 h 血药浓度处于安全范围 ( C0 h =1206 μmol / L < 1500 μmol / L ),给予患者水化、碱化尿液、CF 解救、加强护胃止呕、止泻补液等对症支持治疗。患者 MTX 24 h 当天出现颜面部连及四肢浮肿;头面、口舌麻木;右手拘挛,伸展困难;恶心呕吐加重,伴有腹泻发生;精神状态萎靡不振,后 MTX 24 h 血药浓度严重高于安全范围 ( C24 h = 218 μmol / L > 5 μmol / L )。患者出现 HDMTX 化疗后严重排泄延迟异常,病情危重。立即给予患者生命体征监测,急查化验检查,请专科会诊展开多学科协作诊治。患者的肝功能呈严重 Ⅳ 级毒性反应ALT 升至 972.00 U / L ( 表 1 ),肾功能出现明显 Ⅱ 级毒性反应 ( 肌酐升高至 259.9 umol / L,估计肾小球滤过率由化疗前 175.19 ml / min 降至 24.01 ml / min )。考虑患者出现 HDMTX 化疗后严重消除异常,伴发急性肝肾损伤,继续给予患者加强水化,碱化尿液,加强保肝护肾,增强 CF 解救计量与频次 ( 由 CF 解救常规剂量 12 mg Q6 h调整至 200 mg Q2 h )。患者血清肌酐下降缓慢,一度反弹式升高,给予患者 2 次连续静脉血液滤过治疗。密切监测患者 MTX 血药浓度及生化等实验室检查,调整临床用药直至患者病情稳定,恢复正常生活,于 2021 年 1 月 8 日出院。
二、既往史
患者否认既往肝炎史、疟疾史、结核史;否认高血压史、冠心病史、糖尿病史、脑血管病史、肾病史、精神病史等。
三、肝功能 ALT、AST、GGT 变化
患者既往无急慢性肝病病史,化疗前后出现 ALT、AST、GGT 明显改变,符合重度急性肝损伤的诊断标准。经诊疗,患者化疗后 1~27 天肝功能变化见表 1。
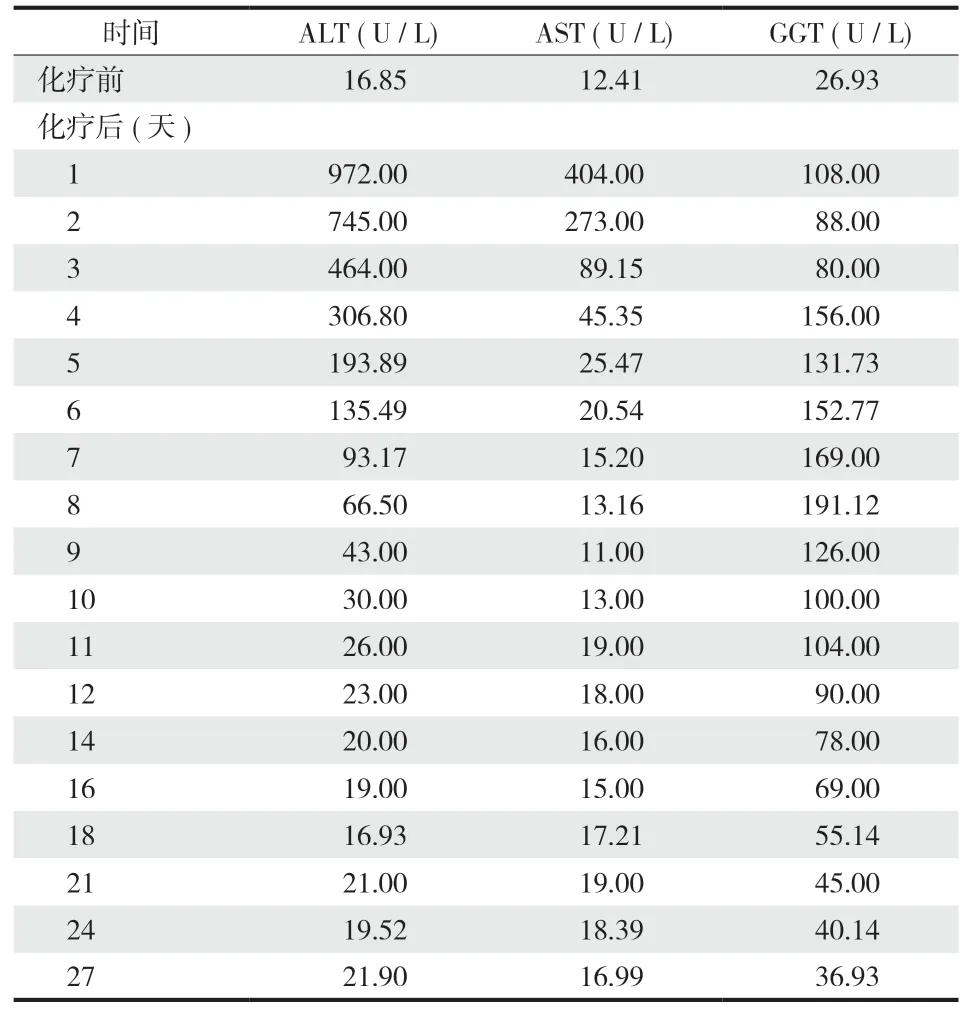
表1 患者大剂量 MTX 化疗前后肝功能 ( ALT、AST、GGT ) 变化Tab.1 Changes of liver function ( ALT, AST, GGT ) before and after high-dose methotrexate chemotherapy
四、肾功能肌酐、血清尿素、尿酸、肾小球滤过率变化
患者否认既往急慢性肾病病史,化疗前患者肾功能正常,化疗后出现明显肾功能损伤。经诊疗,患者化疗后1~43 天肾功能变化见表 2。
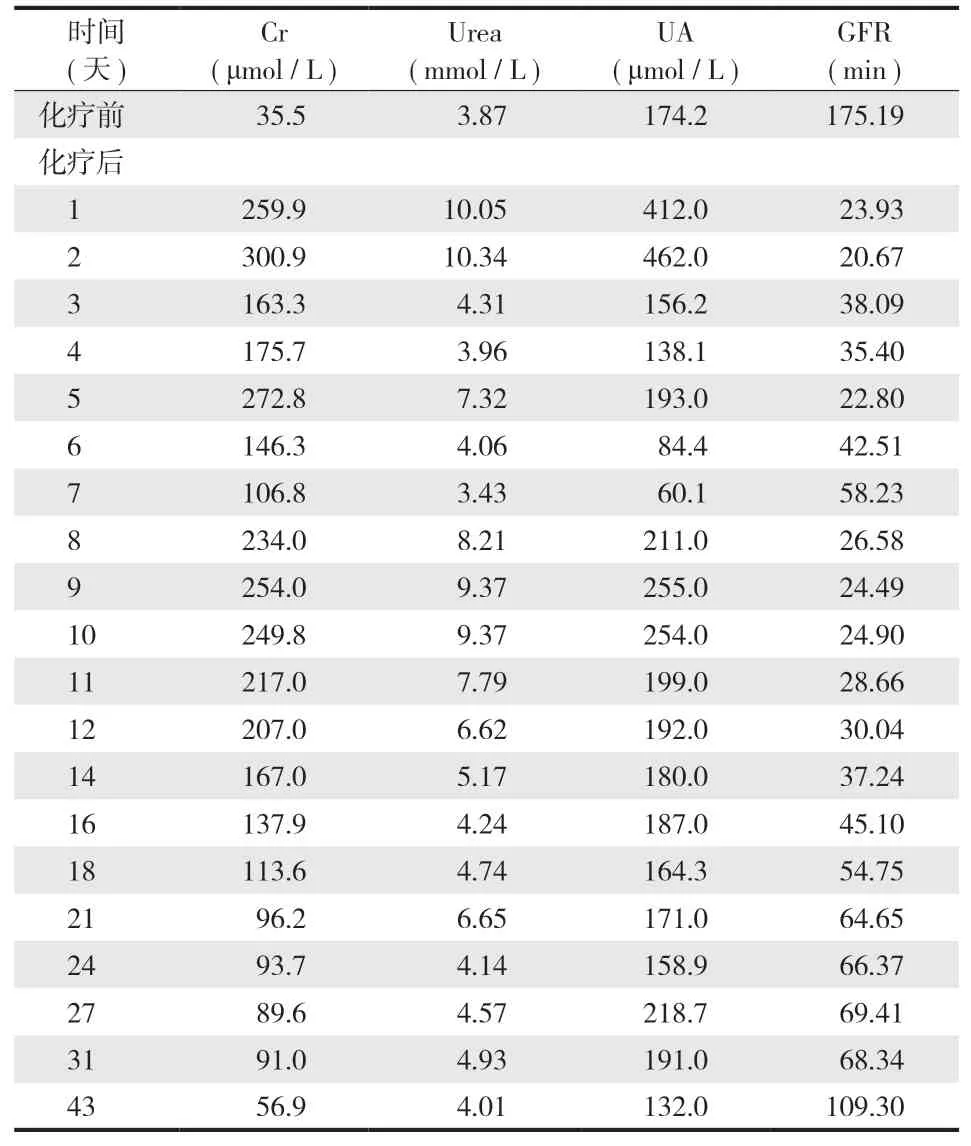
表2 患者大剂量 MTX 化疗前后肾功能 ( Cr、Urea、UA ) 变化Tab.2 Changes of renal function ( Cr, Urea, UA ) before and after high-dose methotrexate chemotherapy
五、化疗期间 MTX 血药浓度变化
HDMTX 化疗治疗骨肉瘤存在诸多不良反应风险,须密切监测 MTX 0 h、24 h、48 h、72 h 血药浓度,保证治疗顺利完成。本例患者 24 h 血药浓度严重高于正常范围,需调整 MTX 血药浓度监测频率,直至血药浓度降至正常范围。患者化疗期间 MTX 血药浓度变化 ( 图 1,2 )。
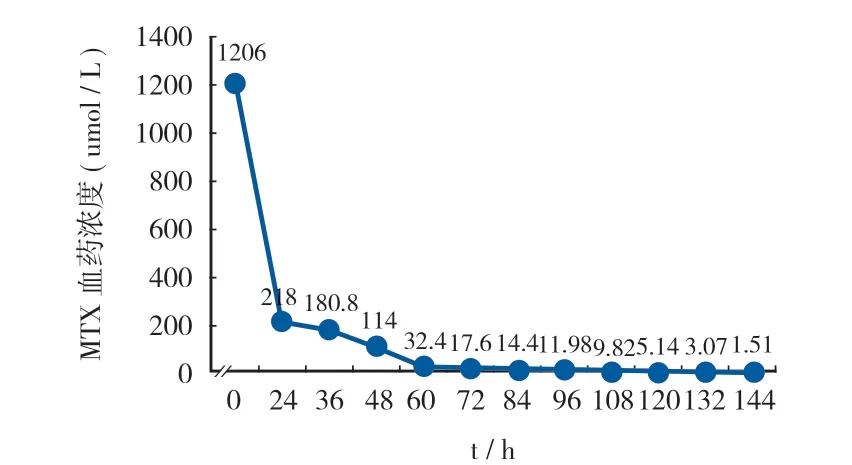
图1 患者 HDMTX 化疗血药浓度变化 ( C ) 变化Fig.1 Changes of blood concentration of HDMTX chemotherapy ( C )
讨 论
一、大剂量 MTX 血药浓度监测意义
MTX 用于治疗骨肉瘤剂量远大于常规剂量 ( < 500 mg /m),通过提高肿瘤细胞内 MTX 浓度以提高临床疗效,另一方面对机体的毒性也随之增强。其毒性强度与细胞在超限浓度下暴露的时间显著相关,因此,实时密切监测大剂量 MTX 化疗时血药浓度很重要。MTX 24 h 血药浓度监测存在特殊意义,可早期识别患者排泄延迟风险,尽早实施个体化解救方案。有研究回顾 3515 例骨肉瘤患者大剂量 MTX 化疗后 C24 h 数据,发现 C24 h ≥ 5 μmol / L 患者C72 h 未达标率超过 70%。同时 C24 h 与 MTX 血药浓度达标所需时间呈正相关。不同患者之间、同一患者不同次 MTX 化疗期间存在清除不稳定性,与本案例存在一致性。因此 DH-MTX 用药期间血药浓度实时监测很重要。同时有文献提出,Cmax 与组织学良好反应、疾病复发率存在相关性,Cmax 控制在 1000~1500 μmol / L 可能有助于实现更有效的临床预后。
二、尿量、尿液 pH、水化碱化
MTX 及其代谢产物,化学性质为酸性,主要通过肾脏排泄,因此存在诱发肾功能损伤导致急性肾衰竭可能。HDMTX 化疗需要充足水化、碱化尿液、监测 MTX 血药浓度。HDMTX 化疗对于患者尿量和尿液 pH 值有严格要求。对于成年人,HDMTX 输注期间要求液体平衡,尿量每日至少 2000~3000 ml / m,尿量每日 < 2000 ml / m会明显减少 MTX 排泄。专家共识推荐的要求是尿液 pH值在 7.5~8.0,水化液体总量每日 2500~3500 ml / m,MTX 静滴前 12 h 开始水化。有研究表明尿 pH 值从 5.0增加至 7.0 时,MTX 在尿液中的溶解度提高 20 倍。本例大剂量 MTX 化疗前 1 天,给予患者约 2600 ml 水化碱化预处理,使用碳酸氢钠静脉联合口服进行碱化尿液。MTX化疗前患者尿常规 pH 值为 8.5。MTX 化疗 0 h 给予患者约3500 ml 水化碱化液体预防性处理,但尿常规 pH 值从 8.5下降至 7.5,并且出现隐血阳性。患者 MTX 化疗后第 1 天继续给予常规水化碱化治疗,患者 MTX 化疗 24 h 血药浓度为 218 μmol / L,出现严重排泄延迟异常。该患者 MTX化疗前水化时间满足要求,但液体量低于专家共识要求,尿液碱化符合规定;MTX 化疗 0 h 水化时间、液体量及尿量均符合要求,但尿常规 pH 值出现下降 ( 虽然最低值 ≥7.5 ) 伴潜血阳性,未取得关注,给予加强对症处理,可能是引起 MTX 严重排泄异常的原因之一。因此,结合患者尿液 pH、MTX 血药浓度,加强水化碱化对于预防 MTX 排泄延迟存在重要意义。
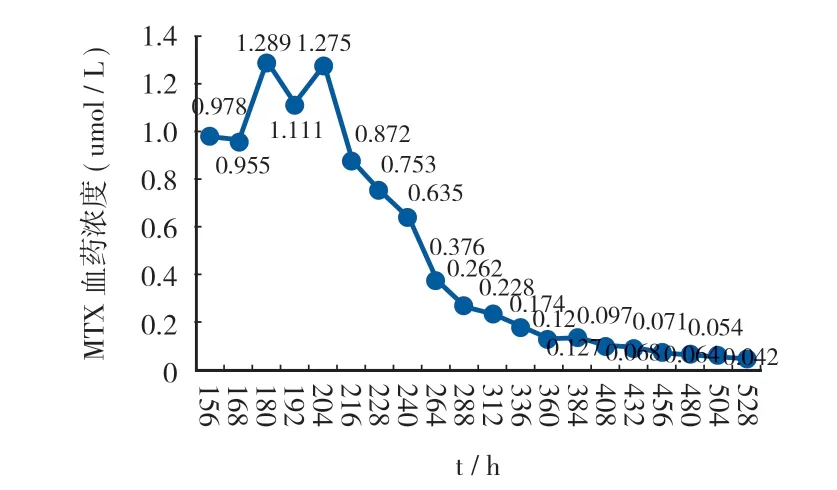
图2 患者 HDMTX 化疗血药浓度变化 ( C ) 变化Fig.2 Changes of blood concentration of HDMTX chemotherapy ( C )
三、大剂量 MTX 化疗的 CF 解救
MTX 与二氢叶酸还原酶结合后能够阻止二氢叶酸还原为四氢叶酸。甲酰四氢叶酸钙,也称 CF,是四氢叶酸的类似物,其进入体内后会转变为有活性的亚甲基四氢叶酸和 N10-甲烯四氢叶酸。因此外源性给予亚叶酸钙,可以越过 MTX 所阻断的生化环节,使正常的 DNA 及蛋白质生化反应继续进行,从而起到解救细胞的作用。水化碱化及 CF 的应用使 HD-MTX 产生的严重毒性反应从 10% 下降到 1% 或更低。本例 MTX 化疗后 6 h,给予成人 CF 常规剂量 12 mg Q6 h 肌注预防解救。患者 MTX 24 h 血药浓度为 218 μmol / L,出现严重消除延迟异常,给予患者加强 CF 解救治疗,调整剂量及频次为 200 mg 静滴 Q2 h,血药浓度监测频率调整为 Q12 h 并联合静脉血滤。患者MTX 156 h 血药浓度下降至 0.978 μmol / L,调整 CF 剂量及频次为 100 mg 静滴 Q4 h。患者 MTX 180 h 血药浓度回升至 1.289 μmol / L,伴有血肌酐反弹式增长,上调 CF剂量及频次为 100 mg 静滴 Q2 h 继续解救处理。待患者MTX 360 h 血药浓度为 0.120 μmol / L,调整 CF 剂量及频次为 100 mg 静滴 Q4 直至血药浓度下降至安全范围 ( Cmtx 528 h = 0.042 μmol / L < 0.05 μmol / L )。结合患者血药浓度变化,及时调整 CF 剂量,加强水化碱化处理是大剂量MTX 化疗后消除延迟异常解救成功的首要原因。密切监测患者 MTX 血药浓度变化趋势,解救过程中存在浓度反弹式回升可能。另有文献提出 CF 的解救时机对肿瘤预后有关,目前国内外针对 CF 解救时间采取推迟和减少剂量的趋势,但对于 CF 解救推迟的时机仍存在争议。目前我国对 MTX 的监测时间点、参考浓度标准、CF 开始解救时间和停止解救标准等方面尚未完全统一。
四、血液透析对于 HDMTX 化疗出现急性肾损伤的意义
MTX 在肝中羟基化形成 7-OH MTX,经肾代谢消除,7-OH MTX 较药物原型溶解度小,易结晶沉淀于肾,是引起 MTX 肾脏毒性主要原因。当发生肾毒性后,MTX 会出现排泄延迟,提高 MTX 血药浓度,同时也会增加其它药物不良反应的发生率,严重时威胁生命安全,形成恶性循环。使用肾脏替代方式解救 MTX 中毒,包括血液透析、血液灌注、腹膜透析、血浆置换、血液滤过等多种方式。各种透析方式存在并发症包括导管出口位置的出血、贫血、血小板减少、低钾血症、严重的低磷血症以及发生心脏骤停的可能。本例患者 MTX 血药浓度 36 h 为180.8 μmol / L;肝功能:ALT:745.00 U / L,AST:273 U / L,GGT:88 U / L;肾功能:肌酐:300.9 μmol / L,血清尿素:10.34 mmol / L,尿酸:462 μmol / L。给予患者连续静脉血滤滤过治疗。第一次血滤结束后复查 MTX 84 h 为14.4 μmol / L;肝功能:ALT 下降至 306.80 U / L,AST 下降至 45.35 U / L,GGT 上升为 156.0 U / L;肾功能:肌酐下降至 175.7 μmol / L,血清尿素下降至 3.96 mmol / L,尿酸下降至 138.1 μmol / L。患者 MTX 108 h 为 9.82 μmol / L,处于持续下降状态,但肌酐上升至 272.8 μmol / L,血清尿素回升至 7.32 mmol / L,尿酸回升至 193 μmol / L,继续给予第 2 次静脉血滤滤过治疗。患者 MTX 168 h为 0.955 μmol / L;ALT 下降至 93.17 U / L,AST 下降至 15.20 U / L,GGT 为 169 U / L;肾功能:肌酐下降至106.8 μmol / L,血清尿素下降至 3.43 mmol / L,尿酸下降至 60.1 μmol / L,结束第 2 次血滤治疗。继续给予 CF 解救,加强水化碱化,保肝护肾等对症支持治疗。血滤滤过肾脏替代治疗对于 MTX 延迟代谢处理存在重要临床意义,本例未出现血滤不良反应。
五、患者临床症状可作为 HDMTX 延迟代谢的预警提示
患者 MTX 化疗当天出现严重恶心呕吐,腹泻等消化道反应,同时伴发面部口舌麻木,右手麻木拘挛,伸展困难;面部及四肢浮肿。精神状态逐渐萎靡。患者既往 MTX化疗未出现上述临床症状,故可提示临床伴发上述情况,需警惕 MTX 血药浓度,是否存在消除延迟异常,需加以临床干预。有文献称呕吐是 MTX 延迟排泄的重要风险因素之一,对于严重呕吐的患者需警惕 MTX 血药浓度,临床可增加化疗止吐药的剂量缓解症状。
六、药物联合作用影响 HDMTX 延迟代谢
HDMTX 化疗联合应用其它药物可能影响其正常排泄,例如抗生素、非甾体抗炎药物、质子泵抑制剂 ( PPI )等。美国食品药品管理局 ( Food and Drug Administration,FDA ) 曾发布声明称 PPI 与 MTX 联用可能导致 MTX 血药浓度升高,增加 MTX 延迟代谢和药物不良反应的风险,并建议“对正在使用 PPI 制剂的患者应谨慎使用HD-MTX”。目前认为具体机制是 PPI 阻断肾脏 H-K-ATP 酶,阻断 MTX 转运相关蛋白,减少 MTX 向尿液转运导致药物代谢延迟。本例既往 HDMTX 化疗均使用了质子泵抑制剂奥美拉唑预防护胃治疗,结合临床实践,PPI延迟 HDMTX 代谢的确定性有待印证,但值得临床注意。
七、大剂量 MTX 化疗中毒后出现循环系统并发症
患者既往否认高血压、冠心病等循环系统疾病,化疗前患者生命体征平稳 ( 心率,血压,脉搏,呼吸,体温 ),常规检查心电图心脏彩超及心肌酶均提示正常范围。本次化疗期间患者多次出现胸闷气短,呼吸不畅等不适,给予患者监测生命体征变化,吸氧,减缓药物静脉滴注速度等常规处理后临床症状好转。患者 HDMTX 化疗后 C24 h 出现消除延迟异常,心率、脉搏、呼吸及体温均在正常水平,动态监测心肌酶 BNP 最高 459.2 pg / ml ( 正常范围:< 100 pg / ml ),TNT 最高 0.058 ng / ml ( 正常范围 < 0.014 ng / ml ),Mb、CK 及 CK-Mb 均在正常范围。后期患者血压逐渐升高,收缩压最高 160 mm Hg,舒张压最高 120 mmg Hg,心血管专科会诊给予对症治疗后收缩压降至 132 mm Hg,舒张压降至 90 mmg Hg 水平。患者复查心电图及心脏彩超提示未见异常。有文献报道 HDMTX 化疗出现中毒事件成功解救后出现了继发性高血压的并发症。同时案例报道 HDMTX 化疗后出现心功能衰竭致死亡 1 例。本例患者 HDMTX 化疗后同样也出现了继发性高血压,排除心脏器质性病变,考虑不除外循环系统功能性改变及肾性因素可能,但具体机制尚且不明确。目前有关 HDMTX 化疗出现心脏毒性甚至诱发心功能衰竭报道极少,有待进一步研究。
总之,大剂量 MTX 治疗骨肉瘤疾病可提高患者生存率,但由于个体差异及多种危险因素的影响,MTX 排泄延迟会加重不良反应事件的发生,从而严重影响临床疗效。化疗前预处理、化疗中充分水化、碱化尿液、辅助CF 解救、监测 MTX 血药浓度及其它实验室检查等尽可能降低 MTX 延迟排泄的发生。同时多学科交叉协作是目前患者受益的重要途径,这对临床医师的全科专业技能水平存在更高要求。

