m6A 甲基化修饰与骨肉瘤研究进展
王闻雪 谭理 汤博艺 蔡林 谢远龙
骨肉瘤 ( osteosarcoma,OS ) 是一种原发性恶性骨肿瘤,起源于间叶组织,多位于四肢长骨干骺端,具有强侵袭、易转移、预后差等特点。在组织学上,OS 是一种高密度细胞肿瘤,由多形纺锤形细胞组成,并产生骨样基质。OS 多发于青少年,发病率约为 3~4 例 / 百万,OS 患者的 5 年生存率平均为 60%。目前发现,OS 的发病机制包括发生染色体异常、抑癌基因突变、原癌基因和转化生长因子表达失调、miRNAs、lncRNA 通过信号通路影响等,但 OS 发病机制尚未完全明确。近年来,m6A 甲基化 ( N6-Methyladenosine ) 调节因子以 m6A 依赖的方式调控OS 细胞转录后修饰过程,对 OS 的发生发展、化疗耐药、免疫治疗等产生影响。
一、m6A 甲基化修饰概述
N6-甲基腺嘌呤 ( N6-methyladenosine,m6A ) 是高等生物中最为常见的 RNA 修饰形式之一,定义为腺苷酸 N6原子上的甲基化修饰。m6A 甲基化广泛发生在真核细胞mRNA 和非编码 RNA ( ncRNA ) 中,常在 mRNA 上的 3’ 非翻译区 ( 3’ UTR ) 和终止密码子处富集,其核心基序多为“GGm6ACU”。m6A 修饰通过 writer、eraser 和 reader三类生物分子实现动态可逆修饰,即 m6A 甲基转移酶,m6A 去甲基化酶和 m6A 甲基化阅读蛋白。
m6A 甲基转移酶主要负责催化 m6A 修饰,包括m6A 甲基转化酶样蛋白 3 ( METTL3 )、类甲基转移酶 14( METTL14 ),Wilms 肿瘤 1 相关蛋白 ( WTAP ) 和 RNA 结合基序蛋白 15 ( RBM15 ) 等。其中 METTL3 研究较多,它含有 S-腺苷甲硫氨酸 ( SAM ) 结合位点和行催化作用的DPPW 结构域,与 METTL14 按照 1∶1 的比例结合形成二聚体,可被 WTAP 招募到靶 RNA 上催化甲基化。在 AML中,METTL3 / 14 异二聚化物通过增强原癌基因 MYB 和MYC mRNA 的 3’ 端的 m6A 甲基化而增加其稳定性,使这两个基因过表达。
m6A 去甲基化酶能够去除 m6A 甲基化,如脂肪与肥胖相关蛋白 ( FTO ) 和人类中 ALKB 同源蛋白 5 ( ALKBH5 )。ALKBH5 可直接催化 m6A 形成腺嘌呤;FTO 则氧化使m6A 依次形成中间产物 hm6A ( N6-羟甲基腺苷 )、f6A( N6甲酰腺苷 ) 后再去除甲基,可在 AML 中通过降低锚蛋白重复序列和 SOCS 盒蛋白基因 2 ( ASB2 ) 和视黄酸受体 α 基因 ( RARA ) mRNA 的 m6A 丰度下调 RARA 和 ASB2的表达,从而抑制全反式视黄酸 ( ATRA ) 诱导的白血病细胞分化,发挥致癌作用。
m6A 甲基化阅读蛋白可识别 RNA 甲基化修饰,以m6A 依赖的方式影响 mRNA 的稳定性、代谢及翻译。常见的 reader 有 YTH 域蛋白家族成员 ( YTHDF1,YTHDF2,YTHDF3,YTHDC1 和 YTHDC2 ) 和异质核糖蛋白 HNRNP蛋白 ( HNRNPA2B1 和 HNRNPC ),真核起始因子 3 ( eIF3 )等。其中,YTH 域蛋白家族主要识别哺乳动物的 DR( m6A ) CH ( D = A / G / U,R = A / G,H = A / C / U ) 模块;5’ UTR 中含有 m6A 的 mRNA 可以直接结合 eIF3,以不依赖帽子结构的方式进行翻译。
二、m6A 修饰相关酶与 OS
目前已有多种 m6A 修饰相关酶被证明可以影响 OS 细胞的增殖、转移、侵袭、凋亡等,以影响 OS 预后与治疗( 表 1 )。
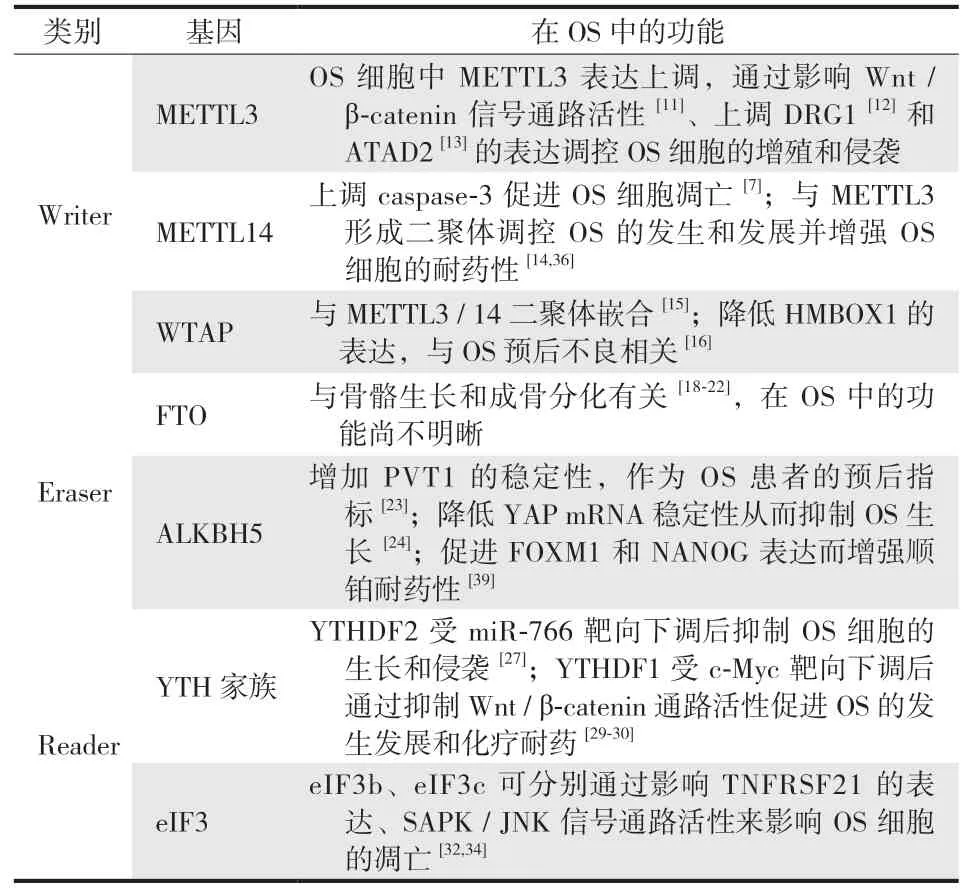
表1 m6A 修饰相关酶对 OS 的影响Tab.1 Effects of m6A-modified enzymes on osteosarcoma
1. m6A 甲基转移酶与 OS:
( 1 ) METTL3:METTL3 包含一个甲基转移酶结构域( MTD ) 和一个锌指结构域,其 MTD 含 358~580 个氨基酸残基。多项研究表明 METTL3 的异常表达与 OS 发生发展密切相关。Miao 等研究显示,在 OS 细胞中 METTL3的表达量和 m6A 甲基化程度均上升,而沉默甲基转移酶METTL3 则会下调淋巴增强因子-1 ( LEF1 ) mRNA 的表达和 m6A 修饰峰度,抑制 Wnt / β-catenin 信号通路的活性,进而调控 OS 细胞的增殖、转移和侵袭能力。另外,Ling等发现,METTL3 和 m6A 识别蛋白 ELAVL1 还能以m6A 依赖的方式诱导 OS 中 DRG1 的上调,DRG1 与细胞周期的正常进行和大量基因的表达有关,沉默 DRG1 可抑制OS 细胞的活力和转移能力。因此,沉默 METTL3 可通过降低 DRG1 的 mRNA 甲基化,从而干扰识别蛋白 ELAVL1识别 DRG1 mRNA,降低 DRG1 mRNA 的表达 ( 图 1a )。此外,有研究显示 OS 细胞内三磷酸腺苷酶家族蛋白 2 抗体( ATAD2 ) 是 METTL3 的又一个下游靶标,已知 ATAD2 参与多种肿瘤进展,METLL3 表达量增加会使 ATAD2 过表达,引起 OS 细胞增殖和侵袭程度上升,但目前还不清楚 METLL3 是否通过 m6A 调控 ATAD2 的表达量。
此外,METTL3 也可以与 METTL14 结合形成二聚体。METTL14 可以增加 caspase-3 的含量以促进 OS 细胞凋亡,而 METTL3 / 14 二聚体则通过识别下游 RNA 序列及翻译后修饰来选择性地调节 RNA 甲基化程度,从而调控 OS 的发生和发展。
( 2 ) WTAP:WTAP 蛋白通过与 METTL3 / 14 二聚体嵌合,作为 m6A 甲基转移酶复合物的重要成分在 RNA 代谢的外转录组调控中发挥重要作用。Chen 等表示WTAP 通过 m6A 甲基化修饰降低了 OS 细胞中核转录因子HMBOX1 基因的表达, WTAP / HMBOX1 部分通过 PI3K /AKT 信号通路调节 OS 细胞的增殖和转移,这与 OS 的预后不良相关 ( 图 1b )。具体表现为在 OS 中,WTAP 表达量增加,HMBOX1 的 mRNA 3’-UTR 区甲基化程度增加,HMBOX1 活性受到抑制,且表达下调。HMBOX1 的表达变化可作为影响 OS 患者总体生存的独立预后因素。
2. m6A 去甲基化酶与 OS:
( 1 ) FTO:FTO 基因位于人类 16 号染色体长臂上,在大脑和多种组织内表达。FTO 通过去甲基化修饰影响肥胖并与多种癌症相关,但在骨组织疾病方面,FTO 仅被证明与骨骼生长和成骨细胞分化有关,而对于 FTO 在OS 中的调控则知之甚少。据报道,缺乏 FTO 酶活性会导致骨密度和骨矿物质含量显著降低,这与骨质疏松症状相似。另外,FTO 在 R-2-羟基戊二酸 ( R-2HG )、miR-22-3p的作用下被抑制,降低癌基因 MYC 转录本的稳定性,其中,c-MYC 的降低可增加骨髓间充质干细胞向成骨细胞的分化。Son 等则表明,FTO 通过与磷酸化腺苷单磷酸活化蛋白激酶 ( p-AMPK ) 的正反馈环路诱导轻度内质网应激刺激成骨分化。
( 2 ) ALKBH5:ALKBH5 直接与底物 RNA 结合并去除m6A,在敲除 ALKBH5 后显示多聚腺苷酸化的 mRNA 总体 m6A 甲基化水平升高,并且加速这些 mRNA 出核。人浆细胞瘤转化迁移基因 1 ( PVT1 ) 是在其它肿瘤中查明的致癌 lncRNA,通过作为竞争性内源 RNA 或激活KAT2A 乙酰转移酶等来促进癌症的发生和发展。有学者揭示 ALKBH5 通过与 PVT1 结合减少其 m6A 甲基化修饰,避免其被 YTHDF2 识别而被降解,增加了 lncRNA 的稳定性。这表明除了转录因子 RUNX2,SOX2 等外,甲基化修饰也可能在 OS 中使 PVT1 表达量上调,因此或可作为对 OS 患者有价值的预后指标。此外,Yuan 等发现 ALKBH5 诱导的去甲基化可通过直接或以 pre-miRNA-181b-1 间接的方式来抑制转录共激活因子相关蛋白 YAP的 mRNA 稳定性和翻译来抑制 OS 生长。YAP 是已知的致癌因子,YTHDF1 m6A reader 可以促进被甲基化的转录物翻译,它的潜在靶标是 YAP,过表达 YTHDF1 可以消除过表达 ALKBH5 对 YAP 表达情况的影响。
3. m6A 甲基化阅读蛋白与 OS:
( 1 ) YTH 家族:YTH 家族包括 YTH m6A 结合蛋白( YTHDF1-3 )、YTH 结构域 1 ( YTHDC1 ) 和 YTH 结构域 2( YTHDC2 ),YTH 结构域采用包含 3 个 α 螺旋和 6 个 β 链的保守 α / β 折叠,6 个 β 链形成桶状褶皱,3 个 α 螺旋排列在 β 链上形成疏水核心。YTH 家族成员可被 m6A招募,影响包括 mRNA 剪接、核输出、翻译和降解在内的多种 mRNA 代谢过程,已有证据表明 YTH 家族在 OS 调控中发挥作用。例如,YTHDF2 在 OS 组织中受 miR-766靶向下调,抑制 OS 细胞生长和侵袭能力,miR-766 过表达可抵消 YTHDF2 的作用。Zhang 等发现包括YTHDC1 在内的多种 m6A 调控因子的表达在 OS 转移样本中有显著差异,但具体调控机制尚不明晰。YTHDF1 受致癌转录因子 c-Myc 调控,下调后可抑制 Wnt / β-catenin通路活性或可以此促进 OS 的发生发展和化疗耐药。
( 2 ) eIF3:eIF3 约 800 kDa,是与 40S 核糖体和几种 eIF 相互作用 ( 包括 eIF1 和 eIF4F 的 eIF4G 亚基 ) 而调控翻译起始的最重要的 eIF 家族成员。Choi 等发现,eIF3b 沉默引起了肿瘤坏死因子受体超家族成员 21( TNFRSF21 ) 的上调,从而降低了 OS 细胞的活力并诱导了细胞凋亡。TNFRSF21 含有一个被称为死亡受体 6( DR6 ) 的死亡结构域,可激活半胱氨酸蛋白酶 caspase-3促进细胞凋亡。但 TNFRSF21 不是 eIF3 惟一的靶点,因为 TNFRSF21 诱导的细胞死亡速率低于 eIF3b 沉默诱导的细胞死亡速率。Luo 等的研究也佐证了这一点,OS组织中 RPL34 mRNA 表达显著上调或是受到了 eIF3 茎环结构的激活。Gao 等表明,敲除 eIF3c 导致 U-2OS 细胞凋亡率增加,激活 SAPK / JNK 的激活信号通路并促进CASP3 / 7,二者可均裂解细胞底物以完成细胞凋亡,但eIF3c 基因下调导致促凋亡的具体作用机制尚不清楚。
目前,仍有一些 m6A 修饰相关酶对 OS 的影响未被发现,如 RBM15、KIAA1429、YTHDC1 / 2、HNRNPA2B1等,且已知 m6A 修饰相关酶对 OS 的调控通路亟待研究。
三、m6A 与 OS 化疗耐药
化疗对改善 OS 患者的预后有重要作用,主要包括手术治疗后的辅助化疗和局部治疗前进行的全身的新辅助化疗,可实现 60% 以上的长期无事生存率。但 OS 细胞的耐药性是化疗面临的主要难题,化疗耐药的 OS 患者预后极差。m6A 甲基化修饰可通过调节多药外排转运蛋白、药物代谢酶、药物靶标等表达,并通过影响 DNA 的损伤修复、自噬等信号通路而与肿瘤耐药密切相关。例如,OS化疗的主流药物有阿霉素、甲氨蝶呤、顺铂和异环磷酰胺等,m6A 甲基化的动态调节可影响这些 OS 化疗药物敏感性的耐药性。有研究显示,METTL3 / 14 使 TRIM7 mRNA 3’ 端发生 m6A 甲基化,经 YTHDF2 识别,可降解靶 RNA从而降低 TRIM7 的表达。而 TRIM7 可在 K184 位点泛素化 BRMS1 来下调其表达。BRMS1 能够诱导上皮到间质转化 ( EMT ) 过程调节 TRIM7 诱导的 OS 对阿霉素和甲氨蝶呤的敏感性 ( 图 1c )。因此,OS 细胞中 TRIM7 mRNA 3’ 端m6A 甲基化水平的降低可增强 OS 细胞的耐药性。
已有不少研究显示 m6A 甲基化的动态调节可影响阿霉素和顺铂肿瘤治疗的耐药性。Pan 等发现,METTL3使 miR-221-3P 上调,通过负调控与 miRNA 结合的 HIPK2 mRNA 的表达,从而促进其靶标血清胆碱酯酶 1 的表达,导致乳腺癌细胞对阿霉素的耐药性。Zhang 等研究则说明 TRIM11 mRNA 的 m6A 水平在鼻咽癌细胞中较高,可具 E3 泛素连接酶活性,与 Dvl 相关蛋白 Daple 结合并以p62 选择性自噬的方式促进 Daple 的泛素化降解,从而上调 Daple 负调控的 β-catenin 蛋白,进一步上调多药外排转运蛋白 ABCC9,导致顺铂排出细胞而减少药物积蓄,增强肿瘤细胞对顺铂的耐药性。此外,ALKBH5 在口腔鳞状细胞癌中通过促进 FOXM1 和 NANOG 表达从而上调顺铂抗性细胞系中的 CSC 群体可增强顺铂耐药性。尽管目前在 m6A 甲基化影响 OS 化疗耐药领域研究成果匮乏,但m6A 甲基化很可能成为降低 OS 化学耐药性的靶点已毋庸置疑,可以依据 m6A 甲基化对其它肿瘤耐药的调节,窥见其对 OS 化疗耐药的作用,为研究其机制提供思路。有研究指出 Wnt-β-catenin 信号通路的上调有利于抵抗 OS 化疗中使用的阿霉素、顺铂和甲氨蝶呤,因此,m6A 甲基化可能调控经典或非经典 Wnt 通路中的关键分子以控制Wnt-β-catenin 途径水平,从而调节 OS 细胞化疗耐药性。此外,发现可能通过 m6A 水平升高促使化学耐药性癌细胞中雌激素相关受体 ERRγ pre-mRNA 的剪接与蛋白表达,进一步与 ABCB1 ( 药物外排的重要的 ABC 膜转运体 )的启动子结合以增强其转录,降低药物储蓄;ERRγ 或通过调节脂肪酸氧化限速酶 CPT1B 以上调此过程,抑制细胞凋亡,从而增强癌细胞的耐药性。而 ERRα 能够通过调节 ABCB1 的转录和 mRNA 稳定性来调节 OS 细胞对阿霉素和顺铂的耐药。可以合理推测 m6A 也可影响 ERRα的表达而调节 OS 细胞化学耐药。针对以上发现,可以对m6A 是否参与调控 Wnt 通路以及 ERRα mRNA 的 m6A 水平对其表达的影响继续研究。此外,m6A 甲基化是否影响 OS 细胞外排转运化疗药物、调节药物靶标水平、控制药物降解以及影响 OS 干细胞产生等有待进一步筛选与研究,以填补 m6A 对 OS 化疗耐药性调控方面的空白。
四、m6A 与 OS 免疫治疗
肿瘤免疫治疗是指通过激活或增强机体免疫功能和免疫反应来杀灭肿瘤细胞和肿瘤组织,包括基于程序性细胞死亡蛋白 1 ( PD-1 ) 及配体 PD-L1 的免疫检查位点阻断疗法 ( ICB 疗法 )、细胞因子疗法、治疗性肿瘤疫苗等。其中PD-1 主要表达于 CD8T 细胞、B 细胞、NK 细胞等免疫细胞的细胞膜,与配体 PDL1 结合可抑制 T 细胞的活化,从而引起肿瘤及其微环境的免疫耐受。研究表明 OS 细胞系中 PD1 / PDL1 表达上调,并与转移肿瘤的发生正相关。针对 PD-1 / PD-L1 的抑制剂,可增加内源性抗肿瘤的活性,在转移性 OS 小鼠模型中,联合抗细胞毒性 T 淋巴细胞抗原 4 ( CTLA-4 ) 可进一步增强 T 细胞功能。
现有研究结果表明,m6A 参与了抗病毒效应及免疫调节通路中免疫细胞的分化与成熟 ( 图 1d ),因此 m6A 调节剂或可干预肿瘤临床免疫治疗。例如,缺乏 METTL3 可高度特异性诱导干扰素刺激基因;缺乏 YTHDF1 促进了树突状细胞 ( DC ) 上肿瘤抗原的交叉呈递,改善了 PD-1抑制剂的治疗效果;缺乏 YTHDF3 的小鼠在病毒感染后 IFN-α 和 INF-β 表达量增加;WTAP 的表达与 T 淋巴细胞浸润显著相关,从而抑制免疫细胞的产生;在敲除黑素瘤小鼠模型中 m6A 去甲基酶 ALKBH5 和 FTO 可增强抗PD-1 抗体免疫治疗的效果,延长小鼠的生存时间。目前,m6A 在 OS 免疫治疗中的研究还很少,但可依据 m6A对其它肿瘤免疫治疗影响的思路,从 m6A 修饰相关酶对抗原的交叉呈递,免疫细胞的增殖、分化、成熟,肿瘤微环境物质代谢,肿瘤浸润免疫细胞种类与水平,免疫治疗检查点以及治疗性肿瘤疫苗与佐剂的效用等方面着手,继续研究 m6A 的具体作用,从而可以通过 m6A 靶点增强 OS免疫治疗,并利用修饰靶点的 m6A 水平建立模型以评估治疗效果。
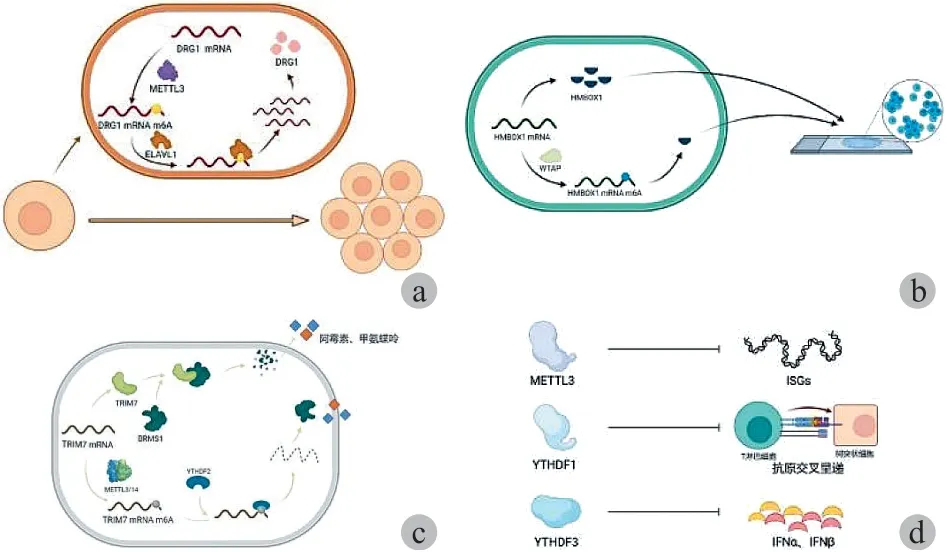
图1 m6A 在 OS 中的功能 a:m6A 对 OS 的发生发展;b:m6A对 OS 患者的预后;c:m6A 对 OS 的化疗耐药;d:m6A 对 OS 的免疫治疗Fig.1 Functions of m6A in OS a: m6A on OS occurrence and development; b: m6A on OS prognosis; c: m6A on OS chemoresistance; d: m6A on OS immunotherapy
五、m6A 与 OS 预后
癌细胞可以通过转录因子重编程、上皮 - 间充质转化、缺氧和化疗等多种方式重编程到原始癌细胞状态造成预后不良。研究表明 m6A 也可以通过上述方式与 OS 预后不良显著相关。例如,FTO 的低表达可能通过体液免疫反应和细胞周期途径与 OS 不良预后相关。Li 等表明,多种 m6A 相关基因的异常调控可能促进有丝分裂和G2M 检查点通路,从而导致 OS 预后不良。Wang 等探讨了数个 m6A 调控基因 ( 但不包括 FTO 和 METTL14 ) 的表达水平与 88 例 OS 患者无转移生存率之间的关系。结果表明,在 OS 患者中,高水平的 METTL13、ALKBH5、FZD8、KLF4 和低水平的 BMP2 和 SMAD5,倾向于与更差的无转移生存率相关。这表明 m6A 修饰相关酶可以作为OS 预后的标志,帮助临床检测评估与针对治疗。
六、总结与展望
目前,对 m6A 甲基化修饰在 OS 中的研究日益加深,各项研究均表明 m6A 通过影响细胞增殖分化、细胞信号通路、细胞耐受和细胞凋亡而调控 OS 的发生、转移和耐药。笔者在总结 m6A 修饰相关酶基本功能及其对 OS 发生发展、治疗与预后影响的基础上,整理了 m6A 对 OS 化疗耐药、免疫治疗、预后方面的调控,在当前相关研究较少的情况下,提供了开展深入研究的建议与思路。实际上,除 OS 外,还有许多骨组织疾病,如骨质疏松、骨关节炎、类风湿关节炎等都被认为与 m6A 相关,为 m6A 在骨组织中的调控提供了研究思路,m6A 在其它多种肿瘤中的调控也给出更多研究方向。Wang 等分析了 OS 干细胞的 m6A 甲基化组,鉴定出 OS 干细胞中一些 m6A 相关酶的表达及多重耐药 OS 细胞系中 2372 个高甲基化和 3229个低甲基化 m6A 峰,有望成为 OS 的新治疗靶点。但一方面,对 m6A 酶系统的作用机制仍有待探索,例如,有研究发现 YTH 家族的多个成员可结合 m5C、m1A 调控下游基因表达,因此,YTH 家族是否均可归属与 m6A 酶系统有待进一步证实;另一方面,尽管大量研究已经证实多种 m6A 调控因子可作为 OS 的潜在生物标志物,但由于m6A 的动态可逆性,其特异度和敏感度较低,难以通过临床验证。因此,将 m6A 研究成果应用于临床治疗尚存距离。进一步了解 m6A 对 OS 的调控机制及其表达特性,有助于开发具有高度选择性靶向 m6A 及相关蛋白质的药物,并对于 OS 的早期诊断和预后判断具有重要意义。期待随着研究的深入和医疗技术的发展,RNA m6A 甲基化修饰可以成为 OS 诊断与治疗的重要理论基础。

