软组织颗粒细胞瘤的临床特点
颗粒细胞瘤是非常罕见的肿瘤,来源于施万细胞,大部分为良性,少数为恶性。最早由 Abrikosoff
于 1926 报道。好发于口腔、舌等头颈部位。位于肢体软组织的颗粒细胞瘤更为少见,此前的报道多数为个案报道,其临床上诊治尚有疑难之处。现报道10 例位于肢体软组织的颗粒细胞瘤,供同道参考。
资料与方法
资料来源于我院骨肿瘤科数据库。2007 年 1 月至 2021 年 1 月,我院经手术治疗 10 例肢体软组织颗粒细胞瘤患者。
栽培果树的总目标是要实现速生、早产、丰产、稳产、优质、寿命长和效益高。而实现这些目标,必须紧紧抓住5个环节:①良种是前提,是丰产优质的内因;②立地是基础条件,劣质荒脊地、低洼易涝地勿用;③防治病虫是“治安保卫”“质量监督”,防患于未然;④整形修剪是“树冠组织”工作,有利于达到早产、高产、稳产的目的;⑤肥水是“后勤供给”工作,足则丰产稳产,缺则欠而不稳。五环缺一不可,这就是总则。
患者的病史、影像、手术资料、术后病理重新进行复习。影像记录肿瘤的部位、大小、筋膜深浅层以及 MRI 的信号特点,病理由我院病理科 2 位高年资医师确认。
患者就诊后,完善影像学检查,包括 MRI 和超声,再进行穿刺活检,病理确诊后,根据术前 MRI设计切除边界进行切除。术后标本进行剖面大体观察,判断切除边界。所有标本进行术后病理分析。所有患者术后定期进行随访,随访时间均 > 6 个月。
结 果
一、临床特点
内保温外墙的构建一般保护墙体主体以及保温结构两部分。在主体选材上,混凝土以及砖砌是目前主要使用的材料。而在保温结构的布局上,一般采用一些保温板来进行设置,同时也有一部分会进行空气层的规划。
既往文献报道,该肿瘤好发于中年人,平均年龄在 35~50 岁,女性多发
。本研究病例的平均年龄 46.5 岁,与文献报道一致。多数患者表现为局部肿块,进展缓慢,本研究患者的病程最长 10 年,与多数良性软组织肿瘤的表现一致。本组 1 例恶性患者,其病程相对较短,为 12 个月,且发现后,肿块在持续增大,可能提示其恶性潜能。
二、肿瘤的影像学表现
颗粒细胞瘤罕见,多数发生在口腔等头颈部,而位于肢体软组织的肿瘤,即使在骨与软组织肿瘤科也是非常少见。此前,全世界报道约在百例左右,且多数为一两例的个案报道。超过 3 例及以上的临床病例报道不过十来篇
。而肢体软组织恶性颗粒细胞瘤的病例更为罕见,因此急需更多的病例报道,以便更好的诊治该肿瘤。本组 10 例中 1 例为恶性,在术前 MRI 影像、病理、手术治疗方面更好地阐述该肿瘤规范的诊治方案。
三、治疗与随访
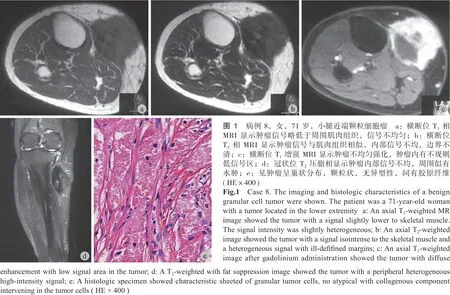
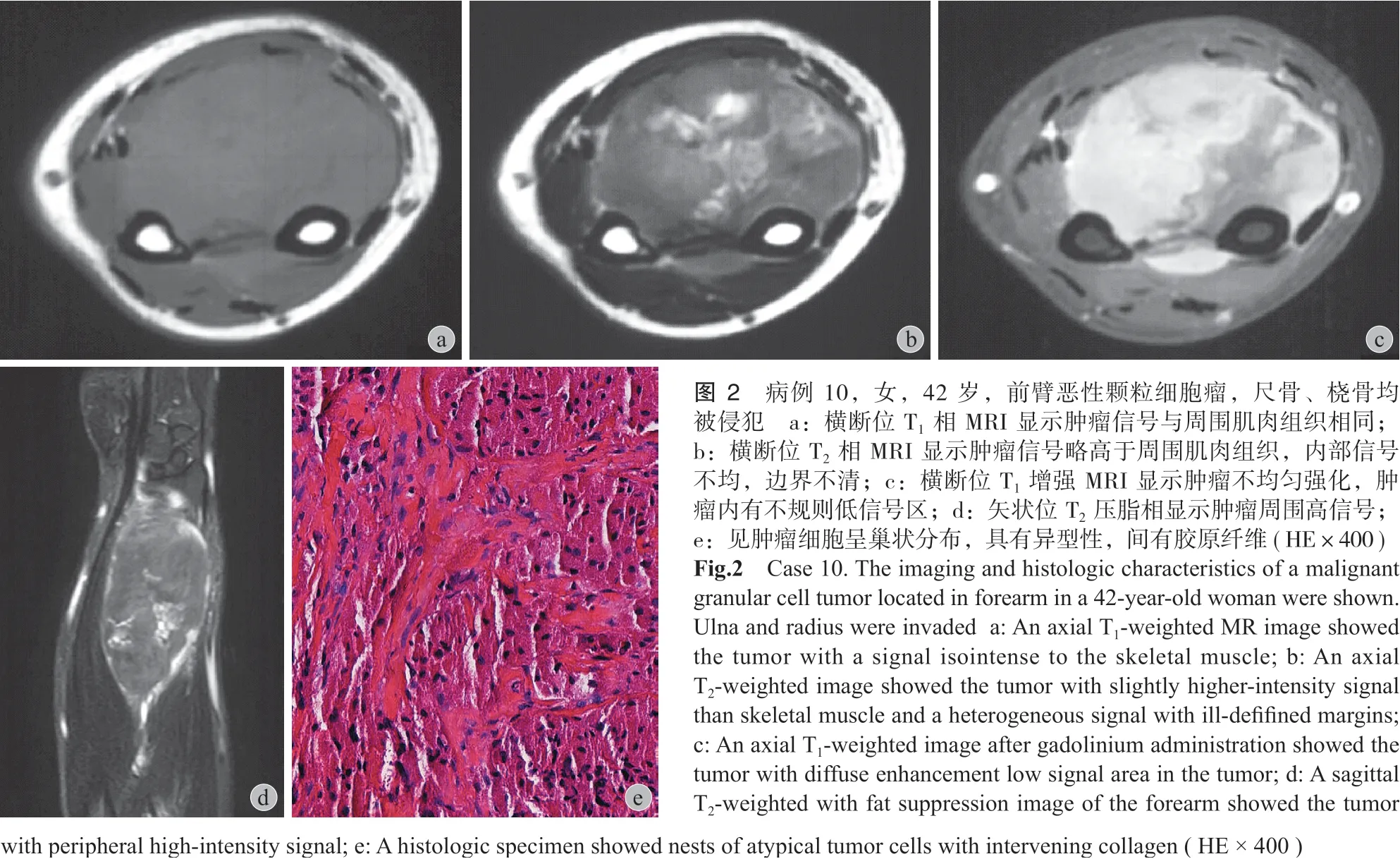
本组 10 例,完善影像学检查后,术前病理均为颗粒细胞瘤,未见恶性。10 例均行手术切除,切除后的标本进行剖面分析,6 例达到广泛的切除边界,4 例因肿瘤临近神经、血管或者紧贴骨面,只达到边缘切除边界。10 例瘤体切除后,伤口均顺利愈合,无围术期并发症发生。10 例中 8 例术后病理为良性颗粒细胞瘤,1 例为不典型颗粒细胞瘤,位于大腿,筋膜浅层,1 例为恶性颗粒细胞瘤,肿瘤最大径 121 mm,位于前臂深筋膜深层。
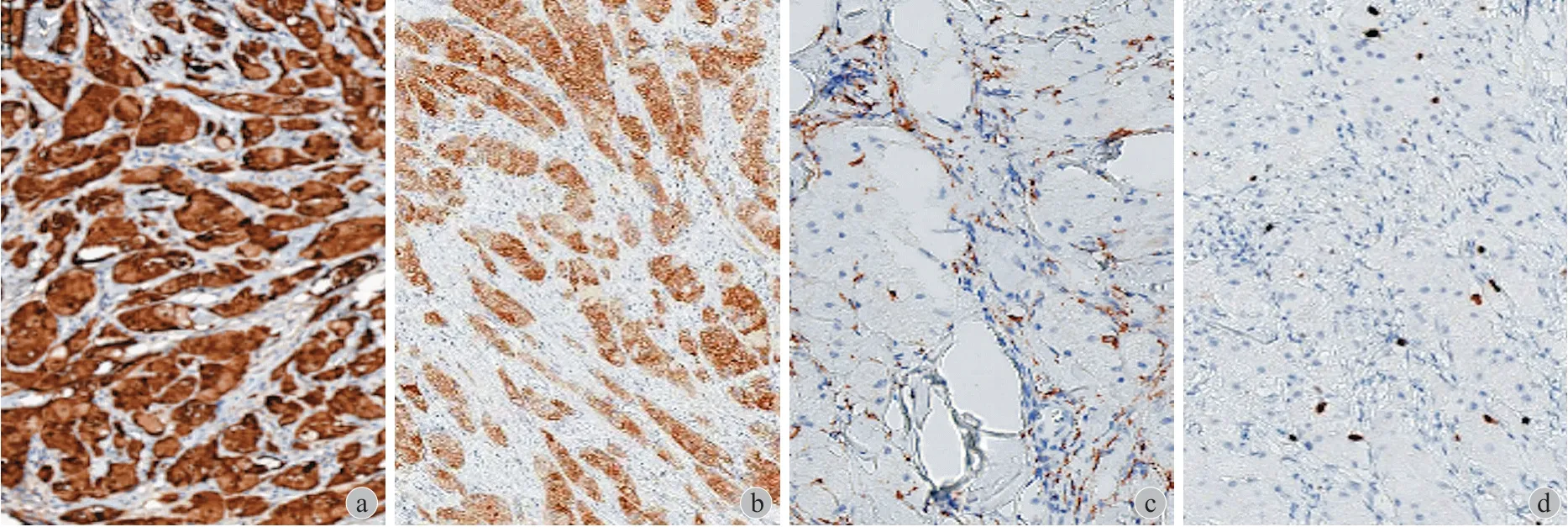
本组 10 例中,男 4 例,女 6 例,年龄 33~71 岁,平均 46.5 岁。患者症状主要为局部软组织肿块,无明显疼痛,缓慢长大,病程 1~120 个月,平均 26.3 个月。3 例位于大腿,3 例位于前臂,1 例位于小腿,1 例位于腘窝,1 例位于腰部,1 例位于前胸壁。4 例位于深筋膜浅层,6 例位于深筋膜深层。瘤体 18~121 mm,平均 52.0 mm ( 表 1 )。
本组 10 例术后随访 7~169 个月,平均 68 个月,随访包括门诊复诊、电话随访。1 例恶性患者术后嘱其密切随访,每 3 个月复诊 1 次。术后 31 个月复查时,发现复发,行截肢术。至目前为再次术后 34 个月,未见复发和转移。其余 9 例未见复发和转移。
四、肿瘤的病理特点
在公路的建设方面,路政部门要修建和改善路面条件,力求路面笔直平整,如遇弯道,外侧路面高于内侧路面可以使重力的一部分充当了转弯的向心力,从而缓解了只由摩擦力提供向心力的压力;及时更换磨损的轮胎;购买配置了ABS、ESP等安全防护系统的车辆优于普通车辆[11]。
术前 MRI 对于颗粒细胞瘤的诊断有较大的参考价值,也是目前常用影像诊断方法。文献报道,在 T
相 MRI 上,颗粒细胞瘤的信号与肌肉相似,而 T
相上,其信号略高于肌肉,但低于脂肪的信号,并且可见到肿瘤信号混杂,在肿瘤的周边信号较高,而中心信号相对较低。周边高信号,有学者认为是由于肿瘤周边的炎症较重并有淋巴结细胞浸润有关,而内部混杂的信号,则是由于在肿瘤细胞间混杂了纤维成分,这在病理切片中可以明确观察到
。这些表现在筋膜深层的肿瘤表现得更明显,而位于皮肤和深筋膜浅层的肿瘤则表现的不典型。本组 8 例良性和 1 例不典型颗粒细胞瘤患者均表现出上述特点,边界不清,呈一定的侵袭性。增强后,肿瘤有不同程度的强化,与文献报道一致。而其它常见的软组织肿瘤,常表现在 T
相上低信号而T
高信号,且内部通常无低信号区域。鉴于上述特点,仔细分析术前 MRI 影像,对患者的诊断有一定的帮助。本组 1 例恶性颗粒细胞瘤,其术前 MRI 除了有上述特点之外,增强后,肿瘤有不均匀强化,临近肿瘤的桡骨,可见明显的骨膜反应,提示其生长潜能,肿瘤周围组织有较强的炎症反应,需要充分考虑其恶性可能。
讨 论
本组 10 例,术前均行 MRI 检查,典型的核磁信号:软组织占位,患者肿瘤与周围组织边界不清,呈浸润性生长。与周围的肌肉相比,肿瘤在 T
相呈等信号、低信号,在 T
相呈等信号、高信号,在压脂 T
相上呈不均高低混杂信号,肿瘤周边可见水肿。T
相增强后,可见肿瘤有不同程度的强化,肿瘤内可见不规则低信号区。1 例恶性患者,其肿瘤与尺桡骨临近,刺激尺桡骨出现骨膜反应 ( 图 1,2 )。
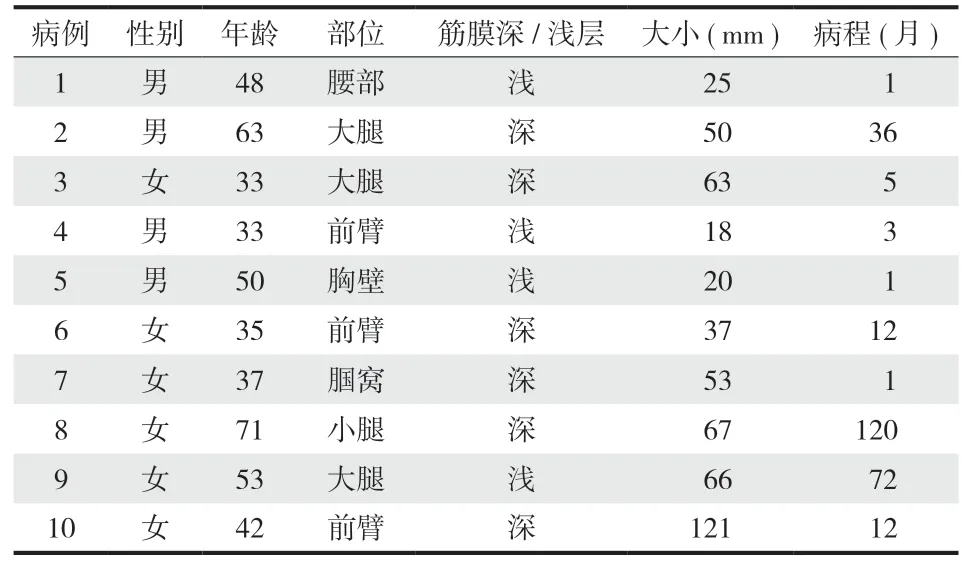
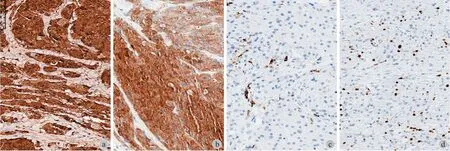
本组 10 例,8 例为良性,典型的病理表现为肿瘤侵袭性生长,与周围组织边界不清,甚至侵犯周围正常组织。肿瘤有较薄包膜或无明显包膜,肿瘤细胞大小较一致的,胞浆较宽,细胞嗜酸性,颗粒状,伴有多少不等的单核、多核组织细胞样细胞和纤维细胞。肿瘤细胞呈巢状分布,间有多少不一的胶原纤维。肿瘤周围组织可有炎性反应,有淋巴细胞浸润。免疫组化:S-100 及 NSE 所有均为阳性,CD68 在 7 例呈阳性,1 例阴性,Ki-67 低于 5%( 图 3 )。
一、临床特点
“我由此猜想李卫中同志一定是与党有关系的人,便向他提出找到并加入中国共产党组织的请求。他当即答应帮助我。” 1947年 8月2日,李卫中正式介绍汤甲真加入中共地下党,并嘱咐他如何保守党的秘密等。
膨润土浸水自由膨胀后,结构变得十分蓬松,由于压汞试验中要求试样脱湿干燥,即使通过液氮冻干的方法处理,也难免对孔隙结构造成扰动。而核磁共振技术以水分子作为测定媒介,可以捕捉孔隙内部氢质子的共振信号,从而能推测饱和状态下的试样孔隙分布状况。因此,选择核磁共振方法具有明显的优势。自由膨胀后的试样孔隙分布特征如图7所示。
1 例不典型颗粒细胞瘤患者,病理除上述特点外,还可见肿瘤坏死。但无明显的细胞异型性、无核分裂相等恶性表现。1 例恶性患者,除了上述特点,还有明显的肿瘤坏死、明显核仁出现,且可见核分裂像,肿瘤 Ki-67 为 15% ( 图 4 )。
术前病理对于诊断有重要作用。病理提示肿瘤包膜较薄或无包膜,部分呈浸润性生长,肿瘤细胞呈巢状分布,间有纤维间隔,细胞呈嗜酸性,无明显细胞异型性。免疫组化显示 S-100 及 NSE 阳性,这些表现与文献报道一致
。本组 1 例术前诊断良性,而术后病理提示恶性,显示肿瘤的不均一性,并且提示肿瘤的病理诊断较为困难,容易误诊。恶性颗粒细胞瘤占颗粒细胞瘤的 0.5%~2.0%,具有较高的复发、转移潜能。有学者认为恶性颗粒细胞瘤的诊断需考虑以下方面:肿瘤坏死、梭形细胞、泡状核且核仁明显、核分裂像增加 ( 每高倍镜视野超过 2 个核分裂 )、高核质比以及明显的细胞异型性
。符合上述 6 个标准例的 3 项即可诊断恶性,而符合 1~2 项的则诊断为不典型颗粒细胞瘤,无上述特点的则可诊断良性,行完整手术切除后,其复发率、转移率均较低。
但 Fanburg-Smith 未对上述 6 个方面提出具体的定义,因此其诊断与病理科医师的个人判断有很大关系
。尽管如此,上述诊断标准仍是目前较为可靠的标准。本组 1 例恶性颗粒细胞瘤,术前病理考虑良性,术后大体病理有明显的肿瘤坏死、明显核仁出现,且可见核分裂像,肿瘤 Ki-67 为 15%,考虑恶性。因术前穿刺病理为良性,未行截肢术。因肿瘤累及尺桡骨,切除边界只达到边缘切除,术后出现复发。因此,对于瘤体较大 ( 直径 > 5 cm ),筋膜深层,短期迅速长大的患者
,病理检查时要考虑其恶性可能,避免切除边界不够导致的复发。
二、颗粒细胞瘤的治疗
手术切除是目前治疗颗粒细胞瘤的主要方法。鉴于上述的影像学特点,颗粒细胞瘤的包膜较薄,与周围组织界限不明显,有的肿瘤可能浸润至周围正常肌肉组织,加上前述良性与恶性颗粒细胞瘤的鉴别诊断较为困难,手术宜行广泛的切除边界。但在某一些部位的肿瘤,临近重要的神经血管结构,广泛的手术切除较为困难。本组中有 4 例就因肿瘤临近神经、血管和骨骼,只达到边缘切除边界。1 例恶性患者术前诊断良性,手术为边缘切除边界,术后病理诊断恶性颗粒细胞瘤。该患者第一次手术后出现复发,行截肢手术。因此对于一些进展较快、肿瘤较大的患者,即使术前病理为良性,手术切除仍宜与恶性肿瘤一样设计广泛切除边界
。对于复发患者,如有保肢条件,手术宜进行广泛切除,术后可进行辅助放疗以降低局部复发
。对于累及重要结构,保肢手术无法达到广泛切除边界的,宜进行截肢术
。
总之,分析本组 10 例肢体软组织的颗粒细胞瘤患者的临床、影像、病理特点。笔者认为:( 1 ) 术前 MRI 是诊断颗粒细胞瘤的主要影像学工具。根据其信号特点,如侵袭性生长,低 T
高 T
信号,病灶内信号混杂,周边 T
相高信号等对于肿瘤的判断有一定帮助。( 2 ) 术前病理是诊断的主要依据,既往文献对恶性颗粒细胞瘤的诊断虽有一些描述,但其诊断终究较为困难。因此,对于可疑诊患者宜转诊到专业的骨与软组织肿瘤中心行进一步的诊治。( 3 )对于直径较大、进展较快且位于深筋膜的肿瘤,病理诊断要充分考虑其恶性可能。不管术前是良性还是恶性颗粒细胞瘤,由于其与周围正常组织边界不明显,手术均宜进行广泛的切除以降低复发率。对于复发或者恶性颗粒细胞瘤患者,广泛切除后须辅以放疗,以降低肿瘤的复发可能,改善其预后。
与文献报道相比,本组 10 例,已为大宗报道,但绝对数量仍然较少,在患者复发、转移等方面较难进行分层分析。此外,本组 10 例颗粒细胞瘤中,只有 1 例恶性患者,对恶性颗粒细胞瘤的影像、病理、临床特点方面难以做深入的分析。因此,企望进行多中心研究,以纳入更多的病例,对颗粒细胞瘤进行进一步的分层分析,以提出对良、恶性颗粒细胞瘤鉴别诊断的依据。
[1] Abrikossoff AI . Uber myome ausgehend vonder quergestreiften willkurlichen muskulatur[J]. Virchows Arch, 1926, 260(1):215-233. DOI:10.1007/BF02078314.
[2] Arai E, Nishida Y, Tsukushi S, et al. Intramuscular granular cell tumor in the lower extremities[J]. Clin Orthop Relat Res, 2010,468(5):1384-1389. DOI: 10.1007/s11999-009-1085-2.
[3] Blacksin MF, White LM, Hameed M, et al. Granular cell tumor of the extremity: magnetic resonance imaging characteristics with pathologic correlation[J]. Skeletal Radiol, 2005, 34(10):625-631. DOI: 10.1007/s00256-005-0925-8.
[4] Marcoval J, Bauer-Alonso A, Llobera-Ris C, et al. Granular cell tumor: a clinical study of 81 patients[J]. Actas Dermosifiliogr(Engl Ed), 2021, 112(5):441-446. DOI: 10.1016/j.ad.2020.11.012.
[5] Chaudhry IH, Calonje E. Dermal non-neural granular cell tumour (so-called primitive polypoid granular cell tumour):a distinctive entity further delineated in a clinicopathological study of 11 cases[J]. Histopathology, 2005, 47(2):179-185.DOI: 10.1111/i.1365-2559.2005.02192.x.
[6] Elkousy H, Harrelson J, Dodd L, et al. Granular cell tumors of the extremities[J]. Clin Orthop Relat Res, 2000, 380:191-198.DOI: 10.1097/00003086-200011000-00026.
[7] Morrison JG, Gray GF Jr, Dao AH, et al. Granular cell tumors[J]. Am Surg, 1987, 53(3):156-160. DOI: 10.2500/105065894781874412.
[8] Smith SB, Farley MF, Albertini JG, et al. Mohs micrographic surgery for granular cell tumor using S-100 immunostain[J].Dermatol Surg, 2010, 28(11):1076-1078. DOI: 10.1046/j.1524-4725.2002.02087.x.
[9] Ordonez, Nelson G, Mackay, et al. Granular cell tumor:a review of the pathology and histogenesis[J]. Ultrastruct Pathol, 1999, 23(4):207-222. DOI: 10.1080/019131299281545.
[10] Fanburg-Smith JC, Meis-Kindblom JM, Fante R, et al.Malignant granular cell tumor of soft tissue: diagnostic criteria and clinicopathologic correlation[J]. Am J Surg Pathol, 1998,22(7):779-794. DOI: 10.1097/00000478-199807000-00001.
[11] Nasser H, Ahmed Y, Szpunar SM, et al. Malignant granular cell tumor: a look into the diagnostic criteria[J]. Pathol Res Pract,2011, 207(3):164-168. DOI: 10.1016/j.prp.2010.12.007.
[12] 王坚, 朱雄增, 张仁元. 恶性颗粒细胞瘤 10 例临床病理学观察及文献复习[J]. 中华病理学杂志, 2004, 33(6):497-502.DOI: 10.3760/j.issn:0529-5807.2004.06.001.
[13] Tsuchida T, Okada K, Itoi E, et al. Intramuscular malignant granular cell tumor[J]. Skeletal Radiol, 1997, 26(2):116-121.DOI: 10.1007/s002560050204.
[14] Crety CM, Garbar C, Madelis G, et al. Adjuvant radiation therapy for malignant Abrikossof’s tumor: a case report about a femoral triangle localisation[J]. Radiat Oncol, 2018, 13(1):115-119. DOI: 10.1186/s13014-018-1064-4.

