介入治疗在血管通路并发症中的应用
卞雪芹 综述 叶 红 审校
慢性肾脏病(CKD)的发病率和患病率逐年增高,由其导致终末期肾病(ESRD)人数持续增加,预计到2030年全球接受肾脏替代治疗的人数将达到543.9万[1]。维持性血液透析(MHD)是ESRD患者最主要的肾脏替代疗法,良好的血管通路是MHD顺利进行的重要保证和“生命线”。
自体动静脉内瘘(AVF)、移植物动静脉内瘘(AVG)及带隧道和涤纶套的透析导管(TCC)是MHD常用的三种血管通路[2]。血管通路并发症已成为血液透析(HD)患者仅次于心血管系统疾病的住院重要原因[2],而通路的质量直接影响患者的透析和生存质量[3]。 血管狭窄是血管通路最常见并发症,血管重塑和内膜增生是其重要发病机制[4-5],血管腔内介入治疗在血管通路相关并发症的应用越来越广泛[6]。
常用的介入技术
经皮腔内血管成形术(PTA)PTA是利用球囊压力对血管内狭窄部位进行扩张,是多数血管通路狭窄病变的首选疗法。早在1982年,Gordon等[7]首次报道了PTA在透析用血管通路中的应用,且手术成功率为100%。PTA具有较高的安全性和易操作性,PTA后残存狭窄<20%表明扩张效果满意,如果反复扩张后残存狭窄仍然>30%提示需要更高压力的球囊才能达到治疗效果[2]。血管内膜增生引起的静脉狭窄以血管局部平滑肌细胞增殖引起的同心增厚和管腔直径减小为特征,反复PTA刺激血管内膜增生则加重了其再狭窄的发生[8]。普通高压球囊在解决一些顽固性狭窄时仍具有一定的局限性。因此,临床需求决定了产品的开发,目前用于血管通路血管成形常用球囊有普通球囊(POBA)、高压球囊(HPB)、切割球囊(CB)以及药物涂层球囊(DCB)等,需要术者根据病变的具体特征从而选择不同的球囊。
PTA可在超声或数字减影血管造影(DSA)引导下进行。2015年,《欧洲超声介入(INVUS)治疗指南》指出,INVUS可用于全身多部位血管通路病变的介入治疗[9]。与DSA相比, INVUS对设备和场所要求较低,在一般手术室或操作间即可开展。此外由于二维显像局限性,DSA可能会漏诊部分狭窄病变,而超声在灵活扫描切面的同时可显示血流及血管内外结构的更多细节。PTA时需要选择合适的穿刺点入路操作,对于一些困难血管的穿刺,超声可实时引导、精准定位,减少穿刺相关并发症。PTA过程中最常见的并发症为导丝、导管鞘穿透血管壁引起的血管破裂,超声引导则容易发现此类并发症。当然,超声也有其局限性,由于肋骨、肺部气体的影响,超声无法诊断及辅助处理中心静脉病变,仅可用于外周血管病变的治疗。
关于PTA时球囊大小、工作压力、作用时间一直是临床医生探讨的问题,一项随机对照试验中,延长PTA的工作时间,临床即刻效果更好,然而6个月的开放率并无明显优势[10]。长期以来,关于球囊大小的选择一直主张渐进式增大而非初始就是用大直径的球囊治疗,然而目前关于此部分仍然缺乏大量的临床随机研究结果。
经皮支架植入术(PTS)PTS为解决血管狭窄、破裂等并发症及其他血管通路相关问题拓展了新的思路。最新国内外指南和共识建议支架植入的适应证[11]:(1)中心静脉狭窄在PTA中出现急性弹性回缩(管腔残存狭窄>50%)和3月内反复发生的狭窄(管腔残存狭窄>30%);(2)复发性AVG静脉吻合口狭窄;(3)病变部位无法行外科手术,如AVF头静脉弓的狭窄;(4)AVG和AVF支架内再狭窄。基于患者的ESRD生存计划,支架植入应充分考虑对未来通路选择的影响[2]。
支架类型包括自膨式支架和球扩式支架,血管通路中使用较多的是自膨式支架。第一代自膨式支架为金属裸支架(BMS),第二代自膨式支架由镍钛合金制成,而第三代支架为表面覆盖可降解或不可降解的聚合物薄膜的金属支架, 即覆膜支架(CS),目前市售的CS有3种类型,支架内表面覆盖材料的金属支架(Viabam)和外表面覆盖材料的支架(Fluency)及内外表面均有覆盖材料的支架。CS应用于HD血管通路早在1996年就有文献报道[12],由于其能够提供相对稳定及不易变化的血管腔体从而降低再狭窄的发生。近年来逐渐广泛应用于临床,尤其是合并长段狭窄或者特殊解剖部位的狭窄,例如近心端腋静脉、头静脉弓等。CS覆盖物能够减少内膜增生的影响,因此其再狭窄发生率显著低于BMS。
DSA下的支架植入技术对于支架的规格和术者的技巧都有较高的要求,为避免支架置入后的移动及脱位,临床专家建议用于静脉移植物的支架应大于原始尺寸20%~ 30%,同时支架成功放置后,为了使支架与血管壁贴合及展开CS内覆盖物,可予以同等大小球囊轻轻地扩张支架从而优化血管管腔。
介入技术的应用
动静脉内瘘成熟不良动静脉内瘘成熟不良是内瘘早期失功的主要原因,内瘘成熟不良往往合并血管狭窄。早期对于内瘘成熟不良的处置主要有延长内瘘成熟的等待时间、重建血管通路等方法。近年来,PTA技术逐渐应用于内瘘成熟不良的治疗,无论是近吻合口狭窄、静脉流出道狭窄还是流入道动脉狭窄的处理。研究显示[13],PTA可以显著提高内瘘早期的成熟,其技术成功率和临床成功率分比为98%和89%,与外科手术相比,两者远期开放率并无显著差异。
中心静脉狭窄(CVS)CVS或中心静脉闭塞(VO)是HD患者常见且严重并发症,发病率为25%~40%,病变多位于无名静脉及锁骨下静脉。目前指南推荐CVS的治疗首选PTA。PTA应用于中心静脉疾病治疗的报道最早见于30年前,由于中心静脉狭窄病变程度及闭塞时间长短不同,同时研究者的评价方法、技术手段及设备不同,因此关于PTA在中心静脉病变处理中的临床成功率和技术成功率都不完全一致。中心静脉病变PTA术后远期开放率也并不理想,有研究报道PTA 后的血管新生内膜及增生性病变比原始狭窄中更严重,因此建议无症状的 CVS 不宜积极行PTA[14]。
CVS 在PTA后狭窄未解除或术后3月内狭窄再发,指南建议放置支架同时需要密切随访[2,15]。既往研究数据表明[16],在反复PTA失败的病变中使用支架具有一定的优势,然而静脉内PTS也有许多局限性,如支架迁移、破裂、支架内内膜增生等。尽管存在上述缺点,PTS在难治性血管通路病变的治疗中仍具有积极的临床意义,可即时开通、即刻使用。对于 PTA 及 PTS 均失败的 CVS 患者,必要时需要采用外科手术治疗。
内瘘吻合口及外周静脉流出道狭窄吻合口及外周静脉流出道狭窄是导致内瘘失功的主要原因。目前PTA是处理上述病变的常规治疗手段。Bountouris等[17]采用PTA治疗AVF狭窄患者,6月初级开放率为61%,12月次级开放率可达89%。在PTA靶病变部位出现血管回缩及新生内膜增生是导致内瘘狭窄再发生的主要机制,因此,PTA虽然具有一定的治疗优势,但其远期疗效并不乐观,为提高疗效,众多研究者尝试使用各种不同类型的球囊或支架来治疗顽固性或周期性静脉流出道狭窄,例如DCB、CB和CS,并对其临床疗效进行比较。
Yildiz等[18]将DCB用于AVF静脉流出道病变中,其6月的初级开放率高于HPB组(96.9%vs20.3%,P<0.001),而两组9月和12月的初级开放率相近。在治疗AVG狭窄方面,Haskal等[19]研究结果提示使用CS 6月后靶病变初级开放率高于PTA组(51%vs23%,P<0.001)。Saleh等[20]观察到CB组6月、12月的初级通畅率(86%、63%)显著高于对照组(56%、37%)。且在静脉吻合口狭窄亚组中,CB组6月、12月的次级通畅率分别为(84%、55%),显著高于常规高压球囊。可见在治疗静脉吻合口狭窄上,CB的开放效果更好,这主要归功于其对新生内膜弹性纤维层的切割作用。对于反复发生的狭窄,我们建议使用足够长的CS来覆盖其边缘附近的静脉瓣膜防止支架内再狭窄的发生[21],同时还需兼顾支架的尺寸对非病变血管部位功能的影响,例如因支架过大导致有效管腔变小,从而影响静脉回流等问题。随着医学科技的进步以及生物医学工程的发展,未来一定会出现更多新型支架为血管通路带来更长久的远期开放率。
头静脉弓狭窄头静脉弓指头静脉与腋静脉汇合共同形成锁骨下静脉之前在肩部弯成的弓形结构,由于其特殊解剖结构和内瘘血流动力学的影响,此处极易发生狭窄,且常规PTA对头静脉弓狭窄的疗效不佳,影响其疗效的主要障碍为病变部位短期内再狭窄、通路开放率低及术中血管破裂。Rajan等[22]研究提示在处理头静脉弓狭窄中,CS的疗效显著优于HPB,其3月、6月、12月的通畅率分别如下:HPB组为60%、0和0,CS组为100%、100%和29%(P<0.01)。既往研究[23]提示支架在头静脉弓狭窄中的积极作用,但是其操作要求较高,主要包括支架规格种类的选择以及手术技巧的要求。特别是与腋静脉的交界处,支架的前缘应覆盖病灶,但不可破坏腋静脉及锁骨下静脉的完整性。同时支架尾部移植物边缘需延伸至健康血管,否则新的边缘狭窄肯定会延伸,需要重复血管成形术或额外的支架移植物向周围扩展。
假性动脉瘤假性动脉瘤主要是由于反复定点穿刺、内瘘过早使用及内瘘近心端的狭窄而导致血管膨大。 通常情况下假性动脉瘤不需要紧急处理, 应根据病变部位覆盖皮肤的完整性以及瘤体增大程度决定是否干预。对于有症状、体积迅速增大、有破裂风险的需要积极处理。外周静脉流出道游狭窄所致的静脉瘤样扩张,不宜支架植入,可参考外周静脉狭窄的处置方法。移植物内瘘中形成的假性动脉瘤,非感染、皮肤破溃的情况下可使用支架植入。Schmelter等[24]评价CS治疗AVG和AVF合并假性动脉瘤、血管破裂时发现,6月、12月、24月的一期通畅率分别为45.5%、31.3%、19.2%,由于支架内仍可发生再狭窄和血栓形成,其远期通畅率仍有待更多的大型临床研究结果。
血管通路介入技术的展望
随着新技术、器材的出现,真正的血管通路“腔内时代”已经到来。在血管通路建立方面,腔内AVF成型术(EndoAVF)已应用于临床[25]。与外科开放手术相比,EndoAVF具有独特的优势,可最大限度地减少术中操作对血管内膜的损伤。目前,EndoAVF有两种系统:Ellipsys和EverlinQ。Ellipsys是一种在超声引导下的单导管系统,使用热量和压力促进血管吻合以建立内瘘。其3月、6月和12月的次级通畅率分别为91.6%、89.3%和86.7%,约72%的患者需要PTA促成熟[26]。EverlinQ在超声或X线透视引导下放置于动脉和静脉的双导管系统,通过激活磁体对齐导管,使用射频能量创建内瘘。FLEX前瞻性研究结果显示EverlinQ构建AVF成功率达97%,6月通畅率96%[27]。尽管EndoAVF短期内证明了安全性和有效性,但长期疗效仍有待进一步观察。
在血管通路维护方面,DCB的应用前景令人鼓舞。目前临床常用的DCB包被的药物以紫杉醇为主,其作用机制是通过药物引起细胞凋亡并抑制平滑肌细胞向内膜迁移,阻止新内膜增生,从而减少通路再狭窄的发生。一项纳入16个随机对照研究的Meta分析[28],显示紫杉醇DCB可显著提高术后早期靶病变通畅率和通路累积通畅率。两个大型随机对照研究的数据均表明DCB组的远期通畅率优于HPB组[29-30]。金其庄教授牵头的中国首个DCB在血管通路中应用的多中心随机对照研究[31],共纳入161例患者,研究结果提示DCB 6月的靶病变一期通畅率显著提升,12月靶病变和血管通路的通畅率仍然较佳,且安全性与普通高压球囊相当。Karunanithy等[32]发起的一项多中心随机对照研究,结果显示DCB的初级通畅率优于普通高压球囊组,但两组的累积通畅率和不良事件的发生率无显著差异。DCB为临床治疗透析通路狭窄提供了新思路,然而其在特定部位的临床疗效、以及对原发和再狭窄的远期疗效、对于高压的药涂球囊是否无需预扩等问题都仍需真实世界的研究结果。
新近一项Ⅱ期临床研究发现带有核因子κB(NF-κB)诱导的寡脱氧核苷酸球囊用于AVF狭窄后的PTA治疗,可显著提高糖尿病组患者AVF的远期开放率(HR=0.666,95%CI 0.366~1.212)并且具有较好的安全性[33]。Cai等[34]在小鼠动物模型中发现,对于PTA术后发生的内瘘再狭窄,通过用绿色荧光蛋白(GFP)标记的脂肪来源性间充质干细胞(AMSC)移植到血管壁外膜可能减少促炎基因的表达,从而提高PTA术后内瘘的通畅性。
小结:介入治疗在血管通路并发症的治疗中具有独特的优势。对于血管通路初期发生狭窄失功时,初始治疗方案仍然以PTA为主,在 PTA失败或狭窄频繁复发时可考虑PTS。鉴于血管通路“一体化”管理理念,需建立早期监测机制,及时发现相关并发症,适时干预,并对各种治疗方案进行权衡利弊(图1)。
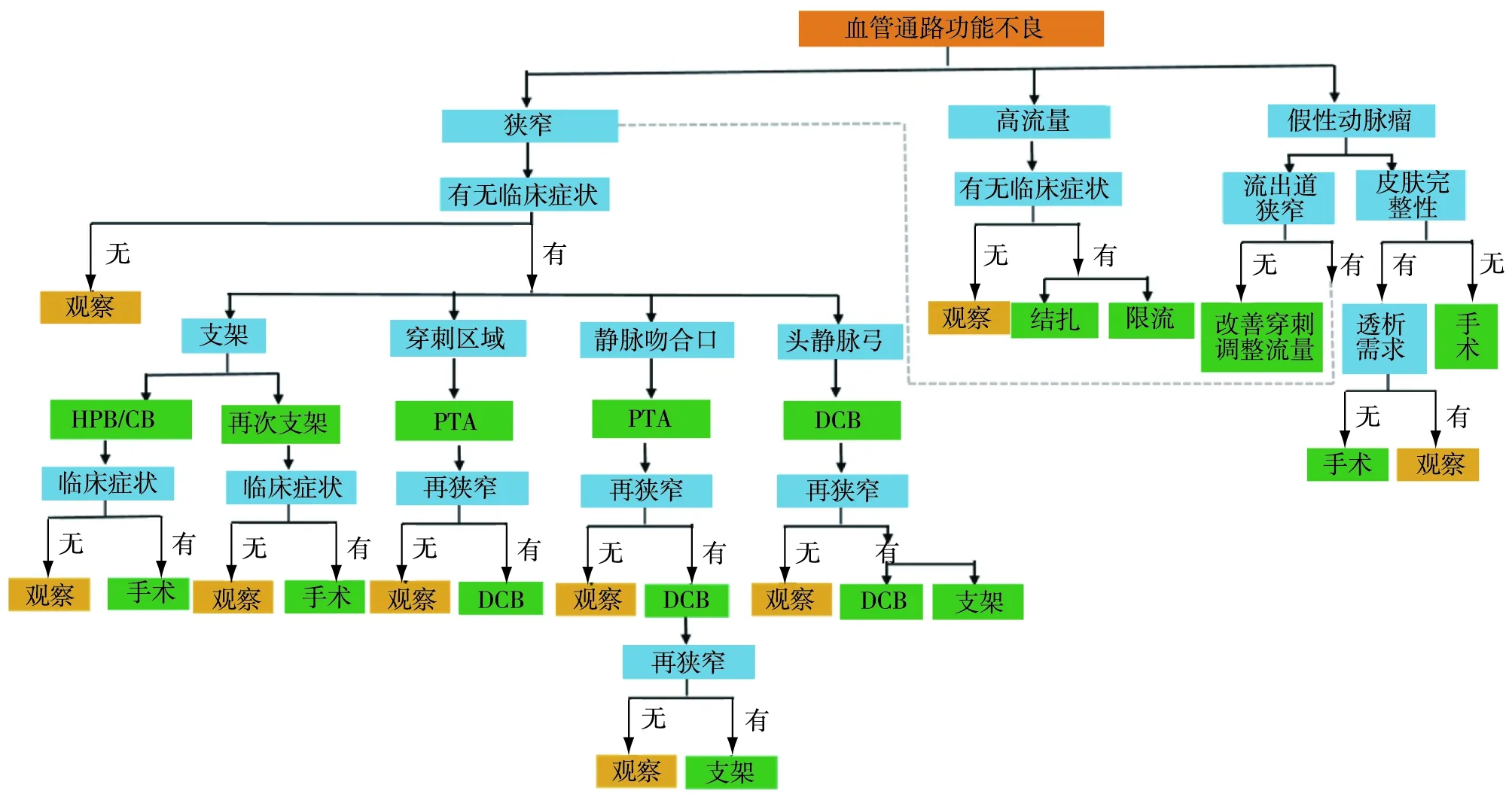
图1 血管通路功能不良诊治流程图PTA:经皮腔内血管成形术;HBP:高压球囊;CB:切割球囊;DCB:药物涂层球囊

