温岭高峰牛线粒体DNA全基因组遗传多样性分析
李 双,夏小婷,李付强,陈宁博,雷初朝*
(1.西北农林科技大学动物科技学院,陕西 杨凌 712100;2.湖南南天华实业有限公司,湖南 涟源 417126)
我国黄牛的品种资源十分丰富,有55个地方黄牛品种资源[1]。55个地方黄牛品种分布地域广泛,按地理分布不同,分为北方黄牛、中原黄牛和南方黄牛3大类[2]。关于中国黄牛的起源问题,一直以来都存在不同的观点,众多国内外学者从Y染色体分子遗传多态性及线粒体DNA多态性方面进行系统研究[3-7],证明北方黄牛主要受普通牛的影响,南方黄牛主要受瘤牛的影响,中原黄牛同时受到普通牛和瘤牛的影响,表明我国黄牛为多元起源的,表明中国黄牛具有普通牛和瘤牛两大母系起源。总体来看,我国普通牛和瘤牛血统所占比例在地理分布上呈现明显的梯度变化趋势。
哺乳动物的线粒体DNA(mitochondrial DNA,mtDNA)为闭合环状双链分子,一般大小为16.5 kb,具有结构简单、遵循母系遗传、无重组、进化速度快等特点,可以很好地反映家畜的母系起源。与其他哺乳动物一样,牛的线粒体DNA同样由37个蛋白编码基因和一段910 bp的D-loop区组成[12]。Xia等[6]系统分析了57个中国地方黄牛品种/群体共1 105个个体的线粒体DNA D-loop区的遗传多样性和母系起源,发现中国地方黄牛有普通牛T1a、T2、T3、T4、T5和瘤牛I1、I2共7种单倍型组,单倍型多样度为0.904±0.008,表明中国地方黄牛的线粒体遗传多样度非常丰富。在普通牛单倍型组中,T2、T3和T4是中国北方黄牛的主要单倍型组,在瘤牛单倍型组中,I1在中国南方黄牛中占主导地位,I2只近分布在中国西南地区(云贵高原和西藏)和新疆地区。另外,在西藏牛中检测到8个个体属于牦牛线粒体序列,说明西藏牛与牦牛存在基因交流。目前有关黄牛mtDNA全基因组的研究不多。Xia等[7]分析了我国肉牛培育品种云岭牛129个个体的mtDNA全基因组遗传多样性和群体结构,共检测到普通牛T1、T2、T3、T4、T6和瘤牛I1、I2共7种单倍型组,表明云岭牛拥有丰富的线粒体遗传多样性。Xia等[8]分析了170个蒙古牛系统10个群体的线粒体基因组,发现其拥有T1、T2、T3、T4、I、Q、P与牦牛的支系。
温岭高峰牛是我国南方地区的优良地方黄牛品种,具有役力较强、遗传性稳定、适应性良好的特点[9],但随着经济发展,温岭高峰牛的存栏量越来越少,并于2001年被农业部列入国家级畜禽品种资源保护名录。同时温岭高峰牛也具有骨骼细致,肌肉结实丰满的特点,有向役肉兼用方向发展的良好基础,因此在做好活畜保种的同时,也可以开展杂交改良工作[10]。本研究对温岭高峰牛的线粒体DNA全基因组多态性进行分析,从母系遗传的角度鉴定温岭高峰牛的群体结构以及遗传多样性,为温岭高峰牛的保种和开发利用提供理论依据。
1 材料与方法
1.1 样品采集
研究按照随机典型抽样方法,从浙江省温岭高峰牛保种场采集10头温岭高峰牛耳组织样本,所采集的每个样本都符合温岭高峰牛的品种特征,并根据家系信息尽量避开个体间的血缘关系。从GenBank下载9条温岭高峰牛全基因组序列(其登录号为:DRR295117-DRR295125)。同时从GenBank下载7条代表不同单倍型组的线粒体DNA全基因组序列以及1条牦牛线粒体DNA全基因组序列(GenBank号为:EU177841.1、AY676856.1、EU177839.1、AB074964.1、EU177862.1、EU177868.1、AF492350.1、AY684273.2)作为对照。
1.2 DNA提取与测序
用标准苯酚—氯仿法提取温岭高峰牛的基因组DNA,将检测质量良好的DNA送至北京诺禾致源生物信息科技有限公司,构建长度为350 bp左右的文库,利用Illumina HiSeq 2000 PE150的测序平台进行测序。
1.3 数据处理与统计方法
用Trimmomatic软件去除温岭高峰牛基因组中测序低质量和接头序列,用BWA-MEM(0.7.13-r1126)软件将过滤后质量合格的序列比对到最新参考基因组(ARS-UCD1.2)中的线粒体基因组上(GenBank:AY526085.1)。将BAM比对转换为FASTQ文件,然后使用Mapping Iterative Assembler v1.0(MIA,https:/github.com/mpieva/mapping-iterative-assembler)组装温岭高峰牛的线粒体DNA基因组全序列。
使用DnaSPv 5.10软件对温岭高峰牛的线粒体DNA基因组序列进行分析,对温岭高峰牛的单倍型和变异位点的数量进行统计,并计算单倍型多样性(Hd)、核苷酸多样性(Pi)和平均核苷酸差异(k)。利用MEGA 5.0对温岭高峰牛的线粒体DNA基因组序列进行比对分析,之后进行人为校正,将GenBank上下载的7条具有代表性的线粒体DNA基因组序列(包括单倍型T1、T2、T3、T4、T5、I1、I2)以及1条牦牛线粒体DNA基因组序列作为对照,构建温岭高峰牛的NJ系统发育树。最后使用NETWORK 5.0.1.1软件构建温岭高峰牛单倍型的网络图。
2 结果与分析
2.1 温岭高峰牛线粒体DNA全基因组的序列特征
对19头温岭高峰牛的线粒体全基因组数据进行统计,其平均比对率为99.91%,对比率范围为99.82%~99.97%;平均深度为861.70 x,深度范围为(362.25~2 184.86) x。温岭高峰牛线粒体DNA全基因组序列由A、T、G、C 4种碱基组成,其中A碱基含量最高(33.5%),其次为T(27.1%)和C(26.0%),G碱基含量最低,仅为13.4%。A+T的平均含量为60.6%,G+C的平均含量为39.4%。11头温岭高峰牛线粒体DNA基因组长度为16 338 bp,7头温岭高峰牛线粒体DNA基因组长度为16 339 bp,1头温岭高峰牛线粒体DNA基因组长度为16 340 bp,这种长度变化主要是插入和缺失导致的。在19头温岭高峰牛群体中共检测到263个变异位点,有258个单一多态位点,5个简约信息位点。258个单一多态位点均为两碱基突变,而5个简约信息位点中有4个为两碱基突变,1个为三碱基突变。
2.2 温岭高峰牛线粒体DNA全基因组遗传多样性和单倍型组成
研究分析了温岭高峰牛的线粒体DNA全基因组的序列变异,以评估其线粒体DNA遗传变异和母系起源。结果显示在19头温岭高峰牛中定义了9种单倍型,其中,有8个单倍型(共包含18个体,占94.74%)属于瘤牛,有1个单倍型(包含1个体,占5.36%)属于普通牛。温岭高峰牛单倍型多样度(Hd±SD)为0.778±0.096,核苷酸多样度(Pi±SD)为0.0017±0.0014,平均核苷酸差异(k)为28.327。
2.3 温岭高峰牛的NJ系统发育树
利用MEGA 5.0软件对19头温岭高峰牛线粒体DNA基因组序列组成的9个单倍型进行系统发育分析,以从GenBank下载的7条具有代表性的线粒体DNA基因组序列(T1、T2、T3、T4、T5、I1、I2)作为参考,以1条牦牛线粒体DNA基因组序列作为外群,构建温岭高峰牛的NJ系统发育树。从图1可以看出,NJ系统发育树将温岭高峰牛分为瘤牛和普通牛两大支系,8个瘤牛单倍型(包含18个体,占94.74%)属于I1单倍型组,仅有1个单倍型(包含1个体,占5.36%)属于普通牛支系,说明温岭高峰牛是普通牛与瘤牛的混合母系起源,主要受瘤牛的影响。
2.4 构建温岭高峰牛单倍型的进化网络图
进化网络(network)是一种可以客观描述物种内不同单倍型间遗传进化关系的方法,其中media-joining进化网络可以快速地进行大量单倍型数据分析。本研究利用Network软件,以从GenBank下载的7条具有代表性的线粒体DNA基因组序列(T1、T2、T3、T4、T5、I1、I2)以及1条牦牛线粒体DNA基因组序列作为对照,构建了19头温岭高峰牛线粒体DNA全基因组9个单倍型间的media-joining进化网络。从图2可以看出,本文分析的19头温岭高峰牛均可划分到瘤牛和普通牛两个大的单倍型类群中,其中,8个单倍型(包含18个体,占94.74%)属于瘤牛支系,仅有1个单倍型(包含1个体,占5.36%)属于普通牛支系,表明温岭高峰牛是普通牛与瘤牛的混合母系起源,但受瘤牛影响较大,与NJ系统发育树的结果一致。
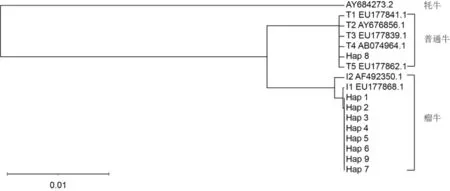
图1 温岭高峰牛线粒体DNA基因组单倍型的NJ系统发育树
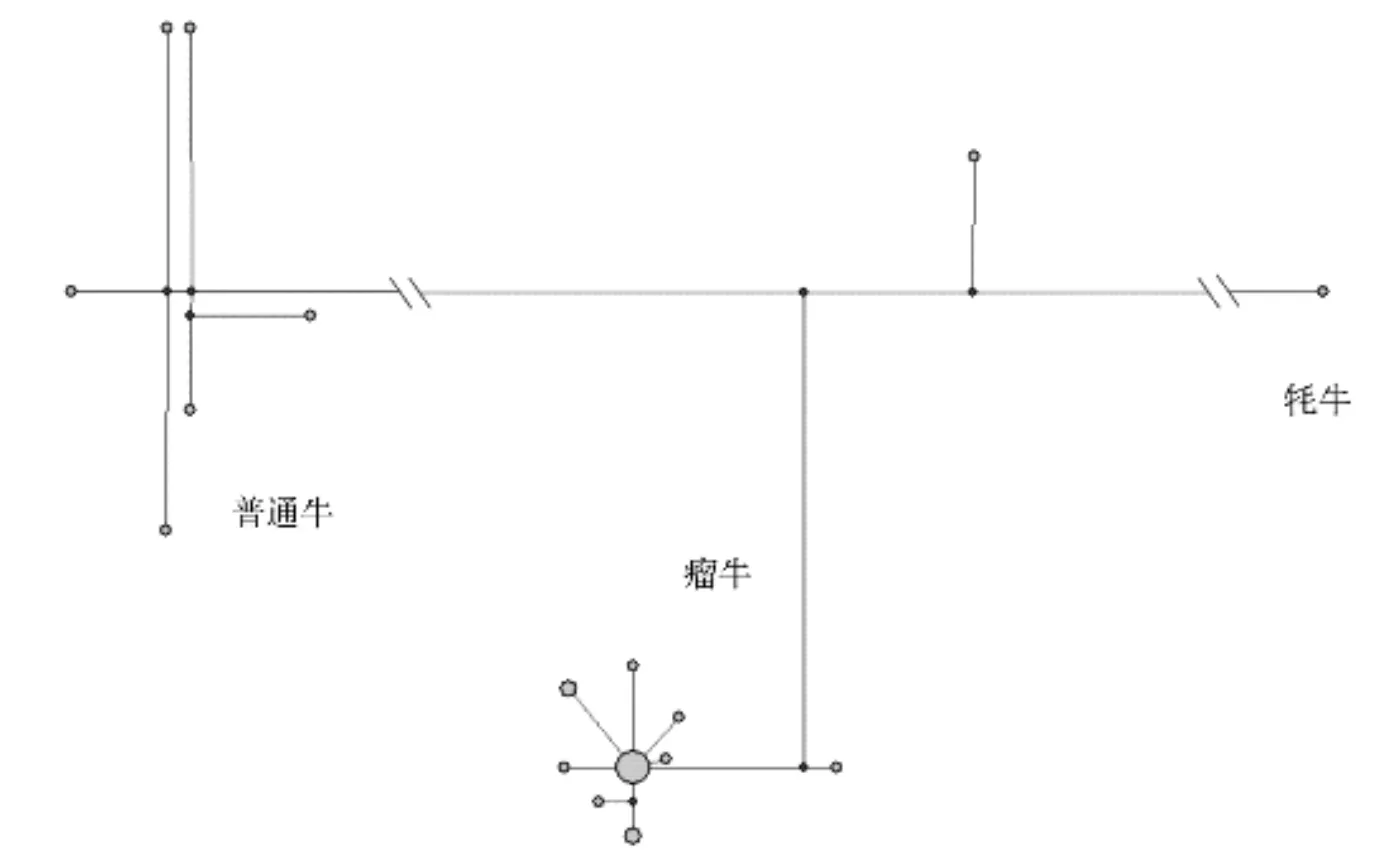
注:圆的面积与单倍型频率成正比,红点是中值向量。
3 讨 论
单倍型多样度(Hd)和核苷酸多样度(Pi)是衡量一个群体线粒体DNA变异程度的重要指标,单倍型多样度和核苷酸多样度的值越大,说明该群体的遗传多样性越高,反之,则说明该群体的遗传多样性越低。Xia等[7]分析了我国肉牛培育品种云岭牛的mtDNA全基因组遗传多样性,发现其Hd值为0.964,Pi值为0.007 8。Xia等[8]分析了170个蒙古牛系统10个群体的线粒体基因组,发现其Hd值为0.464~1.000,Pi值为0.000 4~0.009 2。本研究表明温岭高峰牛的Hd值为0.778,Pi值为0.001 7,与Xia等[7-8]的研究结果相比,其mtDNA基因组的遗传多样性较低,这可能与其群体数量大大减少,处于保种状态有关。温岭高峰牛为役用品种,随着农村经济快速发展,其役用功能大都消失,农户已基本不养殖该品种,导致其群体数量急剧减少,难以进行血统更新,从而导致温岭高峰牛遗传多样性降低[9-10]。本研究发现,在19个温岭高峰牛个体中,1个普通牛起源的个体(1/19,占5.26%)共享1个单倍型,18个瘤牛起源的个体(18/19,占94.74%)共享8个单倍型,表明温岭高峰牛主要受瘤牛的影响。Jia等[11]对以中国地方黄牛为主的亚洲六国黄牛mtDNA D-loop序列的多样性研究,其中12个温岭高峰牛全部属于瘤牛I1单倍型组,没有普通牛单倍型。Jiang等[12]对舟山黄牛和温岭高峰牛的全基因组研究,发现温岭高峰牛和舟山黄牛类似,以瘤牛为主,有少量普通牛的基因组渗入。从本研究的mtDNA基因组及全基因组研究均表明,温岭高峰牛以瘤牛血统为主,含有极少量普通牛基因组。孙婷等[13]对吉安黄牛的mtDNA研究,表明南方地区的吉安黄牛,其母系起源受瘤牛的影响大。而对郏县红牛的mtDNA遗传多样性研究,发现郏县红牛是典型的中原黄牛,同时受到普通牛和瘤牛的影响[14]。本研究发现温岭高峰牛线粒体DNA遗传多样性较低,具有普通牛和瘤牛两大母系起源,但主要受瘤牛的影响。由于温岭高峰牛的遗传多样性较低,在保种条件下更容易近亲繁殖,因此应该特别注意防止其近亲繁殖的问题,提高保种监测水平,保证其遗传资源不丢失,品种特性不改变。要将温岭高峰牛产业做大做强,除了保种外,还要想办法发掘其有利肉用性状,加快推进品种资源保护与有序的产业化开发,真正做到对温岭高峰牛品种资源的保护和开发利用。
4 结 论
本文共分析了19头温岭高峰牛的线粒体DNA全基因组序列,其中4种碱基的含量分别为:A(33.5%)、T(27.1%)、C(26.0%)、G(13.4%),A+T的含量明显高于G+C,表现出了对碱基的偏好性,这与一般多细胞动物线粒体DNA的显著特征相符[15]。19头温岭高峰牛的单倍型多样度(Hd±SD)为0.778±0.096,核苷酸多样度(Pi±SD)为0.0017±0.0014,平均核苷酸差异(k)为28.327,与Xia等[7-8]的研究结果相比,其线粒体DNA基因组的遗传多样性较低,这可能与温岭高峰牛由于役用功能基本消失而导致农户饲养数量不断减少,且难以进行血统更新有关,需要相关部门进一步加大保种力度,从多方面对温岭高峰牛这一品种资源进行保护和开发利用。同时,在19头温岭高峰牛的线粒体DNA全基因组序列中发现了263个变异位点,共定义9种单倍型,从NJ系统发育树以及进化网络图均可以看出,有8个单倍型(共包含18个体,占94.74%)属于瘤牛支系且均为I1支系,仅有1个单倍型(包含1个体,占5.36%)属于普通牛支系,因此温岭高峰牛具有瘤牛和普通牛两大母系起源,但受瘤牛影响更大。

