甘草酸拮抗雷公藤多苷所致肾毒性的分子机制研究
李秋红,胡勇,鞠爱霞,赵娇,郄青松,周育生
(黑龙江中医药大学药学院,黑龙江 哈尔滨 150040)
雷公藤多苷是从雷公藤TripterygiumwilfordiiHook.F.去皮根部提取的皂苷类有效成分,雷公藤甲素和雷公藤内酯酮等二萜类成分、雷公藤内酯甲和雷公藤红素等三萜类成分、雷公藤次碱和雷公藤晋碱等生物碱类成分是其主要有效和有毒成分[1-4],用于治疗慢性肾小球疾病、肾病综合征、类风湿性关节炎、红斑狼疮等难治或顽固性疾病,有“中草药激素”之称,但易产生肾毒性,临床使用受限[5-7]。中药配伍具有中医遣方用药的优势特色,既可增强疗效,又可减轻或消除毒性。甘草GlycyrrhizauralensisFisch.具有“和诸药,解百毒”之称,三萜皂苷类化合物甘草酸是甘草主要活性成分。研究表明,甘草酸可保护肾脏,拮抗药源性、缺血再灌注性、梗阻性等多种类型肾损伤,临床上用于病毒性肝炎、慢性肾病和免疫性皮肤病等的治疗[8-10]。实验研究证实,雷公藤配伍甘草治疗肾病,疗效优于单用雷公藤,具有增效减毒的作用[11-14],但产生这种效应的分子机制尚不明确。网络药理学是药物作用靶点预测的有效方法[15],能从组织、细胞、分子等层面对成分复杂的中药进行研究,是揭示药物、基因和疾病相互作用的系统和整体方法,为中药作用机制的研究提供思路。
因此,本研究通过网络药理学方法预测甘草酸与雷公藤多苷的作用靶点,从中选出与肾脏转运体有关的靶基因,并在动物水平进行验证,以期为临床两药配伍使用提供实验依据。
1 材料
1.1 药品及主要试剂
雷公藤多苷片(湖南千金协力药业有限公司,批号:20180603);甘草酸(上海源叶生物科技有限公司,批号:X12A9C58435,纯度>95%);尿素氮(BUN)检测试剂盒、肌酐(Scr)检测试剂盒(南京建成生物工程研究所,批号:20181218、20181214);动物总RNA快速抽提试剂盒(上海生工生物工程股份有限公司,批号:EA12KA9784);FastKing cDNA第一链合成试剂盒(北京天根生化科技有限公司,批号:R6720);FastStart Universal SYBR Green Master(ROX)核酸染料(德国罗氏诊断有限公司,批号:04913914001);Western及IP裂解液(上海碧云天生物技术有限公司,货号:P0013);P-gp一抗、MRP2一抗(北京博奥森生物技术有限公司,批号:bs1468R、bs1092R);β-actin一抗、辣根酶标记抗鼠IgG、辣根酶标记山羊抗兔IgG(H+L)(北京中杉金桥生物技术有限公司,批号:18AV0409、137699、136080);超敏ECL化学发光检测试剂盒(上海爱必信生物科技有限公司,批号:EL0419004);戊巴比妥钠(德国Merck公司,批号:P11011)。
1.2 实验动物
SPF级SD雄性大鼠,6~8周龄,体质量180~200 g,购自黑龙江中医药大学实验动物中心,实验动物许可证号:SYXK(黑)2018007,饲养在温度为20~26 ℃,湿度为40%~70%的环境中。本实验通过黑龙江中医药大学实验动物伦理委员会的批准,批号:20190930s1000121[232]。
1.3 主要仪器
酶标仪(SynergyMX,BioTek公司);切片机(RM2135,Leica公司);显微摄影成像系统(Moticam3000,Motic公司);qPCR仪(iQ5,Bio-Rad公司);红外微定量分析仪(Direct Detect,Merck公司);电泳系统(Mini PROTEAN Tetra Cell,Bio-Rad公司);全自动凝胶成像系统(Gel Doc XR+,Bio-Rad公司)。
2 方法
2.1 网络药理学预测甘草酸拮抗雷公藤多苷所致肾毒性的作用靶点
2.1.1 构建雷公藤多苷主要成分和甘草酸的靶点网络 在PubChem数据库中获取雷公藤多苷中6种主要成分雷公藤甲素(Triptolide)、雷公藤内酯酮(Triptonide)、雷公藤晋碱(Wilforgine)、雷公藤次碱(Wilforine)、雷公藤红素(Tripterine)和雷公藤内酯甲(Wilforlide A)及甘草酸(Glycyrrhizic acid)的结构式文件和Canonical SMILES名称,将结构式文件导入PharmMapper数据库同时将Canonical SMILES名称输入SwissTargetPrediction中检索靶点基因,此外,在CTD、GeneCards、NCBI数据库补充筛选上述7个有效成分的靶点基因;所有靶点基因在UnitProt数据库中更正为官方名称,剔除重复靶点基因,将成分和对应靶点基因的关系导入Cytoscape 3.7.2软件中,得到雷公藤多苷和甘草酸成分的靶点网络图。
2.1.2 构建肾毒性-靶点网络 在NCBI数据库Gene子项和GeneCards数据库中检索肾毒性的英文名称“Nephrotoxicity”和“Renal toxicity”,得到关于肾毒性的靶点基因,剔除重复的部分,将肾毒性和对应靶点基因的关系导入Cytoscape 3.7.2软件中,得到肾毒性-靶点网络图。
2.1.3 靶点的富集分析 运用Cytoscape 3.7.2软件中的Merge功能,将雷公藤多苷主要成分和甘草酸的靶点网络图以及肾毒性-靶点网络图合并得到交集靶点,将交集靶点输入DAVID数据库(https://david.ncifcrf.gov/)进行基因本体(Gene ontology,GO)富集分析,获得雷公藤多苷主要成分和甘草酸作用于肾毒性靶点的分子功能信息。
2.2 动物实验
2.2.1 实验分组及给药 雷公藤多苷给药剂量根据临床给药剂量折算及预实验确定为130 mg·kg-1,甘草酸给药剂量依据文献及预实验确定为57 mg·kg-1,保肝效果最佳[16-17]。将适应性喂养后的SD大鼠随机分为空白组(生理盐水)、甘草酸组(57 mg·kg-1)、雷公藤多苷组(130 mg·kg-1)和联合给药组(甘草酸57 mg·kg-1+雷公藤多苷130 mg·kg-1),每组10只,每日灌胃给药1次,连续干预29 d。
2.2.2 生物样本采集 大鼠连续给药29 d后,禁食不禁水12 h,2%戊巴比妥钠(3 mL·kg-1)腹腔注射麻醉,腹主动脉取血,收集血液8~10 mL,室温静置40 min,于3 000 r·min-1离心10 min得血清样本。腹主动脉取血结束后取两侧肾脏,用生理盐水冲洗表面并用滤纸吸干多余的水分得肾脏样本,将血清样本和肾脏样本置于-80 ℃保存备用。
2.2.3 肾损伤生化指标测定 血清中BUN和Scr含量分别按照BUN检测试剂盒和Scr检测试剂盒说明书进行测定。
2.2.4 HE染色观察组织病理 大鼠肾脏组织经10%多聚甲醛固定24 h,乙醇梯度脱水,二甲苯透明,石蜡包埋,切片,二甲苯Ⅰ和Ⅱ脱蜡,梯度水化,苏木素染色,蒸馏水冲洗,含1%盐酸的70%乙醇水化,蒸馏水漂洗,70%和80%乙醇浸泡后,90%伊红醇溶液染色,脱水,透明,中性树胶封片,显微摄影成像系统×400下拍片,记录结果。
2.2.5 qPCR法检测肾组织中Mdr1a、Mdr1b、MRP2 mRNA的表达量 采用动物总RNA快速抽提试剂盒提取各组肾脏组织总RNA,用核酸蛋白分析仪检测总RNA的浓度及纯度,FastKing cDNA第一链合成试剂盒逆转合成cDNA,引物Mdr1a、Mdr1b、MRP2及内参β-actin的序列由上海生工生物工程股份有限公司合成(表1),用SYBR®Green Master预混液于qPCR仪上进行测定,采用2-ΔΔCt计算相对表达量。

表1 qPCR引物序列Table 1 Sequences of qPCR primers
2.2.6 Western blot法检测肾组织中P-gp、MRP2的蛋白表达量 采用Western及IP细胞裂解液提取肾脏总蛋白,红外微定量分析仪测定蛋白浓度,5×SDS-PAGE上样缓冲液配制蛋白样品,按照SDS-PAGE凝胶试剂盒要求配置8%、12%分离胶及5%浓缩胶,取8 μL样品上样,进行SDS-PAGE电泳,待电泳结束后用半转干机(恒压15 V,20~30 min)将蛋白条带转移至PVDF膜;用5%脱脂奶粉封闭2 h;以1∶500稀释一抗,4 ℃孵育过夜,次日回收一抗,TBST冲洗,以1∶10 000稀释二抗,室温孵育1 h,回收二抗,TBST冲洗;超敏ECL化学发光显影,β-actin作为内参,置于Bio-Rad凝胶成像系统记录结果。用Image J软件测定各组蛋白条带的光密度值并分析各组灰度值。
3 结果
3.1 甘草酸拮抗雷公藤多苷所致肾毒性的网络药理学分析
3.1.1 雷公藤多苷与甘草酸靶点网络的构建及分析 各数据库中筛查到雷公藤多苷和甘草酸靶点基因数目如下:雷公藤甲素63个,雷公藤内酯酮10个,雷公藤红素263个,雷公藤晋碱103个,雷公藤次碱106个,雷公藤内酯甲264个,甘草酸107个,根据Cytoscape 3.7.2软件分析雷公藤多苷主要成分和甘草酸的靶点网络,图中包含593个节点(7个成分和586个相关靶点)和916条线(成分与靶点的关系),见图1。
3.1.2 肾毒性-靶点网络的构建及分析 获得肾毒性的相关靶点281个,根据Cytoscape 3.7.2软件分析肾毒性-靶点网络图,图中包含282个节点(281个相关靶点)和281条线(成分与靶点的关系),见图2。
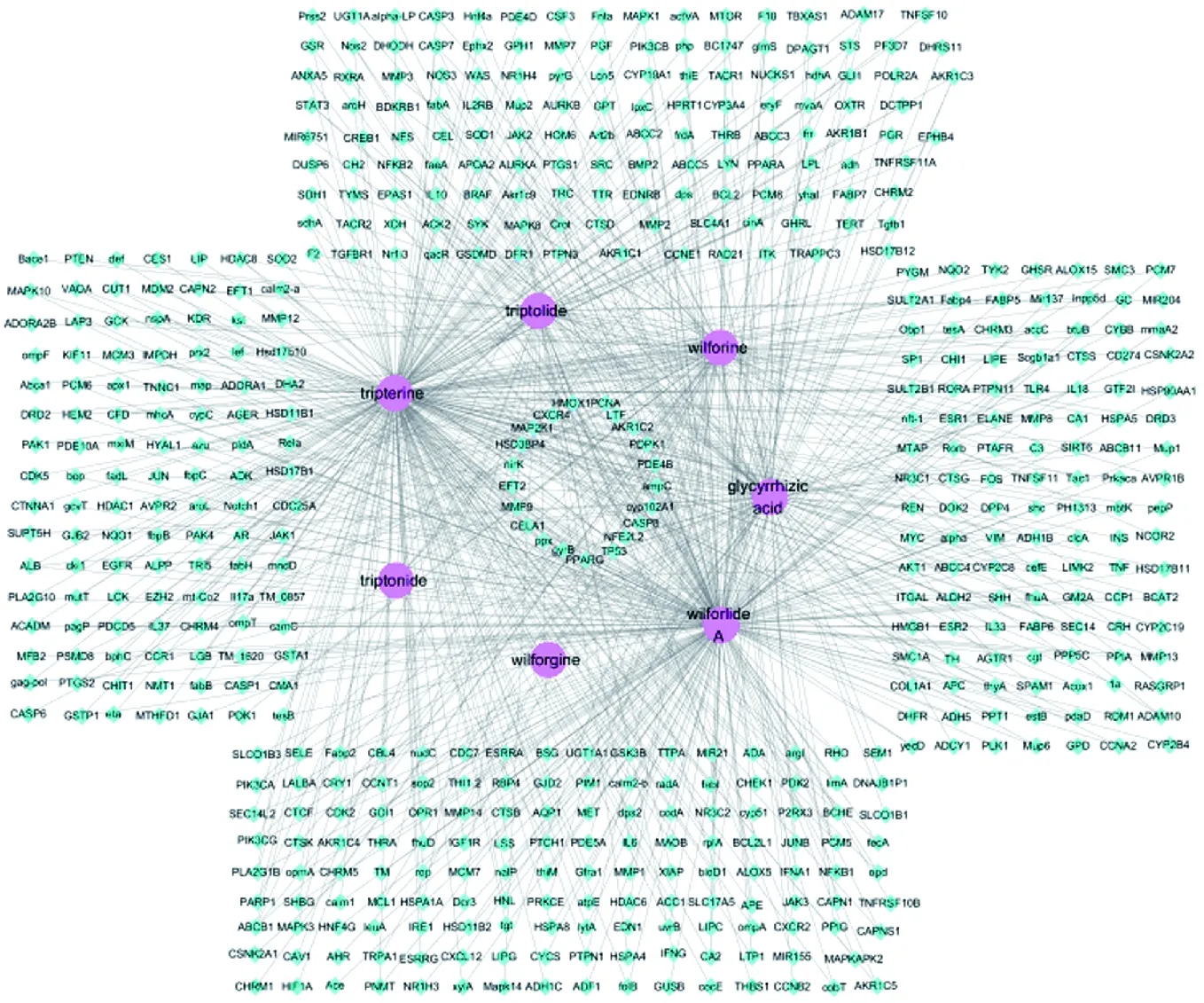
注:Triptolide.雷公藤甲素;Triptonide.雷公藤内酯酮;Wilforgine.雷公藤晋碱;Wilforine.雷公藤次碱;Tripterine.雷公藤红素;Wilforlide A.雷公藤内酯甲;Glycyrrhizic acid.甘草酸图1 雷公藤多苷主要成分和甘草酸-靶点网络图Fig.1 Main components of tripterygium glycosides and glycyrrhetic acid-target network
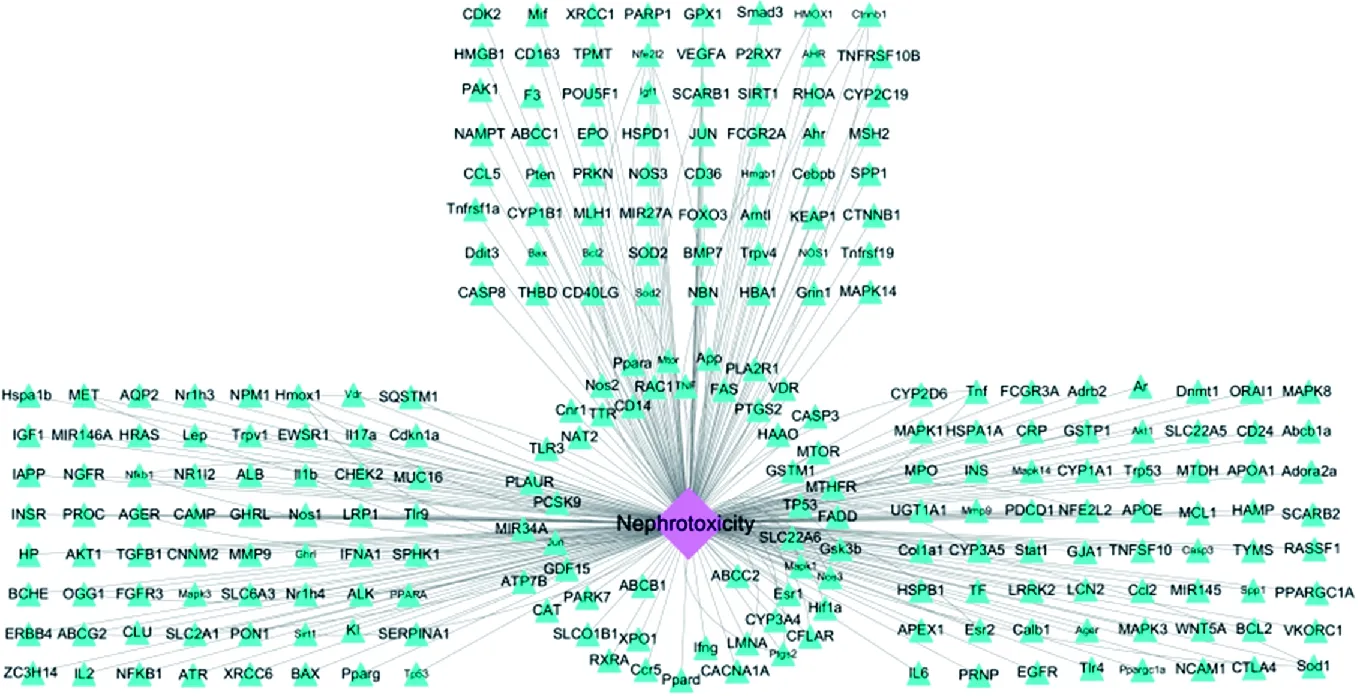
注:Nephrotoxicity.肾毒性图2 肾毒性-靶点网络图Fig.2 Nephrotoxicity-target network
3.1.3 靶点的富集分析 通过Cytoscape 3.7.2中的Merge功能获得交集靶点73个,说明雷公藤多苷主要成分和甘草酸与肾毒性有73个相关的共有基因(图3A)。通过GO富集获得GO条目(GOTERM_MF_DIRECT)81个,基因富集数量最多的10个条目、各条目富集的基因及所占比例如图3B所示,其中富集基因数量占比最多的是蛋白结合(BP)条目(56个,76.7%)。BP富集的基因中ABCB1和ABCC2是其涉及的主要转运体:ABCB1即P-糖蛋白(P-gp)外排转运体,由Mdr1a和Mdr1b基因编码;ABCC2即MRP2外排转运体。二者在肾脏中的肾上腺和肾小管等部位有较高表达,将毒素和有害药物转运到细胞外,进而排出体外。研究表明,甘草酸诱导P-gp表达[18],推测与雷公藤多苷配伍时,甘草酸可能是通过激活P-gp和MRP2蛋白外排作用,使雷公藤多苷中毒性成分外排增加,产生减毒效果。因此,本研究对P-gp和MRP2两个关键节点进行实验验证。

图3 交集靶点(A)及GO富集分析(B)Fig.3 Intersection target (A) and GO enrichment analysis (B)
3.2 甘草酸拮抗雷公藤多苷肾毒性的分子机制
3.2.1 大鼠血清BUN和Scr含量的变化情况 与空白组比较,雷公藤多苷组大鼠血清中BUN和Scr含量显著升高(P<0.01),甘草酸组大鼠血清中BUN含量呈升高的趋势但无统计学意义,Scr含量显著升高(P<0.05);与雷公藤多苷组比较,联合组、甘草酸组大鼠血清中BUN和Scr含量显著下调(P<0.01),见表2。
表2 各组大鼠血清BUN和Scr含量Table 2 Serum contents of BUN and Scr in each group
3.2.2 组织病理观察 空白组肾组织结构较规则,细胞质和细胞核染色清晰,肾小管腔、肾小球和囊腔完整,无充血或炎性细胞浸润现象;甘草酸组肾组织结构较规则,细胞核染色清晰,肾小管和肾小球相对完整,未见充血和炎性细胞浸润;雷公藤多苷组肾组织结构紊乱,染色不均,肾小管及间质有较明显的炎性细胞浸润,肾小管上皮细胞出现变性、混浊,肾小管内有大量均匀的红色染色物质(蛋白尿),肾小球萎缩,球囊扩张,肾小管出现融合甚至消失形成空腔;联合组肾组织结构较雷公藤多苷组完整,肾小管内红色染色物质明显减少,肾小管上皮混浊肿胀等病变也明显改善,肾小球萎缩、囊腔扩张减少。见图4。

图4 各组大鼠肾脏组织病理形态的显微图(HE,×400)Fig.4 Micrographs of renal histological morphology of rats in each group (HE,×400)
3.2.3 雷公藤多苷配伍甘草酸对肾脏转运体基因表达的影响 与空白组比较,甘草酸组大鼠Mdr1a mRNA表达量升高(P>0.05),Mdr1b、MRP2 mRNA表达量显著升高(P<0.05,P<0.01),雷公藤多苷组大鼠Mdr1a、Mdr1b、MRP2 mRNA表达量显著降低(P<0.05,P<0.01);与雷公藤多苷组比较,甘草酸组、联合组大鼠Mdr1a、Mdr1b、MRP2 mRNA表达量显著升高(P<0.05,P<0.01)。见图5。
3.2.4 雷公藤多苷配伍甘草酸对肾脏转运体P-gp和MRP2蛋白表达的影响 与空白组比较,甘草酸组P-gp、MRP2蛋白表达量显著升高(P<0.05,P<0.01),雷公藤多苷组P-gp、MRP2蛋白表达量显著下调(P<0.01);与雷公藤多苷组比较,甘草酸组、联合组P-gp、MRP2蛋白表达量显著上调(P<0.05,P<0.01)。见图6。

注:与空白组比较,*P<0.05,**P<0.01;与雷公藤多苷组比较,图5 各组大鼠肾脏组织Mdr1a、Mdr1b、MRP2 mRNA表达量Fig.5 The mRNA expressions of Mdr1a, Mdr1b, MRP2 in renal tissue of rats in each group
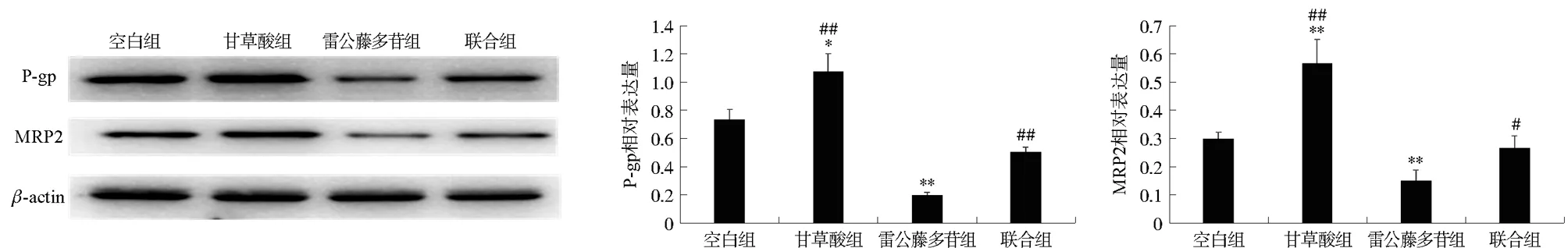
注:与空白组比较,*P<0.05,**P<0.01;与雷公藤多苷组比较,图6 各组大鼠肾脏组织P-gp、MRP2蛋白表达量Fig.6 The protein expressions of P-gp and MRP2 in renal tissue of rats in each group
4 讨论
药源性肾损伤是由药物所致的各种肾脏损伤的一类疾病的总称,主要表现为肾毒性反应及过敏反应,滥用药物、不规范用药及肾毒性药物的使用是引发药源性肾损伤的重要原因,从而导致肾病患者数量逐年增多,临床上20%~33%的急性肾功能损伤由药物引发[19]。雷公藤多苷是从雷公藤中提取的有效成分,长期或过量使用易产生肝肾毒性等不良反应,其中肾毒性临床表现为血尿、蛋白尿、水肿、肾小管损伤、肾间质炎性细胞浸润以及急性肾功能衰竭等[20],为了降低雷公藤多苷的毒副作用,古今医家在药性理论基础上采用配伍用药对其毒性进行制约,可有效地保证其安全性[21]。有“解百药毒”之称的甘草常与雷公藤配伍用于综合性肾病的治疗,可有效缓解雷公藤对肝、肾器官的损伤。近年来甘草配伍雷公藤拮抗肝毒性的研究甚多,研究表明甘草酸可通过诱导CYP3A酶、转运体MRP2活性及激活Nrf2通路,增强肝细胞抗氧化,抑制细胞凋亡及免疫损伤等发挥对雷公藤致肝损伤的拮抗作用[22-24]。但对于其如何缓解肾损伤的机理尚不明确,因此有必要对其中的生物学基础进行探索。
本研究运用网络药理学预测甘草酸与雷公藤多苷作用于肾毒性的潜在靶点,并通过GO富集分析其中涉及的主要分子功能。共获肾毒性与甘草酸和雷公藤的共同靶点73个,其中76.7%的靶点富集于BP条目,涉及蛋白调节(ABCB1、ABCC2)、氧化应激(NOS、SOD)、炎症因子(TNF、IL-6)、细胞凋亡(PI3K、AKT、MAPK)等,说明甘草酸对雷公藤多苷肾毒性的拮抗具有多靶点、多途径的作用。研究表明[25],细胞毒性作用、免疫损伤、自由基与氧化损伤等均是药源性肾损伤的机制。在使用雷公藤甲素治疗胶原诱导的关节炎大鼠时,发现大鼠肾脏损伤加重,且肾皮质中雷公藤甲素浓度高于延髓,此时肾脏有机阳离子转运蛋白2(Oct2)表达上调[26],说明肾脏转运蛋白的表达或功能发生改变,会增强毒性药物的蓄积,产生细胞毒性作用,为此本研究选择GO富集的主要转运体ABCB1、ABCC2进行实验验证。
实验结果显示,给予大鼠雷公藤多苷后,其血清中肾脏功能指标BUN和Scr含量显著升高。大鼠体内BUN和Scr蓄积,会导致肾小球滤过功能降低。配伍甘草酸后能显著降低BUN和Scr含量,改善肾小球滤过功能的损伤。HE染色结果显示,雷公藤多苷对肾小球、肾小管及肾间质均有损害作用,而配伍甘草酸后能减少蛋白尿,改善肾小管上皮肿胀、肾小球萎缩及炎性细胞浸润,说明甘草能拮抗雷公藤的肾毒性,对肾脏起保护作用。为进一步明确雷公藤多苷所致肾损伤及甘草酸对肾脏的保护作用机制是否与ABCB1(P-gp)、ABCC2(MRP2)转运体有关,本实验对转运体P-gp和MRP2进行检测。采用qPCR对编码P-gp的基因Mdr1a、Mdr1b和MRP2的mRNA表达量进行检测,采用Western blot对P-gp和MRP2蛋白表达量进行检测。结果显示,雷公藤多苷对编码外排转运体P-gp及MRP2基因和蛋白均有不同程度的抑制作用,具有一致性,说明雷公藤多苷对转运体功能的影响可能是通过对基因表达的抑制传递到蛋白表达的抑制,在一定程度上限制了转运体P-gp和MRP2对雷公藤多苷有毒成分雷公藤甲素、雷公藤红素、雷公藤内酯甲等的转运,致使这些有毒成分在肾脏滞留积累,导致肾功能异常;而甘草酸配伍可有效逆转雷公藤多苷对外排转运体P-gp和MPR2基因和蛋白的下调作用,使雷公藤多苷有毒成分有效排出,改善转运体的功能,减轻细胞毒性作用。因此,甘草酸配伍雷公藤多苷拮抗其肾毒性可能机制之一是逆转转运体P-gp和MPR2功能,使雷公藤多苷毒效成分及时排出体外,减少在肾脏的蓄积,达到保肾脏作用。甘草酸有2个差向异构体,分别为18α-甘草酸(18α-Glycyrrhetinic acid,α-GL)和18β-甘草酸(18β-Glycyrrhetinic acid,β-GL),有学者研究α-GL与β-GL对Caco-2细胞P-gp功能和表达的影响,发现α-GL对P-gp具有抑制作用,β-GL对P-gp具有诱导作用,但不存剂量依赖性[27-28]。然而,本课题组研究发现,甘草酸对P-gp具有诱导作用,其可能原因是从不同的层面上对甘草酸进行研究导致α-GL与β-GL在体内的含量不同,从而得出不同的结果[29-30]。
综上所述,本研究通过网络药理学预测甘草酸拮抗雷公藤多苷肾毒性可能的分子机制,并对甘草酸配伍雷公藤的药效和其中涉及的关键转运体通过动物实验进行验证,为两药配伍的临床应用提供一定数据支持,但中药往往是通过多靶点、多途径协同发挥作用,对于其他涉及的可能分子机制还有待进行实验验证,此外网络药理学预测使用的数据库对化学成分收录不足,本研究主要对雷公藤多苷6种成分的靶点进行了预测,今后可通过UPLC-MS对雷公藤多苷的成分进行进一步分析,提高网络药理学预测的可靠性。

