微小RNA-106通过调控PTEN/PI3K/AKT信号通路影响子宫内膜癌RL95-2细胞生物学行为的研究
邵 洋, 姚 超, 徐崧圆, 强 萍
(江苏省张家港市第一人民医院 妇产科, 江苏 张家港, 215600)
子宫内膜癌是常见的女性生殖系统恶性肿瘤,具有较强的侵袭性和转移能力,其发病率逐年升高并呈年轻化的趋势,患者5年相对存活率约为82%, 但晚期患者易发生复发及转移,治疗效果仍不理想,其发病机制也不明确,因此研究子宫内膜癌发生发展的分子机制具有重要的意义[1-2]。微小RNA-106(miR-106)是研究较多的miRNA, 在宫颈癌[3]、胃癌[4]、肝癌[5]等肿瘤中表达上调,参与调控肿瘤细胞的增殖与迁移等。研究[6]显示, miR-106在子宫内膜癌组织与细胞系中高表达,可促进子宫内膜癌细胞的增殖与侵袭,但miR-106对子宫内膜癌影响的具体作用机制尚不清楚。PTEN是一种抑癌基因,可负向调节AKT信号通路,抑制肿瘤细胞的增殖与迁移,且PTEN/PI3K/AKT通路参与调控多种肿瘤细胞迁移与侵袭[7]。研究[8]显示, PTEN在子宫内膜癌组织中低表达,与子宫内膜癌病理分级、浸润程度有关。目前, miR-106对PTEN/PI3K/AKT信号通路的影响尚不清楚。本研究在子宫内膜癌细胞(RL95-2细胞)中抑制miR-106表达,观察miR-106对RL95-2细胞增殖、迁移及侵袭的影响及其对PTEN/PI3K/AKT通路的调控作用,初步探讨子宫内膜癌的发生发展机制,现报告如下。
1 材料与方法
1.1 主要材料
人子宫内膜癌细胞RL95-2购自中国科学院细胞库; DMEM培养基、胎牛血清(FBS)均购自美国Gibco公司,抑制miR-106表达质粒(miR-106 inhibitor)及其阴性对照(NC inhibitor)、PTEN过表达质粒(PTEN)及其阴性对照(pcDNA)、miR-106过表达质粒(miR-106 mimics)及其阴性对照(miR-NC)购自上海Genepharma公司; TRIzol试剂、LipofectamineTM2000转染试剂购自美国Invitrogen公司; miR-106、PTEN、U6、β-action引物购自广州锐博生物科技有限公司; 双荧光素酶报告基因检测试剂盒、Annexin V-FITC/PI凋亡检测试剂盒购自北京索莱宝科技公司; 兔抗人PTEN、p-PI3K、p-AKT单克隆抗体购自英国Abcam公司。
选择2019年6月—2021年6月行手术切除的子宫内膜癌组织标本及癌旁组织(距离肿瘤组织≥0.5 cm的正常组织)23例,年龄34~73岁,平均(57.60±9.80)岁; 患者术前未经任何抗肿瘤治疗,术后经病理诊断为子宫内膜样腺癌20例,浆液性腺癌3例; 根据FIGO分期,临床分期为Ⅰ期18例, Ⅱ期5例。实时荧光定量聚合酶链反应(qRT-PCR)检测子宫内膜癌组织标本及癌旁组织中miR-106表达。本研究经本院伦理委员会批准。
1.2 方法
1.2.1 细胞培养及转染: RL95-2细胞采用含有10% FBS、100 U/mL青霉素和100 μg/mL链霉素的DMEM培养基常规培养; 待细胞生长至对数期时,将RL95-2细胞密度调整为1×105个/mL, 接种于6孔板中; 培养24 h后,分别转染miR-106 inhibitor、NC inhibitor、PTEN、pcDNA、PTEN+miR-NC及PTEN+miR-106 mimics共转染质粒(依次作为miR-106 inhibitor组、NC inhibitor组、PTEN组、pcDNA组、PTEN+miR-NC组及PTEN+miR-106组),转染方法参考Lipofectamine 2000转染试剂说明书; 转染6 h后更换新鲜DMEM培养基,继续培养48 h, 另设对照组(不做转染)。qRT-PCR检测细胞中miR-106与PTENmRNA表达,验证转染效率。
1.2.2 双荧光素酶报告基因实验: 根据生物信息学软件starbase预测显示, miR-106与PTEN存在靶向关系,根据miR-106与PTEN 3′UTR结合区域,分别构建野生型PTEN-3′UTR-WT和突变型PTEN-3′UTR-MUT质粒,均与miR-106 mimics、miR-NC共转染RL95-2细胞,并于37 ℃、5% CO2培养箱中培养48 h后,双荧光素酶报告基因检测试剂盒检测各组荧光素酶活性。
1.2.3 miR-106、PTENmRNA水平检测: TRIzol试剂提取总RNA,采用qRT-PCR法检测细胞中miR-106、PTENmRNA相对表达量,分别以U6和β-action为内参,采用2-△△Ct法计算miR-106、PTENmRNA相对表达量。miR-106: 上游引物(5′-3′)为AAGTGCTGACAGTGCAG, 下游引物(5′-3′)为GAACATGTCTGCGTATCTC。U6: 上游引物(5′-3′)为GCTTCGGCAGCACATATACTAAAAT,下游引物(5′-3′)为CGCTTCACGAATTTGCGTGTCAT。PTEN: 上游引物(5′-3′)为TGAGTTCCCTCAGCCGTTACCT, 下游引物(5′-3′)为GAGGTTTCCTCTGGTCCTGGTA。β-action: 上游引物(5′-3′)为GACCTCTATGCCAACACAGT, 下游引物(5′-3′)为AGTACTTGCGCTCAGGAGGA。
1.2.4 CCK-8法检测细胞增殖: 转染后的对数期RL95-2细胞,采用胰酶消化后调整细胞浓度为2×105个/mL, 接种至96孔板中,常规条件下培养24、48、72 h后,每孔加入10 μL的CCK-8溶液,孵育3 h后,检测酶标仪450 nm处的光密度(OD450 nm)值,绘制细胞生长曲线。
1.2.5 Transwell小室检测细胞迁移与侵袭: ① 细胞迁移实验。使用无血清培养基将RL95-2细胞制备成2×105个/mL的细胞悬液, Transwell上室中接种200 μL细胞悬液,下室接种600 μL完全培养基,常规条件培养24 h后,拭去未穿膜细胞, 4%多聚甲醛固定15 min, 0.5%结晶紫染色,显微镜下随机选择6个视野观察迁移细胞数。② 细胞侵袭实验。Transwell小室上室铺无血清培养基稀释的Matrigel基质胶,待胶凝固后,加入细胞悬液,其余步骤同细胞迁移实验。
1.2.6 流式细胞术检测细胞凋亡: 将各组对数生长期RL95-2细胞接种于96孔板中,培养48 h后收集细胞,磷酸盐缓冲液(PBS)洗涤,加入结合缓冲液混匀,再加入5 μL的Annexin V-FITC, 避光孵育20 min,上机前加入5 μL的PI溶液染色,流式细胞仪检测细胞凋亡率。
1.2.7 蛋白免疫印迹法(WB)检测细胞中PTEN、p-PI3K、p-AKT蛋白表达: 提取细胞总蛋白后,十二烷基硫酸钠聚丙烯酰胺凝胶电泳(SDS-PAGE)分离蛋白,转膜, 5%牛血清白蛋白封闭2 h, 加入PTEN、p-PI3K、p-AKT单克隆抗体和β-actin抗体(1∶1 500), 4 ℃孵育过夜, PBST洗涤膜3次,加二抗室温孵育2 h, ECL溶液显色,以β-actin为内参,Quantity One软件分析目的条带灰度值。
1.3 统计学方法

2 结 果
2.1 子宫内膜癌组织与癌旁组织miR-106表达
子宫内膜癌组织中miR-106表达水平为(3.53±0.42), 高于癌旁组织的(1.01±0.11), 差异有统计学意义(P<0.05)。
2.2 转染后各组细胞miR-106及PTEN mRNA的表达
与NC inhibitor组比较, miR-106 inhibitor组细胞miR-106表达水平降低,PTENmRNA表达水平升高,差异有统计学意义(P<0.05); 与pcDNA组比较, PTEN组细胞miR-106表达水平降低,PTENmRNA表达水平升高,差异有统计学意义(P<0.05); 与PTEN+miR-NC组比较, PTEN+miR-106组细胞miR-106表达水平升高,PTENmRNA表达水平降低,差异有统计学意义(P<0.05)。见表1。
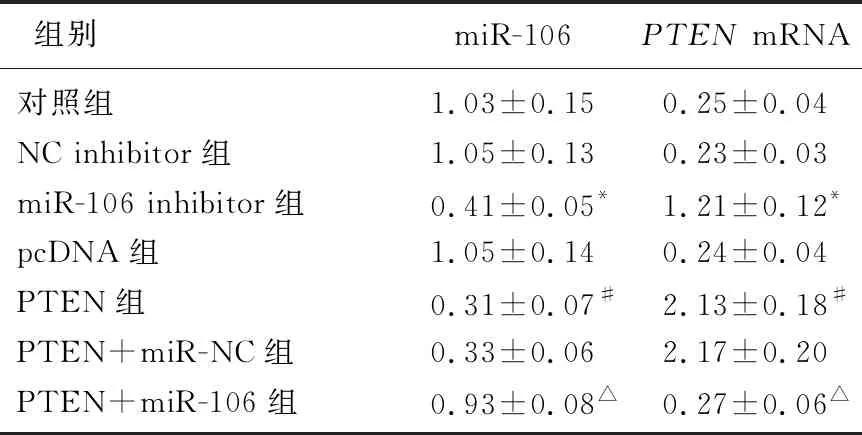
表1 转染后各组细胞miR-106表达
2.3 抑制miR-106表达对RL95-2细胞增殖、迁移、侵袭及凋亡的影响
NC inhibitor组与对照组RL95-2细胞的OD450 nm值、细胞迁移数、细胞侵袭数及凋亡率比较,差异无统计学意义(P>0.05); miR-106 inhibitor组RL95-2细胞OD450 nm值、细胞迁移数、细胞侵袭数低于NC inhibitor组,细胞凋亡率高于NC inhibitor组,差异有统计学意义(P<0.05); 上述结果表明抑制miR-106表达可显著抑制RL95-2细胞增殖、迁移和侵袭,促进细胞凋亡,见图1、表2。
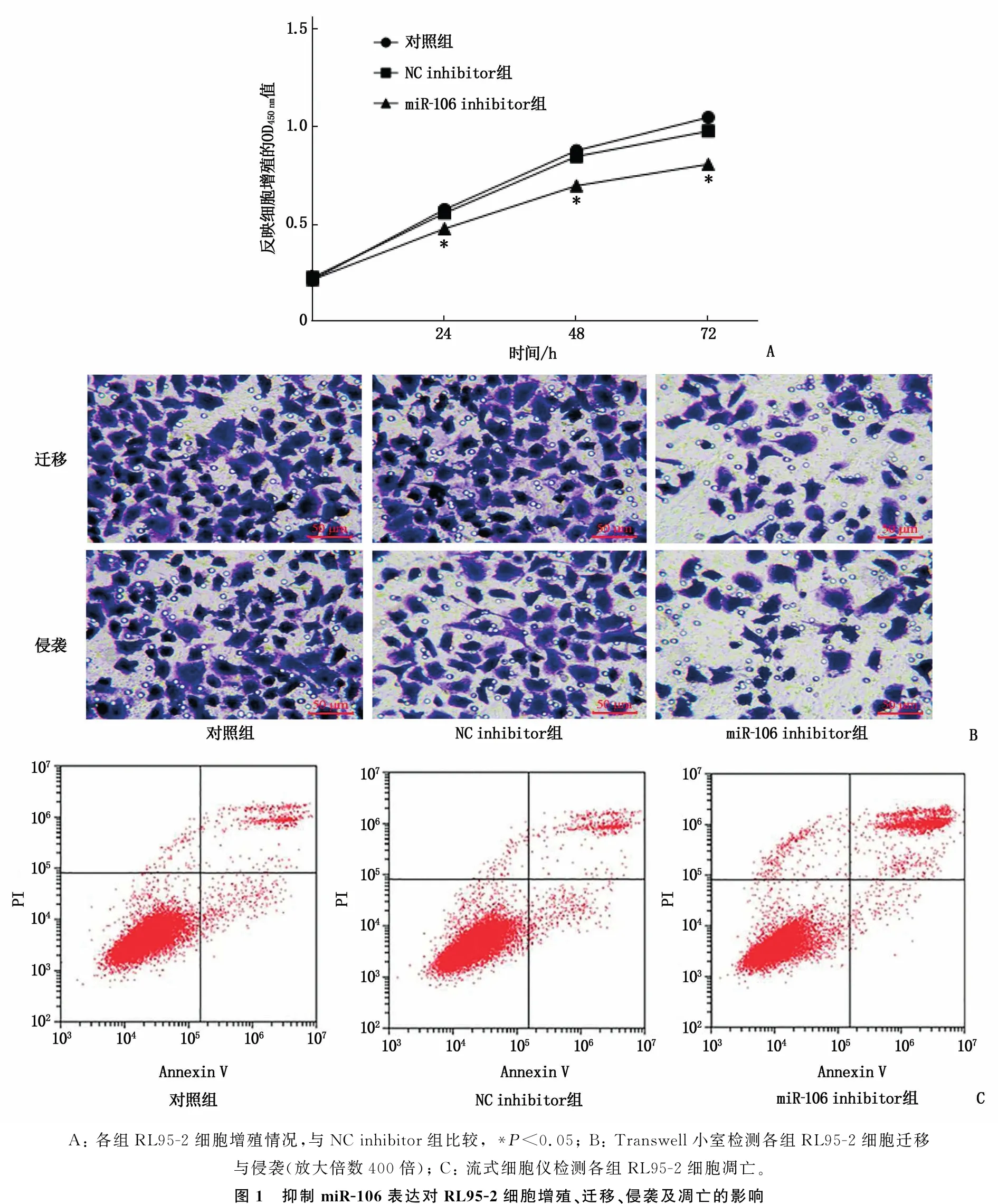
A: 各组RL95-2细胞增殖情况,与NC inhibitor组比较, *P<0.05; B: Transwell小室检测各组RL95-2细胞迁移与侵袭(放大倍数400倍); C: 流式细胞仪检测各组RL95-2细胞凋亡。图1 抑制miR-106表达对RL95-2细胞增殖、迁移、侵袭及凋亡的影响

表2 抑制miR-106表达对RL95-2细胞迁移、侵袭及凋亡的影响
2.4 miR-106与PTEN靶向调控关系
经starbase数据库预测显示, miR-106与PTENmRNA 3′UTR区有结合位点。双荧光素酶报告基因实验检测结果显示,过表达miR-106后, PTEN-3′UTR-WT的相对荧光素酶活性降低,差异有统计学意义(P<0.05); miR-106 mimics与PTEN-3′UTR-MUT共转染后,相对荧光素酶活性变化差异无统计学意义(P>0.05), 证明miR-106与PTEN存在靶向关系。见图2。
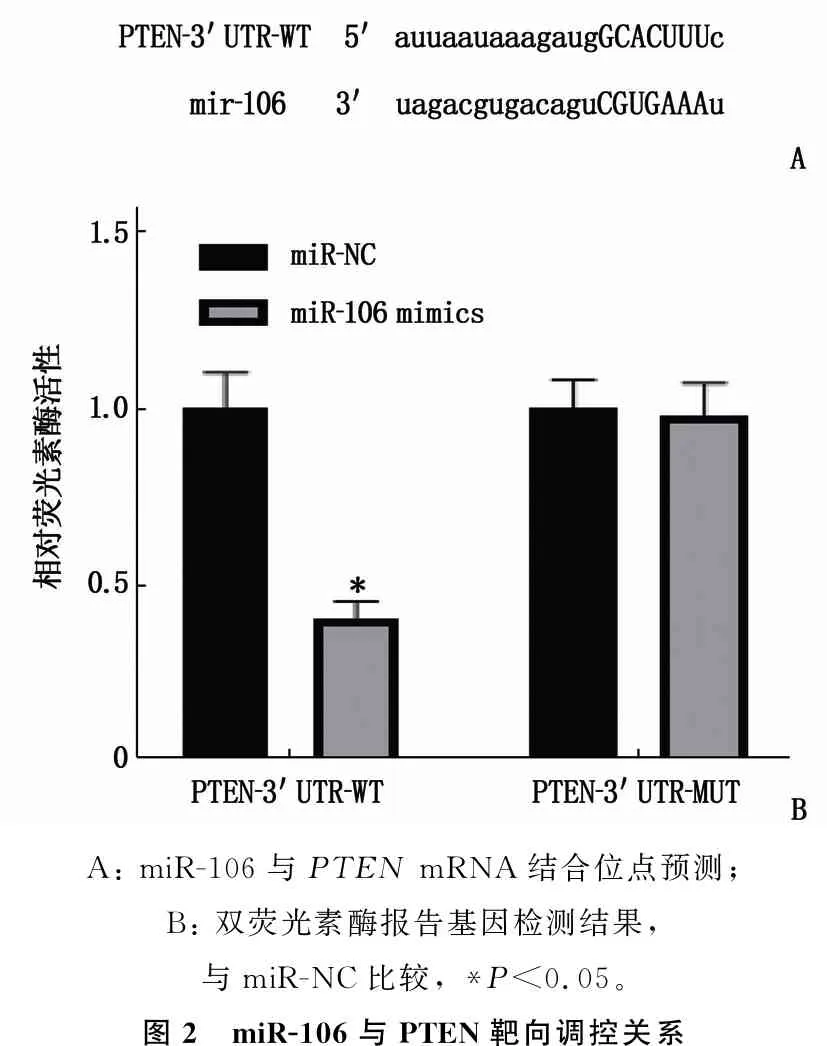
A: miR-106与PTEN mRNA结合位点预测; B: 双荧光素酶报告基因检测结果,与miR-NC比较, *P<0.05。图2 miR-106与PTEN靶向调控关系
2.5 抑制miR-106表达对PTEN/PI3K/AKT通路蛋白的影响
WB结果显示, NC inhibitor组与对照组细胞PTEN、p-PI3K、p-AKT蛋白表达水平的差异无统计学意义(P>0.05); miR-106 inhibitor组RL95-2细胞PTEN蛋白表达水平高于NC inhibitor组, p-PI3K、p-AKT蛋白表达水平低于NC inhibitor组,差异有统计学意义(P<0.05)。见图3、表3。
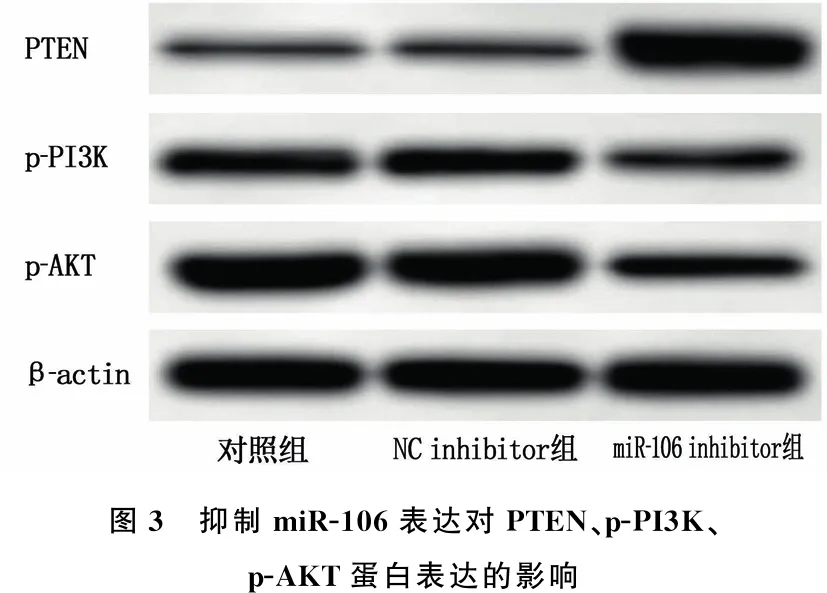
图3 抑制miR-106表达对PTEN、p-PI3K、p-AKT蛋白表达的影响

表3 抑制miR-106表达对PTEN/PI3K/AKT通路蛋白的影响
2.6 miR-106通过PTEN/PI3K/AKT通路影响RL95-2细胞增殖、迁移、侵袭及凋亡
为验证miR-106通过PTEN/PI3K/AKT通路对RL95-2细胞增殖、迁移、侵袭及凋亡的调控作用,在RL95-2细胞中过表达PTEN, 结果显示,与pcDNA组比较,过表达PTEN可降低p-PI3K、p-AKT蛋白表达水平,抑制细胞增殖、迁移与侵袭能力,促进细胞凋亡,差异有统计学意义(P<0.05); 在RL95-2细胞中同时过表达PTEN与miR-106,结果显示,与PTEN+miR-NC组比较, PTEN+miR-106组RL95-2细胞p-PI3K、p-AKT蛋白表达水平升高,细胞增殖、迁移与侵袭能力升高,细胞凋亡率降低,差异有统计学意义(P<0.05)。见图4、表4。
3 讨 论
研究[9]显示, miRNAs在肿瘤的发生发展中扮演重要的角色, miRNAs可通过调控靶基因的表达以及影响细胞增殖、迁移与侵袭等参与子宫内膜癌的发生发展。研究[10-11]显示,多种miRNAs如miR-652、miR-34b与子宫内膜癌细胞的增殖、迁移、化疗敏感性有关,但还有部分miRNAs的作用尚不清楚。miR-106是近年来发现的与肿瘤发生密切相关的一种miRNA,研究[12-13]表明, miR-106在结肠癌、胃癌、鼻咽癌等多种肿瘤中异常表达,发挥促癌基因的作用。研究[14]表明, miR-106b在子宫内膜癌组织中上调表达,与肿瘤组织分化、患者预后及细胞增殖、迁移有关。本研究结果显示, miR-106在子宫内膜癌组织中表达水平高于癌旁组织癌旁组织,差异有统计学意义(P<0.05)。张成伟等[15]研究表明, miR-106a-5p可靶向调控重组人转化生长因子B受体-2(TGF-BR2)促进肺腺癌细胞增殖、迁移和侵袭。本研究在RL95-2细胞中抑制miR-106的表达,结果显示, miR-106 inhibitor组RL95-2细胞OD450 nm值、细胞迁移和侵袭数显著低于NC inhibitor组,细胞凋亡率显著高于NC inhibitor组,表明抑制miR-106表达能显著抑制RL95-2细胞增殖、迁移和侵袭,促进细胞凋亡, miR-106可能在子宫内膜癌中发挥促癌作用,但其具体调控机制尚不清楚。
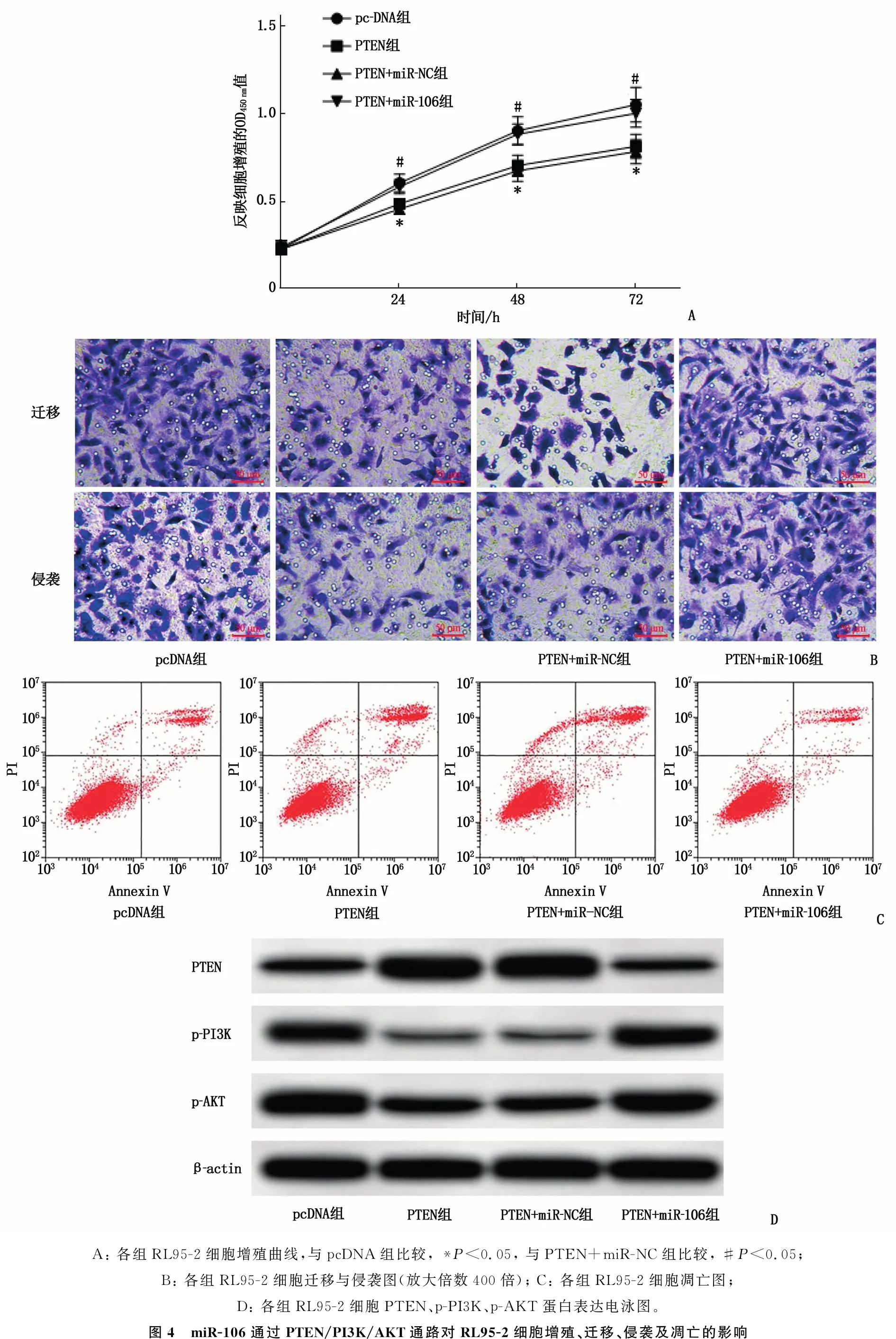
A: 各组RL95-2细胞增殖曲线,与pcDNA组比较, *P<0.05, 与PTEN+miR-NC组比较, #P<0.05; B: 各组RL95-2细胞迁移与侵袭图(放大倍数400倍); C: 各组RL95-2细胞凋亡图; D: 各组RL95-2细胞PTEN、p-PI3K、p-AKT蛋白表达电泳图。图4 miR-106通过PTEN/PI3K/AKT通路对RL95-2细胞增殖、迁移、侵袭及凋亡的影响

表4 miR-106通过PTEN/PI3K/AKT通路影响RL95-2细胞迁移、侵袭及凋亡
本研究经starbase数据库预测显示, miR-106与PTENmRNA 3′UTR区有结合位点,双荧光素酶报告基因检测结果显示, miR-106与PTEN存在靶向负调控关系。PTEN是一种抑癌基因,可将磷脂酰肌醇-3, 4, 5-三磷酸(PIP3)转化为二磷酸产物(PIP2), 使PI3K去磷酸化,抑制PI3K/AKT信号通路的活化,抑制肿瘤进展,如调控细胞生长、凋亡、黏附、迁移和侵袭[16-17]。研究[18]显示, PTEN在子宫内膜癌组织中低表达,激活PI3K/AKT信号通路可促进肿瘤细胞增殖。李玉兰等[19]研究表明, miR-144-3p可靶向调控PTEN/PI3K/AKT信号通路以促进口腔鳞癌CAL27细胞增殖、侵袭并抑制细胞凋亡。研究[20]显示, miR-374b可抑制PTEN的表达,激活PI3K/AKT通路,促进肺癌细胞的增殖。本研究发现抑制miR-106表达后, RL95-2细胞PTENmRNA 及其蛋白表达水平显著升高, p-PI3K、p-AKT水平显著降低,表明miR-106可靶向负调控PTEN表达,进而调控PI3K/AKT通路,参与子宫内膜癌的发生发展。本研究在过表达PTEN基础上过表达miR-106后发现, RL95-2细胞p-PI3K、p-AKT蛋白表达水平显著升高,细胞增殖、迁移与侵袭能力显著增强,细胞凋亡率显著降低,提示miR-106可通过靶向抑制PTEN表达来激活PI3K/AKT通路以促进RL95-2细胞增殖、迁移和侵袭,抑制细胞凋亡。
综上所述, miR-106可通过靶向抑制PTEN表达并激活PI3K/AKT通路来促进人子宫内膜癌细胞的增殖、迁移及侵袭,抑制细胞凋亡。鉴于PTEN/PI3K/AKT通路还涉及多个分子参与,其具体调控机制仍需进一步的研究。

