肝细胞癌患者Eag1表达与临床病理特征的相关性
陈丽燕, 顾春燕, 陈 莉
(1. 江苏省南通市第三人民医院 病理科, 江苏 南通, 226000;2. 南通大学医学院 病理教研室, 江苏 南通, 226000)
基于肝癌发生发展相关机制的研究成果以及分子靶向药物的临床推广,中国2000—2015年肝细胞癌(HCC)的发病率显著下降[1], 但同时也存在着HCC患者对放疗及化疗不敏感、副作用大等问题。Eag1作为钾离子通道之一,具有肿瘤标志物的特点。Eag1已在许多不同的癌细胞系中呈现表达,包括肠癌[2]、肝癌[3]和肺癌[4]等,但在正常组织中的表达却受到限制[5]。离子通道与细胞的免疫炎症反应间存在一定的相关性[6]。自RUDOLF VICHOW首次在肿瘤中发现了白细胞并提出肿瘤可能发生在炎症部位这一假说以来,肿瘤与炎症之间的联系就得到了证实[7]。外周血中性粒细胞与淋巴细胞比值(NLR)、血小板与淋巴细胞比值(PLR)均是反映机体免疫状态的重要标志物,其还可以综合反映患者的炎症状况[8]。相关研究[9]显示,NLR、PLR在评估癌症患者的治疗效果及预后方面有重要的价值。本研究探讨HCC患者中Eag1的表达及其与临床病理因素、NLR、PLR的相关性,现将结果报告如下。
1 资料与方法
1.1 一般资料
本研究经南通市第三人民医院伦理委员会批准,选取2011年12月—2016年12月首次接受肝癌手术并经病理学确诊为HCC的患者186例,术前均未接受抗肿瘤治疗,且具有完整的临床病理信息及随访资料,患者对本研究知情同意。
1.2 免疫组织化学(IHC)实验及结果判定
制备组织芯片,采用EnVision二步法行IHC实验, Eag1阳性定位于细胞膜或细胞质。每个病例随机观察5个高倍视野(40×10放大倍数),每个高倍视野计数200个肿瘤细胞(每个高倍视野的阳性表达率>70%为高表达, 30%~70%为中等强度表达, <30%为低表达)。选取同等数量的癌旁组织作为对比。收集186例HCC患者治疗前的中性粒细胞、淋巴细胞及血小板计数水平,计算NLR、PLR。
1.3 统计学分析
采用SPSS 21.0软件进行数据分析,计数资料采用[n(%)]表示,比较采用χ2检验,指标间相关性分析采用Spearman相关性检验;P<0.05为差异有统计学意义。
2 结 果
2.1 Eag1在HCC组织与癌旁组织中的表达
Eag1在HCC组织中的阳性表达率为82.3%(153/186), 阴性表达率为17.7%(33/186); Eag1在癌旁组织中的阳性表达率为56.5%(105/186), 阴性表达率为43.5%(81/186); Eag1在HCC组织与癌旁组织中的阳性表达率及阴性表达率比较,差异有统计学意义(P<0.01)。见图1。
2.2 HCC患者Eag1表达与临床病理特征的相关性
根据HCC Edmondson's分级法,将本研究HCC患者分为Ⅰ~Ⅳ级,其中Eagl在不同级别HCC中的表达见图2。HCC中Eag1阳性表达与乙型肝炎表面抗原(HBsAg)、血清甲胎蛋白(AFP)、肝硬化、肿瘤分级、脉管内癌栓、术后复发因素相关,具体表现为有HBsAg阳性、血清AFP≥400 ng/mL、有肝硬化、肿瘤分级Ⅲ~Ⅳ级、有脉管内癌栓、术后复发病理特征患者的Eag1阳性表达率升高,差异有统计学意义(P<0.05或P<0.01)。见表1。
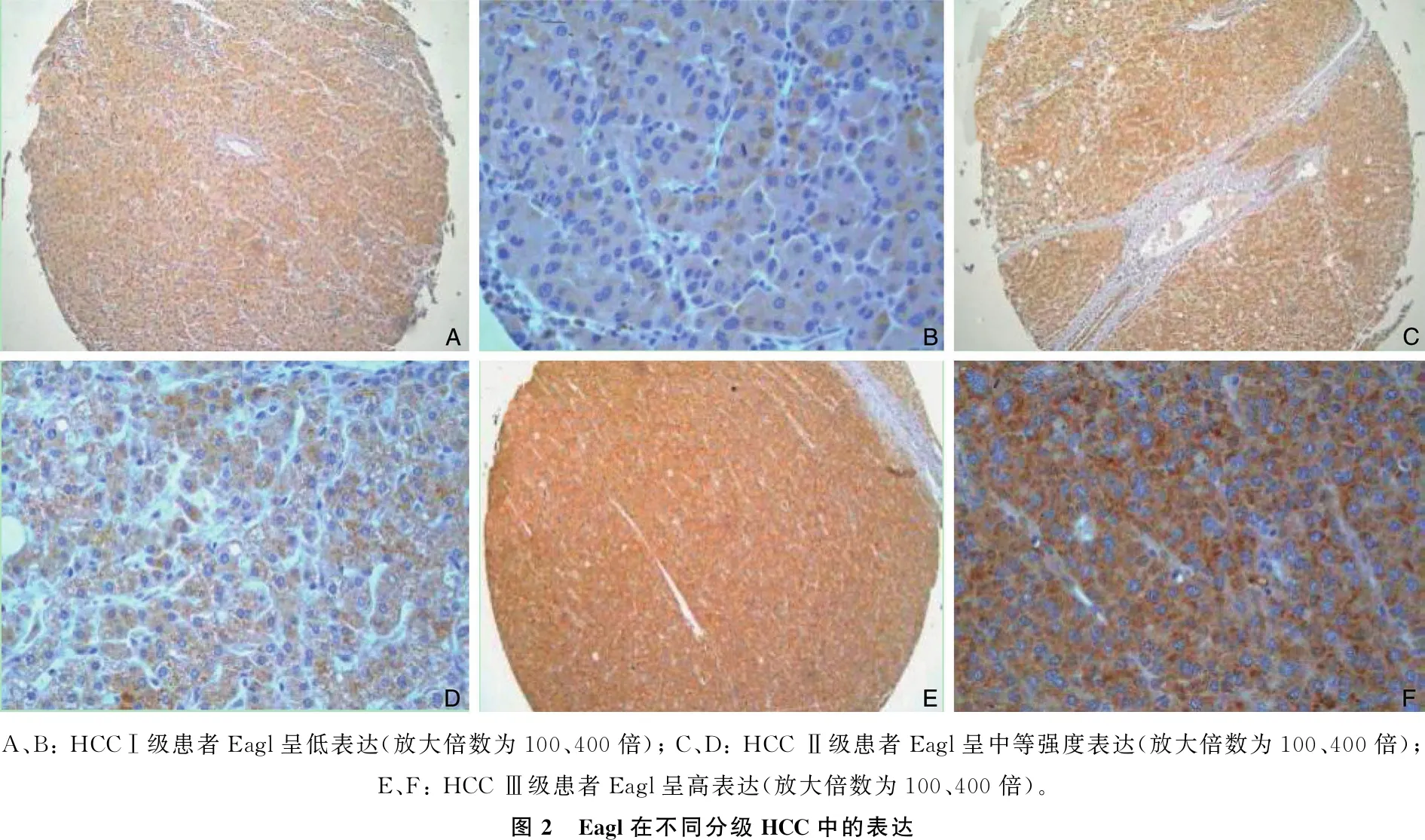
A、B: HCCⅠ级患者Eagl呈低表达(放大倍数为100、400倍); C、D: HCC Ⅱ级患者Eagl呈中等强度表达(放大倍数为100、400倍); E、F: HCC Ⅲ级患者Eagl呈高表达(放大倍数为100、400倍)。 图2 Eagl在不同分级HCC中的表达
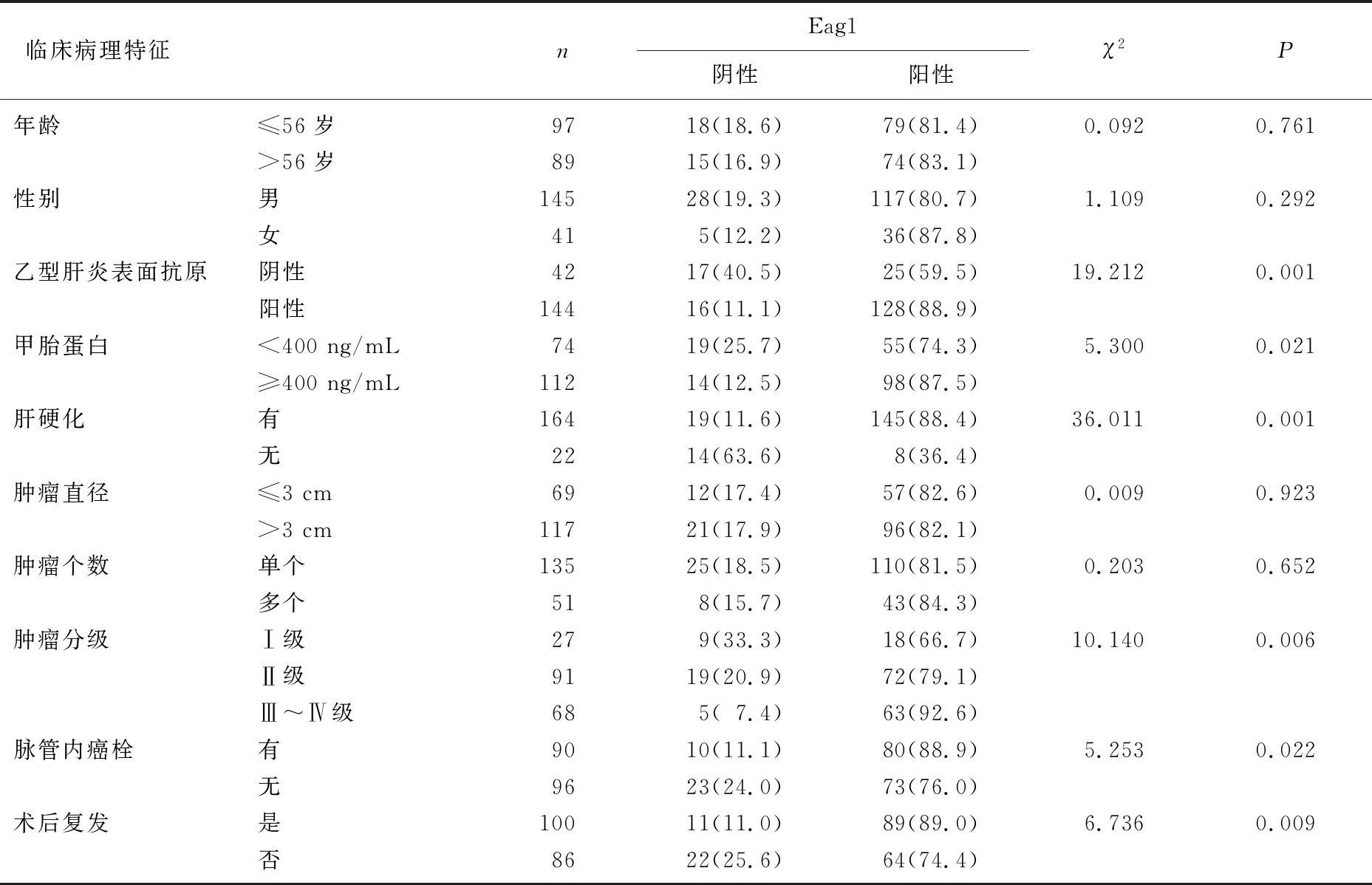
表1 Eag1表达与HCC患者临床病理特征的相关性[n(%)]
2.3 HCC患者治疗前外周血NLR、PLR与临床病理特征的相关性
本研究患者NLR中位数为2.26, PLR中位数为102.36。以中位数为截点,将患者分为高NLR组(NLR>2.26)与低NLR组(NLR≤2.26), 高PLR组(PLR>102.36)与低PLR组(PLR≤102.36), 每组93例。结果显示,患者治疗前外周血NLR、PLR与HBsAg、AFP、肝硬化、肿瘤分级、脉管内癌栓、术后复发因素相关,具体表现为有HBsAg阳性、血清AFP≥400 ng/mL、有肝硬化、肿瘤分级Ⅲ~Ⅳ级、有脉管内癌栓、术后复发病理特征的患者NLR、PLR较高,差异有统计学意义(P<0.05或P<0.01)。见表2、表3。
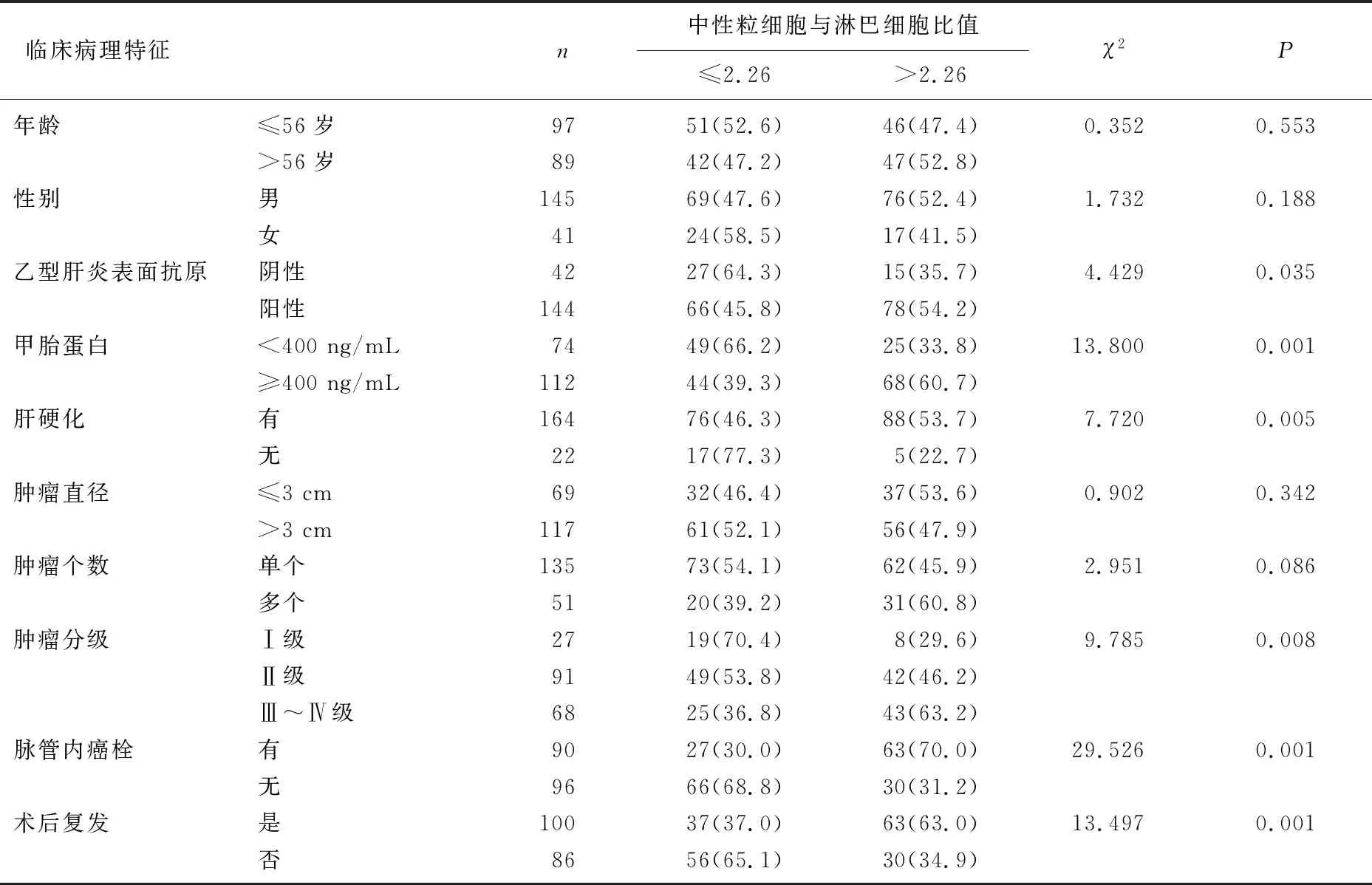
表2 NLR与HCC患者临床病理特征的相关性[n(%)]
2.4 HCC组织中Eag1表达与患者治疗前外周血NLR、PLR的相关性
结果显示, HCC组织中Eag1阳性表达与NLR、PLR呈显著正相关(P=0.001), 见表4。
3 讨 论
作为一种较为重要的癌症诱发因子, Eag1主要在中枢神经组织中表达,也可在胃腺主细胞、

表4 HCC组织中Eagl表达与外周血NLR、PLR的相关性
胰腺腺泡细胞、子宫内膜上皮细胞、胎盘、肥大细胞、精原细胞、组织巨噬细胞、肾上腺、淋巴滤泡的生发中心中表达[10]。Eag1在神经母细胞瘤的SHSY-5Y细胞、乳腺癌的EFM-19细胞和MCF-7细胞中高表达,在黑色素瘤细胞的IPC298细胞和IGRl细胞中, Eag1也呈阳性表达[11]。PCR、Southern印迹方法证实了Eag1在宫颈癌中呈强阳性表达[12]。HEMMERLEIN B等[13]通过IHC实验证实了Eag1在肝癌、胰腺癌、胆囊癌、肾细胞癌、前列腺癌、卵巢癌、甲状腺癌等多种恶性肿瘤组织中高表达。Eag1也被证实是一个具有高潜力活性的恶性肿瘤标志物[14]。本研究结果证实了Eag1在恶性肿瘤组织中呈高表达,即Eag1在HCC中的阳性表达率为82.3%, 显著高于癌旁组织的56.5%。有研究[15]显示, Eag1的表达也受癌组织大小、病理分级、浸润深度、转移情况、分期等多因素的影响。此外,离子通道与恶性肿瘤的转移、侵犯及脉管的形成也密切相关[16]。本研究结果证实了Eag1在HCC中的表达与血清HBsAg、血清AFP、肝硬化、肿瘤分级、脉管内癌栓、术后复发均相关(P<0.05)。
研究[17]证实,炎症的长期存在与肿瘤的发生、发展有一定的相关性。长期的炎症刺激可以增强恶性肿瘤的侵犯和远处转移能力[18]。目前研究[19]证实,炎症反应可以诱导破坏细胞DNA, 抑制正常细胞的凋亡和诱导血管的生成,促进肿瘤的进展。相反,当炎症被抑制时,肿瘤的发生、发展就会被阻止。NLR可在一定程度上反映机体抑制免疫监视功能及促进肿瘤最终发生发展的能力,是评估恶性肿瘤复发概率的重要因素[20]。PLR已被证实是胰腺癌[21]、肠癌[22]和胃癌[23]等恶性肿瘤中有价值的预后相关因素。研究[24]证实, NLR、PLR等一系列炎症因子与肝癌、胰腺肿瘤等多种肿瘤的组织学分级、浸润转移、发生及进展有一定的相关性。本研究结果证实了患者治疗前NLR、PLR与HBsAg、AFP、肝硬化、肿瘤分级、脉管内癌栓、术后复发均相关(P<0.05)。研究[8]证实离子通道与细胞内免疫炎症反应也存在相关性。本研究结果显示, Eag1在HCC中的表达与外周血NLR、PLR呈显著正相关(r=0.413,P=0.001;r=0.329,P=0.001)。
综上所述, HCC组织中Eag1表达水平显著增高,与HBsAg、血清AFP、肝硬化、肿瘤分级、脉管内癌栓、术后复发均相关,是判断癌症预后较差的有效指标,提示在HCC恶性进展中Eag1表达是关键的分子事件之一。HCC中Eag1高表达显著影响外周血中NLR、PLR, 提示其参与乙型肝炎病毒感染导致的慢性乙型肝炎、肝硬化、肝癌的发生过程,表明其与机体的免疫反应、炎症反应存在一定的相关性。因此, HCC中Eag1表达水平既能反映患者炎症状态,又能作为判断其预后的肿瘤标志物和治疗靶点。

