党参灰霉病拮抗细菌的筛选、鉴定及生防效果评价
孙 坤,任怡璇,贾凌云,陈大为
(西北师范大学生命科学学院,甘肃兰州 730070)
党参(Codonopsispilosula(Franch.)Nannf) 为桔梗科植物,主产于陕西、甘肃、四川等地,是我国重要的传统中药[1],其性味甘平,具有补中益气、生津止渴、扩张血管、改善微循环等功效[2-3].但是近年来,随党参种植面积的不断扩大,其病虫害发生日益严重,特别是灰霉病危害最为突出,阴湿地区发病率高达80%~100%,造成党参产量下降、品质降低,成为阻碍党参种植产业发展的主要因素之一[4].
灰霉病(Botrytis cinerea Pers.)是一种常见的植物病害,可危害多种植物.目前灰霉病的防治主要依靠化学杀菌剂和一些简单的农业措施,但是,随着化学杀菌剂的长期大量使用,灰霉病菌对很多药剂都产生了不同程度的抗性,防治效果开始大幅降低.同时,化学杀菌剂对环境造成严重污染、危害人畜健康[5].因此,筛选灰霉病拮抗菌并开发具有环境友好、安全等特性的生物防治药剂已成为国内外灰霉病防治研究的新趋势[6].近年来,已有诸多关于拮抗菌防治植物灰霉病的报道.例如,陈晋等[7]通过离体叶片和果实的抑病试验表明非洲哈茨木霉(Trichodermaafroharzianum)可有效防治黄瓜灰霉病;Jiang 等[8]通过温室试验发现贝莱斯芽孢杆菌(Bacillusvelezensis)可降低辣椒灰霉病的发病严重程度;石玉莹等[9]从番茄土壤中分离到的假单孢属细菌(Pseudomonassp.)对番茄灰霉病具有较好的防治作用;王潇冉[10]发现洋葱伯克氏菌(Burkholderiacontaminans)可有效防治草莓灰霉病.但是,在党参灰霉病拮抗菌的筛选及其生物防治的研究甚少.
为得到对党参灰霉病有良好防治效果的拮抗细菌,本试验分离了党参根际土壤和根、茎、叶中的细菌并对其进行筛选,并在盆栽条件下测定了拮抗菌对灰霉病的防治效果,以期为今后党参灰霉病的生物防治提供理论依据.
1 材料与方法
1.1 试验材料
供试病原菌:党参灰霉病菌(Botrytiscinerea)由西北师范大学生命科学学院逆境植物进化与发育实验室保存.
供试植株与土样: 2019年9月于甘肃省定西市安定区、渭源县和岷县采集党参种植试验田中的健康党参植株及其根际土壤,每一田地各采集3份,采集地信息见表1.随机挖取田中的健康党参植株,同时取其地表下5~10 cm处的新鲜土壤,采用抖落法[11]取与健康党参植株根系紧密结合的土壤,带回实验室于4 ℃冰箱保存备用.
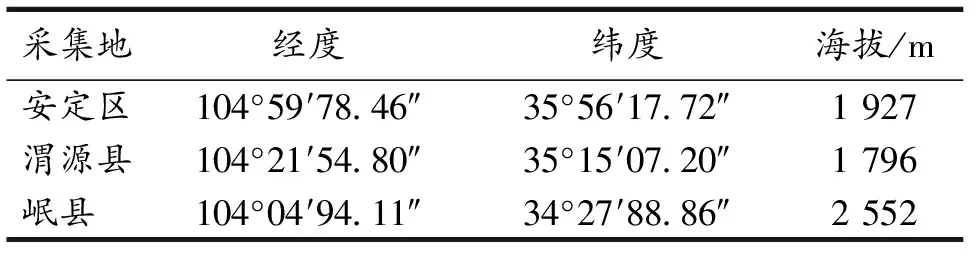
表1 样品采集地信息
1.2 拮抗细菌的分离与纯化
根际细菌的分离采用土壤稀释涂布法[12].先称取10 g土样,置于盛有90 mL 无菌水的三角瓶中(原液),于150 r·min-1恒温振荡12 h后制成土壤悬液备用.将制成的悬液稀释至10-5,10-6,10-7梯度,分别吸取 100 μL 均匀涂布于NA培养基上,每组处理重复3次.
内生细菌的分离采用组织匀浆法[13].将采集的新鲜党参用自来水清洗表面附着的土壤和灰尘并晾干.分别称取根、茎、叶各0.2 g于75%的乙醇中浸泡1 min后用浓度为1% NaClO溶液浸泡30 s,再用无菌水冲洗5次.取经消毒处理过的根、茎、叶放置于无菌研钵中,加入1.8 mL无菌水研磨至糊状,取1 mL加入到9 mL无菌水中,梯度稀释制成菌液浓度为10-5,10-6和10-7CFU·mL-1的稀释液,取稀释液100 μL分别涂布于NA平板上,每组处理3个重复.吸取等量用于最后一次清洗的无菌水涂布于NA培养基上检查表面灭菌效果.28 ℃恒温培养箱中培养48 h,根据菌落形态、大小等特征挑取不同的单菌落并在平板上划线纯化.根际细菌以GJ+采集地的方式命名,如:GJWY-1…n.分离自根、茎、叶的内生细菌分别以NS+采集地首字母+1-1…n、NS+采集地首字母+2-1…n和NS+采集地首字母+3-1…n命名后于4 ℃冰箱斜面保存.
1.3 拮抗细菌的筛选
1.3.1 拮抗细菌的初筛 采用平板对峙法[14],十字交叉法在PDA平板背面做标记,中心位置接倒置的灰霉病菌菌饼(d=5 mm),于十字两端等距离(距中心位置30 mm)处划线接种供试细菌进行对峙培养,以只接灰霉病菌菌饼的平板为对照,每组处理3个重复.28 ℃培养5 d后测量菌落直径,并按公式计算抑制率[14]:
1.3.2 拮抗细菌的复筛 采用菌丝生长速率法[12],将初筛抑制率最高的菌株NSW3-1接种在NB液体培养基中,28 ℃,180 r·min-1恒温振荡培养48 h后,4 ℃,10 000 r·min-1离心20 min,所得上清液经0.22 μm滤膜过滤得到无菌发酵滤液.取制备好的无菌发酵滤液2 mL与冷至45 ℃左右的PDA培养基18 mL混合加入培养皿内,制成含有拮抗菌发酵液的固体平板.于平板中央接入灰霉病菌菌饼(d=5 mm),每组处理3个重复,以加入2 mL无菌水的PDA作对照.28 ℃下恒温培养,对照组菌丝将铺满整个平板时用十字交叉法测量对照菌落直径和处理菌落生长直径,并计算抑制率[14].
1.4 拮抗细菌的鉴定
1.4.1 表型特征及生理生化测定 将筛选出的拮抗菌于NA培养基上划线培养,30 ℃恒温培养2 d,观察菌落形态、大小以及经革兰氏染色后的颜色等特征.参照《常见细菌系统鉴定手册》[15]和《伯杰氏细菌鉴定手册》[13]中的方法对菌株的接触酶、淀粉水解、明胶液化等生理生化指标进行测定.
1.4.2 分子生物学鉴定 利用16S rDNA序列分析方法,采用Cheng等[16]的方法提取细菌DNA.使用细菌通用引物27F(5′-AGAGTTTGATCCTGGCTCAG-3′)和1492R(5′-GGTTACCTTGTTACGACTT-3′)对提取的基因组DNA进行PCR扩增[17].PCR扩增程序为:94 ℃预变性5 min,94 ℃变性30 s,50 ℃退火30 s,72 ℃延伸1 min,从第2步到第4步共30个循环,72 ℃终延伸5 min,4 ℃ 永久保存.所得PCR产物由测序公司进行序列测定.测序结果登录NCBI网站进行BLAST序列比对,获得近缘物种的信息,利用MEGA7软件Neighbor-joining法构建系统发育树(T代表模式菌株),确定分类位置.
1.5 室内盆栽防效测定
采用叶面喷雾的方法,试验设计3个处理组1×106,1×107和1×108CFU·mL-1,2个对照组无菌培养基(不接菌)和病原菌+无菌培养基(CK).
拮抗细菌发酵液的制备:将筛选出的拮抗细菌接种在NA培养基上,28 ℃培养1 d.以接种环挑取菌株菌落,接入装有50 mL NB液体培养基的150 mL三角瓶中,28 ℃,180 r·min-1振荡培养24 h,得菌株种子液.将种子液按1%接种量加入到50 mL(150 mL三角瓶)的NB液体培养基中,28 ℃,180 r·min-1振荡培养48 h,得菌株发酵液.
分生孢子悬浮液的制备:将党参灰霉病菌(Botrytiscinerea)在PDA平板上培养7 d后在培养基中加入无菌水,轻轻震荡30 min后用血球计数板将分生孢子浓度调整为1×106个·mL-1备用.
党参种子的萌发及移栽:党参种子于25 ℃恒温光照培养箱萌发,条件设定为12 h光照、12 h黑暗,种子露白后移栽入装有营养土(灭菌)的花盆中,待党参长至6~8叶期时进行防效测定.
预防试验:将稀释的拮抗细菌发酵液(20 mL)喷施于党参幼苗,以叶片布满稀释的发酵液而不滴水为度.待植株叶片上的发酵液变干后,接种灰霉病菌孢子悬浮液(20 mL)于各处理植株,两组对照的处理分别为只喷施NB液体培养基和喷施NB液体培养基后再接种病原菌孢子悬浮液,25 ℃保湿处理48 h,14 d后按病害分级统计发病情况,并按公式计算病情指数和防效.
治疗试验:将党参灰霉病菌孢子悬浮液(20 mL)喷施于党参幼苗,25℃保湿48 h后,将拮抗细菌稀释发酵液(20 mL)喷施于处理后的党参幼苗,两组对照的处理分别为只喷施NB液体培养基和接种病原菌孢子悬浮液后再喷施NB液体培养基,喷雾处理后第14 d调查发病情况并计算病情指数和防治效果.
按病斑面积占叶片总面积的百分比对党参灰霉病发病情况进行定级[18]:0级(0%)、1级(5%以下)、3级(6%~10%)、5级(11%~25%)、7级(26%~50%)、9级(>50%).
1.6 数据处理
数据采用Excel 2007软件进行统计分析,利用SPSS 17.0软件的Duncan氏新复极差法对数据进行差异显著性检验(P<0.05),结果用“平均值±标准误差”表示.
2 结果与分析
2.1 拮抗细菌的初筛
从土壤样品中分离出39株根际细菌,其中抑制率>50%的为12株,占全分离的30.77%.党参根、茎、叶中分别分离出11株、3株和8株,共22株内生细菌,其中抑制率>50%的为3株,占全分离的13.64%.初筛结果显示,分离自渭源栽培党参叶组织的菌株NSW3-1抑制率最高,达到92.31%(表2).
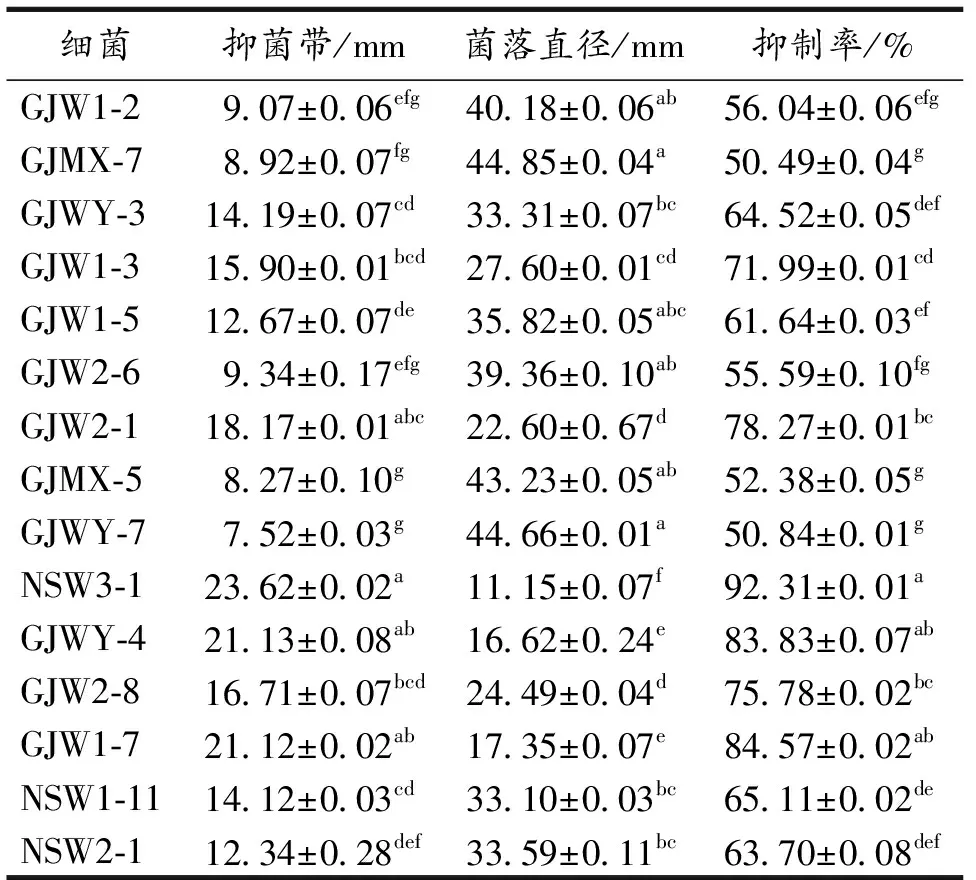
表2 拮抗细菌对灰霉病菌的抑制作用初筛结果
2.2 拮抗细菌的复筛
对初筛效果最好的菌株NSW3-1进行复筛,
结果表明,NSW3-1的发酵滤液对党参灰霉病菌具有明显的抑制作用(图1),且抑制率可达86.88%.
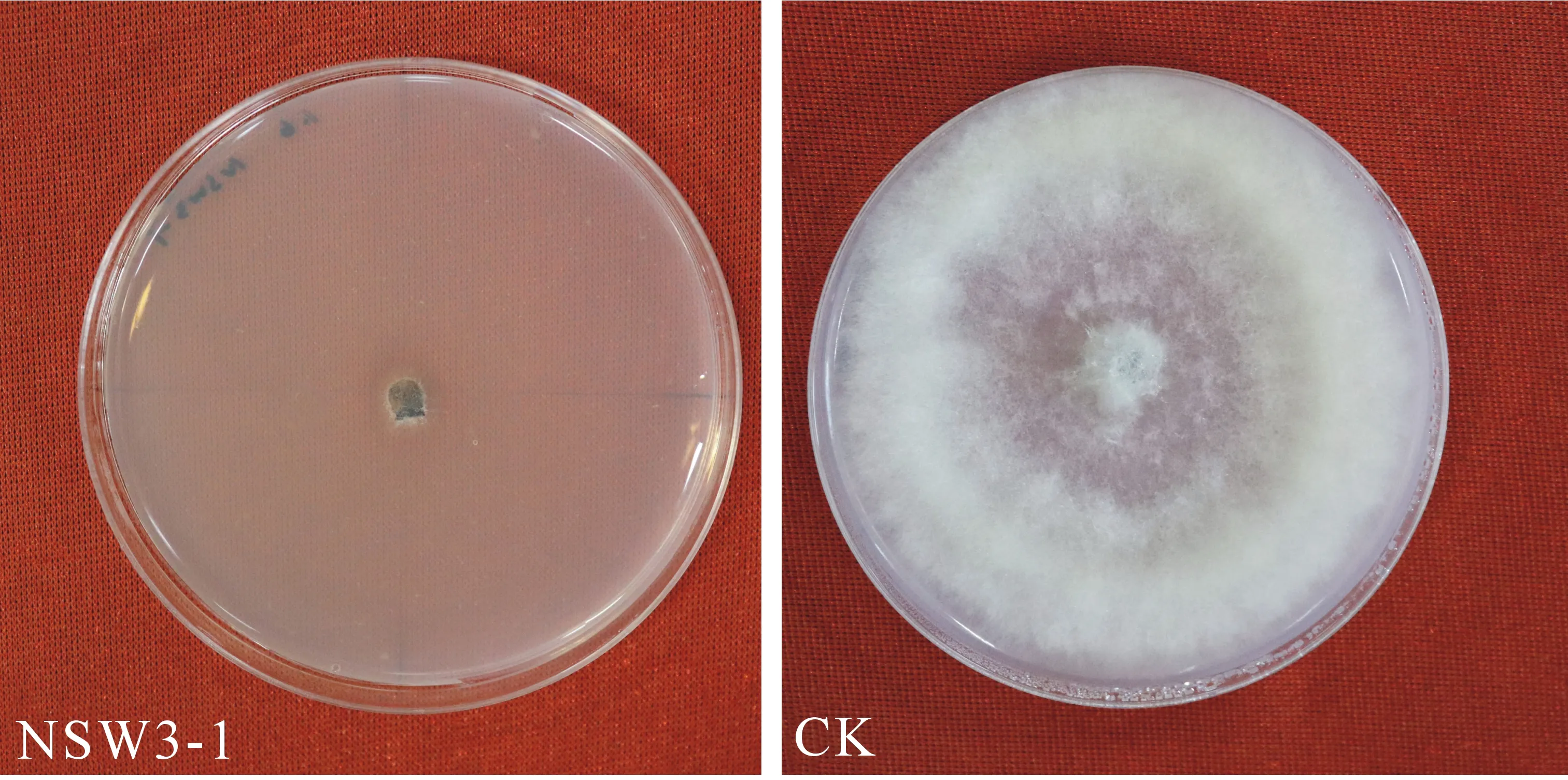
图1 拮抗细菌NSW3-1无菌发酵滤液对党参灰霉 病菌菌丝生长的抑制作用
2.3 拮抗细菌NSW3-1的鉴定
2.3.1 表型特征观察及生理生化测定 拮抗细菌NSW3-1于NA培养基上菌落呈白色圆形,大小中等,半透明,表面粗糙,边缘由不规则到整齐(图2A-C).光学显微镜(100×)下观察细胞(图2D)为杆状,多为单个排列、两端平滑,革兰氏染色呈紫色为阳性.由表3可知,NSW3-1可用于葡萄糖、麦芽糖、甘油和柠檬酸盐,能有效液化明胶、还原硝酸盐、水解淀粉,V-P实验、接触酶实验、甲基红试验均呈阳性,与《常见细菌系统鉴定手册》[15]和《伯杰氏细菌鉴定手册》[13]中描述的枯草芽胞杆菌(B.subtilis)的生理生化特征基本相同,初步鉴定为枯草芽胞杆菌.
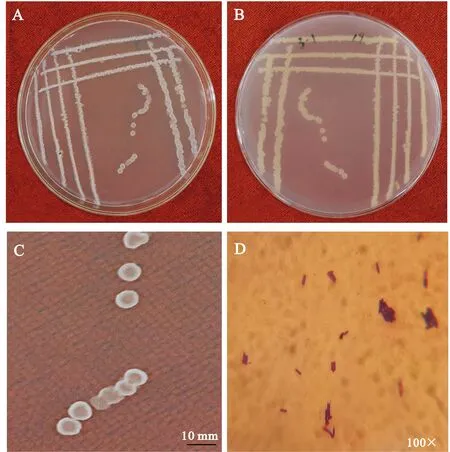
A 正面;B 背面;C 单菌落;D 光学显微镜下的显微形态

表3 生理生化测定结果
2.3.2 16S rDNA序列分析与系统进化树构建 经测序分析,菌株NSW3-1的16S rDNA基因片段长度约为1 436 bp,提交Genbank获得的注册号为MW131662.系统发育树中(图3),菌株NSW3-1与2株枯草芽胞杆菌的模式菌株(B.subtilis)位于同一分支,其聚类支持强度为100%.结合形态和生理生化特征,最终确定菌株NSW3-1为枯草芽胞杆菌(B.subtilis).
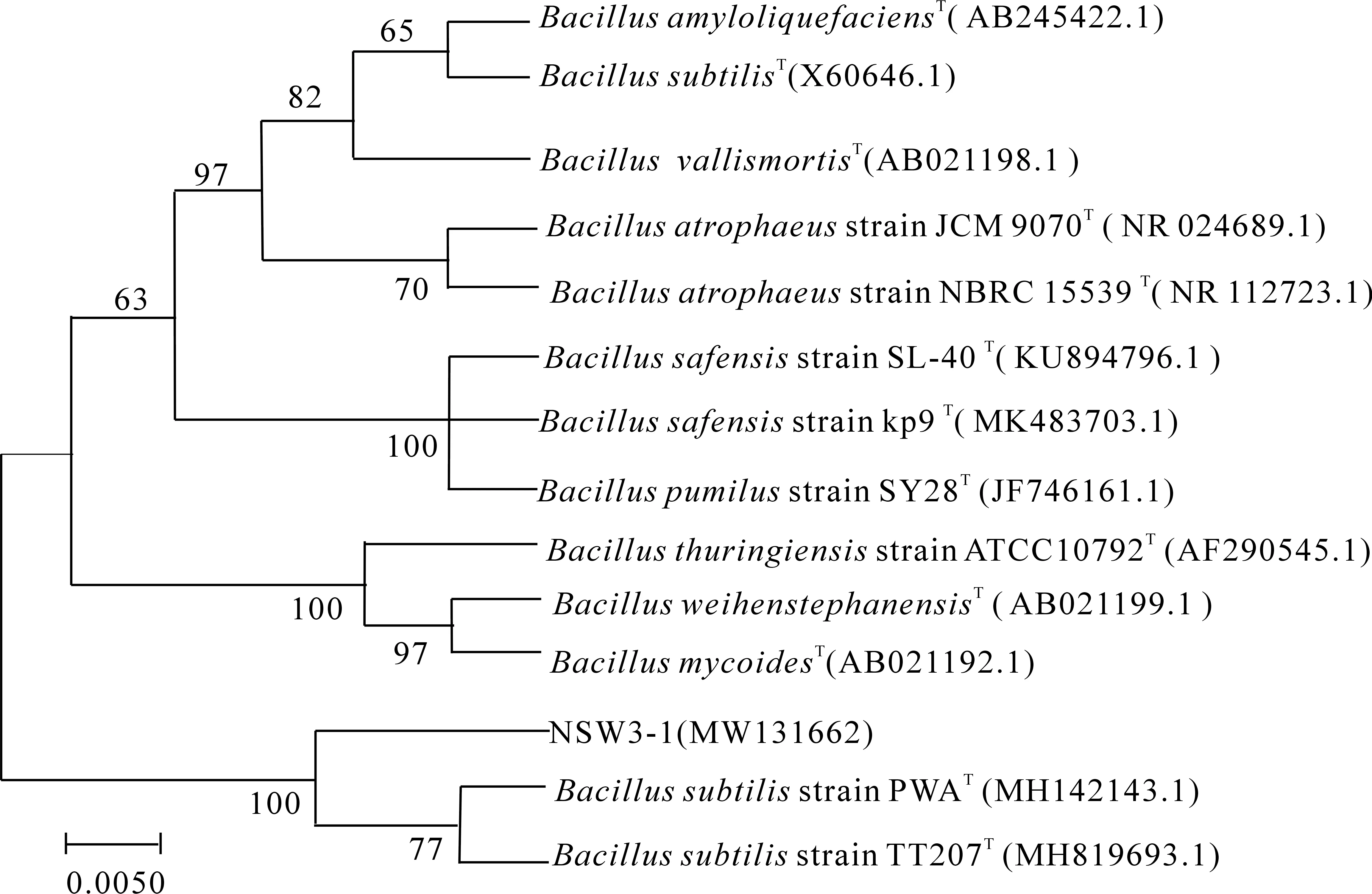
图3 基于16S rDNA 序列构建的菌株NSW3-1的系统发育树
2.4 室内盆栽防效测定
由表4可知,接种党参灰霉病病原菌第14 d时,预防试验和治疗试验的对照组党参(CK)病情指数分别为45.22和51.70,而经菌株NSW3-1不同浓度发酵液处理的党参病情指数显著低于对照组.结果表明,灰霉病的防效随发酵液浓度的增大而增大.其中,1×108CFU·mL-1的发酵液对灰霉病的预防和治疗效果最好,分别为89.42%和81.20%;当发酵液浓度为1×107CFU·mL-1时,预防效果和治疗效果下降至66.89%和65.08%;发酵液浓度为1×106CFU·mL-1时,预防效果和治疗效果分别为55.64%和56.88%.

表4 盆栽试验中菌株NSW3-1对党参灰霉病的防治效果
3 讨论
生物防治由于具有安全、绿色等特点,在植物病害防治上已成为一个重要的研究领域,该方法运用于药用植物病害防治可保证用药安全[19-20].此前,诸多学者已从药用植物生存环境中筛选到对灰霉病具有生防作用的菌株.陈长卿等[21]从人参茎部分离出一株内生拮抗细菌NJ13(Bacillusmethylotrophicus),对人参灰霉病的平均防效可达73.86%.蒋妮等[22]从三七植株土壤中分离到棘孢木霉(Trichodermaasperellum),其对三七灰霉病有较好的防治作用.但在我国常见中药材党参的种植中,党参灰霉病的生物防治仍鲜有报道.本研究通过初步筛选得到了15株对党参灰霉病菌有较强抑制作用的细菌,其中抑制率最高(92.31%)的细菌为NSW3-1,经鉴定该细菌为枯草芽胞杆菌,该菌株分离自渭源栽培党参的叶组织,其发酵滤液可抑制灰霉病菌菌丝的生长,这可能与发酵滤液中含有抗菌蛋白有关[23].另外,芽孢杆菌属是一类具有重大潜在价值的微生物资源,可防治多种植物灰霉病.潘晓梅[24]发现蜡样芽孢杆菌(Bacilluscereus)对番茄灰霉病具有防治作用;张立新等[25]筛选到的特基拉芽孢杆菌(Bacillustequilensis)对采后樱桃灰霉病的发生有良好的防控效果;Mousavi等[26]发现枯草芽胞杆菌发酵液对蔷薇灰霉病的防治亦有显著效果.其中,枯草芽胞杆菌因具有抑菌广谱性、繁殖迅速、易于储存、对环境友好等优点被广泛应用[27-29].因此,本试验筛选鉴定的枯草芽胞杆菌NSW3-1可为党参灰霉病的生物防治提供菌种资源.
利用枯草芽胞杆菌进行室内盆栽防效测定时,Wang等[30]用预防试验测定了菌株WXCDD105的发酵液对番茄灰霉病的预防效果,李丽梅等[31]采用了相同的方法,测定了菌株BS03对黄瓜灰霉病的预防效果.而本试验将枯草芽胞杆菌发酵液稀释为3个不同浓度梯度通过先接种拮抗菌再接种病原菌和先接种病原菌再接种拮抗菌的方法对党参灰霉病进行了预防和治疗试验.结果显示,枯草芽胞杆菌NSW3-1的低浓度和高浓度发酵液在室内盆栽的预防和治疗试验中均有较好的防治作用.当发酵液浓度为1×106CFU·mL-1时,治疗效果为56.88%,优于预防效果(55.64%),浓度为1×107和1×108CFU·mL-1时,预防效果优于治疗效果,因此利用菌株NSW3-1防治党参灰霉病时应采用预防为主,治疗为辅的方法.乔俊卿等[32]利用枯草芽胞杆菌PTS-394浓度为1×107CFU·mL1的发酵液进行预防试验时预防效果为58.2%,Bu等[33]发现枯草芽胞杆菌L1-21浓度为1×108CFU·mL-1的发酵液对灰霉病的预防效果为86.57%,而菌株NSW3-1同浓度的发酵液预防效果分别达到66.89%和89.42%,均高于上述试验的预防效果.有关商业化枯草芽胞杆菌可湿性粉剂对灰霉病的防治也有报道.王学慧等[34]利用枯草芽胞杆菌可湿性粉剂2 000倍对番茄灰霉病的治疗效果为83.06%,而本试验中NSW3-1的治疗效果为56.88%,65.08%和81.20%,低于枯草芽胞杆菌可湿性粉剂,这可能是由于环境条件的多变性导致单一菌株对灰霉病的防治效果低下.而经过制剂加工往往避免了外界因素对拮抗菌的影响,因此防治效果优于NSW3-1[35].
综上,枯草芽胞杆菌NSW3-1不仅有效防治党参灰霉病,同时具备绿色、无污染、对环境友好和维持生态平衡等特点,有开发为防治药用植物病害新型生物源农药的潜力.但是,目前本试验仅在盆栽条件下对党参灰霉病的生防效果进行了评价,该菌在田间对党参灰霉病的防治效果及其分子机制还有待进一步研究.

