谷胱甘肽过氧化物酶在胶质瘤患者中的表达及对生存预后的影响
任晓梅,张 立,辛 宝,钱文文,夏曾润,祁 蒙,杜小平,史传道,刘启玲,张荣强
1陕西中医药大学公共卫生学院营养与食品卫生学教研室,陕西咸阳 712046 2青岛大学医学院附属烟台毓璜顶医院临床营养科,山东烟台 264000 3安康市富硒产品研发中心,陕西安康 725000 4陕西中医药大学公共卫生学院流行病与卫生统计学教研室,陕西咸阳 712046
胶质瘤是一种人类中枢神经系统常见的肿瘤,具有较强的侵袭性。根据恶性程度,世界卫生组织将其分为Ⅰ~Ⅳ级,其中Ⅰ、Ⅱ级胶质瘤的增殖性低、不具有侵袭性,患者的预后相对较好,称为低级别胶质瘤(low grade glioma,LGG)。胶质母细胞瘤(glioblastoma,GBM)为Ⅳ级,其恶性程度高,呈现浸润性生长,且具有坏死倾向[1],预后极差,中位总体生存时间约14.6个月[2],被公认为是最致命的胶质瘤[3]。谷胱甘肽过氧化物酶(glutathione peroxidase,GPX)是人体主要的过氧化物分解酶,其家族包含8种亚型(GPX1~GPX8),在体内发挥重要的抗氧化作用[4]。目前,GPX家族基因对胶质瘤的影响及作用机制尚不清楚。本研究拟从肿瘤基因图谱计划(The Cancer Genome Atlas,TCGA)数据库获取胶质瘤患者的临床数据及其GPX家族基因表达谱,利用生物信息学技术分析GPX在不同级别胶质瘤样本中表达情况及其对患者预后的影响,筛选出影响患者预后的危险因素并建立预测模型,探索GPX在不同级别胶质瘤发生发展中的作用,为预测患者生存期限和制定靶向治疗措施提供依据。
资料和方法
数据收集从TCGA数据库(https://cancergenome.nih.gov)中获取胶质瘤患者的基因表达数据,根据肿瘤分级将其分为GBM和LGG两组。同时选取TCGA数据库中5例癌旁组织与基因型和基因表达量关联数据库中的2642例正常组织作为对照组,分析GPX1~GPX8基因在肿瘤组织和对照组中表达水平的差异。
生存与预后分析采用Kaplan-Meier生存分析和Cox回归分析不同GPX表达水平患者的总生存率(overall survival,OS)、无病生存期(disease-free survival,DFS)、疾病特异性生存期(disease-specific survival,DSS)和无进展生存期(progression-free survival,PFS)的情况。
生存预后的影响因素分析利用多因素和单因素Cox比例风险回归分析判定GPX表达水平、年龄、性别、肿瘤分期、治疗方式等因素与患者OS之间的关系,从而筛选出与胶质瘤患者OS存在显著相关性的危险因素。
最小绝对收缩选择算子模型构建最小绝对收缩选择算子(least absolute shrinkage and selection operator,Lasso)回归是一种基于惩罚的变量选择方法。为验证Cox回归分析结果,本研究进一步通过R语言“glmnet”程序,采用Lasso回归法对GPX1~GPX8 8个变量进行降维处理,进而筛选影响胶质瘤患者的危险因素。Lasso模型中的最优参数(λ)选择通过最小标准使用5倍交叉验证,部分似然偏差为轴,log(λ)为X轴。
生存预测模型的建立基于Cox和Lasso回归得到的危险因素建立胶质瘤患者列线图预测模型。列线图是一种可视化的回归模型,根据预测模型中自变量回归系数制定评分标准,然后给每个自变量一个评分值,从而计算出每例患者的总分,最后通过总得分与预后概率之间的转换函数计算每例患者的预后概率[5- 6]。
危险因素验证中国脑胶质瘤基因组图谱计划数据库中下载数据集mRNA-seq_325,收集患者的基因表达和生存资料,将筛选出来的影响患者预后的关键因素进行再次验证,确定其对患者预后的影响。
统计学处理计量资料的比较采用秩和检验,使用R语言对所得数据进行分析。采用R语言软件包制作列线图,计算一致性指数,并绘制校正曲线评估模型的预测效能。计数资料以百分比表示,采用卡方检验,P<0.05为差异有统计学意义。
结 果
基本特征共纳入胶质瘤患者663例,其中LGG 510例、GBM 153例,GBM患者的病死率显著高于LGG患者(P=0.001),男性患者明显多于女性(P=0.036),各族人群之间的患者分布差异无统计学意义(P=0.259)(表1)。
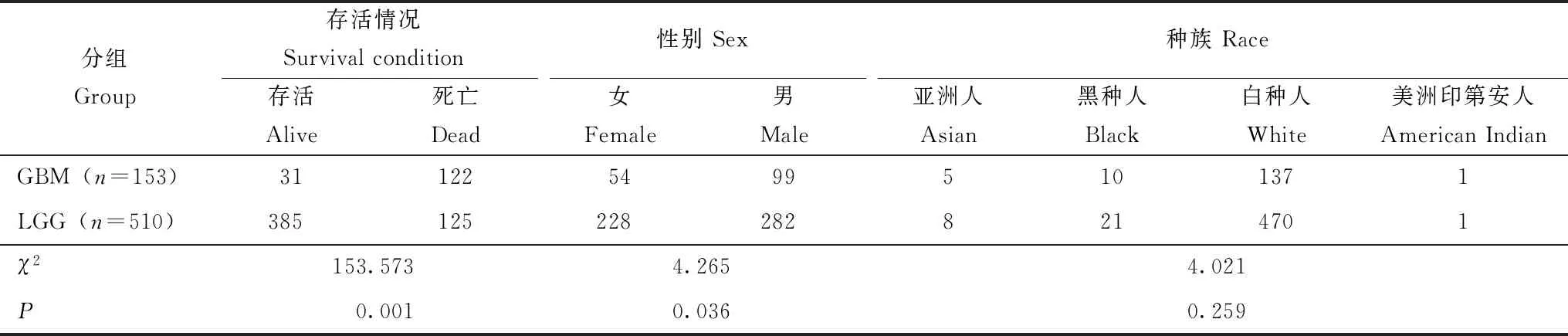
表1 两组胶质瘤患者的基本特征(n)
Kaplan-Meier生存分析对两组胶质瘤患者生存资料和临床资料进行Kaplan-Meier生存分析,结果显示LGG和GBM患者的DSS中位时间分别为7.6、1.2年,差异有统计学意义(P<0.001);OS中位时间分别为6.5、1.1年,差异有统计学意义(P<0.001);PFS中位时间分别为3.4、0.5年,差异有统计学意义(P<0.001);但DFS中位时间差异无统计学意义(P>0.05)(图1)。
GPX家族基因mRNA表达情况与TCGA数据库中2647例配对的正常人群比较,GPX1、GPX3、GPX4、GPX7、GPX8的表达在胶质瘤患者中显著升高(P均<0.001),且除GPX3外,GBM患者的表达显著高于LGG患者(P均<0.001);胶质瘤患者GPX2的表达显著高于正常人群(P<0.001),但是两组患者之间的表达差异无统计学意义(P>0.05);LGG患者的GPX5的表达显著低于正常人群(P<0.001),但是两组患者之间的表达差异无统计学意义(P>0.05)(图2)。
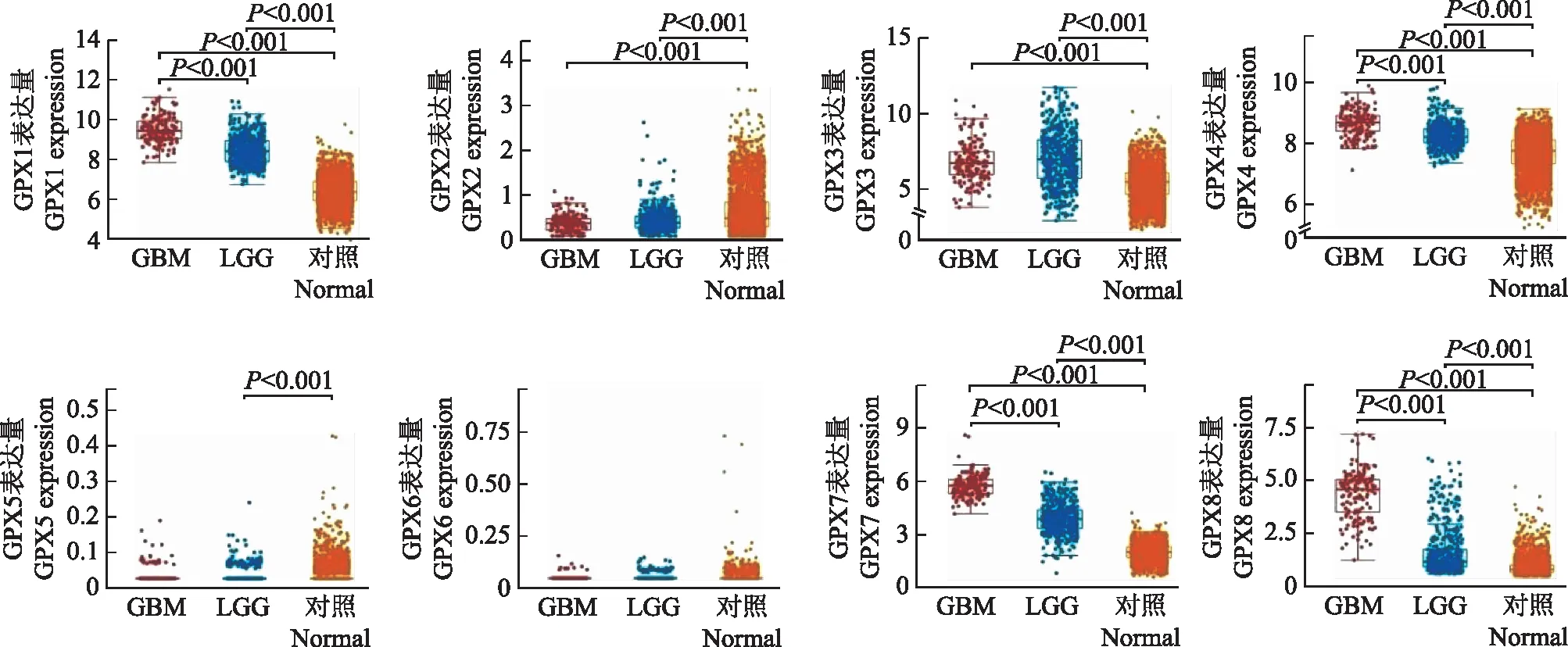
GPX:谷胱甘肽过氧化物酶
GPX表达与两组患者预后的关系为进一步研究GPX基因表达水平与胶质瘤患者预后的相关性,以GPX水平高低为分组依据,绘制Kaplan-Meier生存曲线,通过Log Rank法分别比较两组患者生存曲线差异,结果显示在GBM组,与低表达相比,GPX1(P=0.013)和GPX4(P=0.040)高表达患者的PFS明显缩短(图3),GPX对患者OS、DSS和DFS无影响;在LGG组,GPX1、GPX7和GPX8高表达患者的OS、DSS和PFS明显缩短(P均<0.001)(图4)。
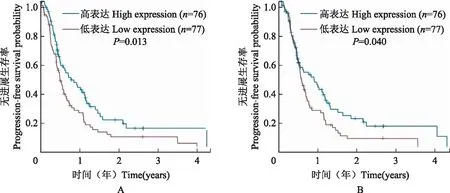
图3 GPX1(A)和GPX4(B)表达与GBM患者预后的关系
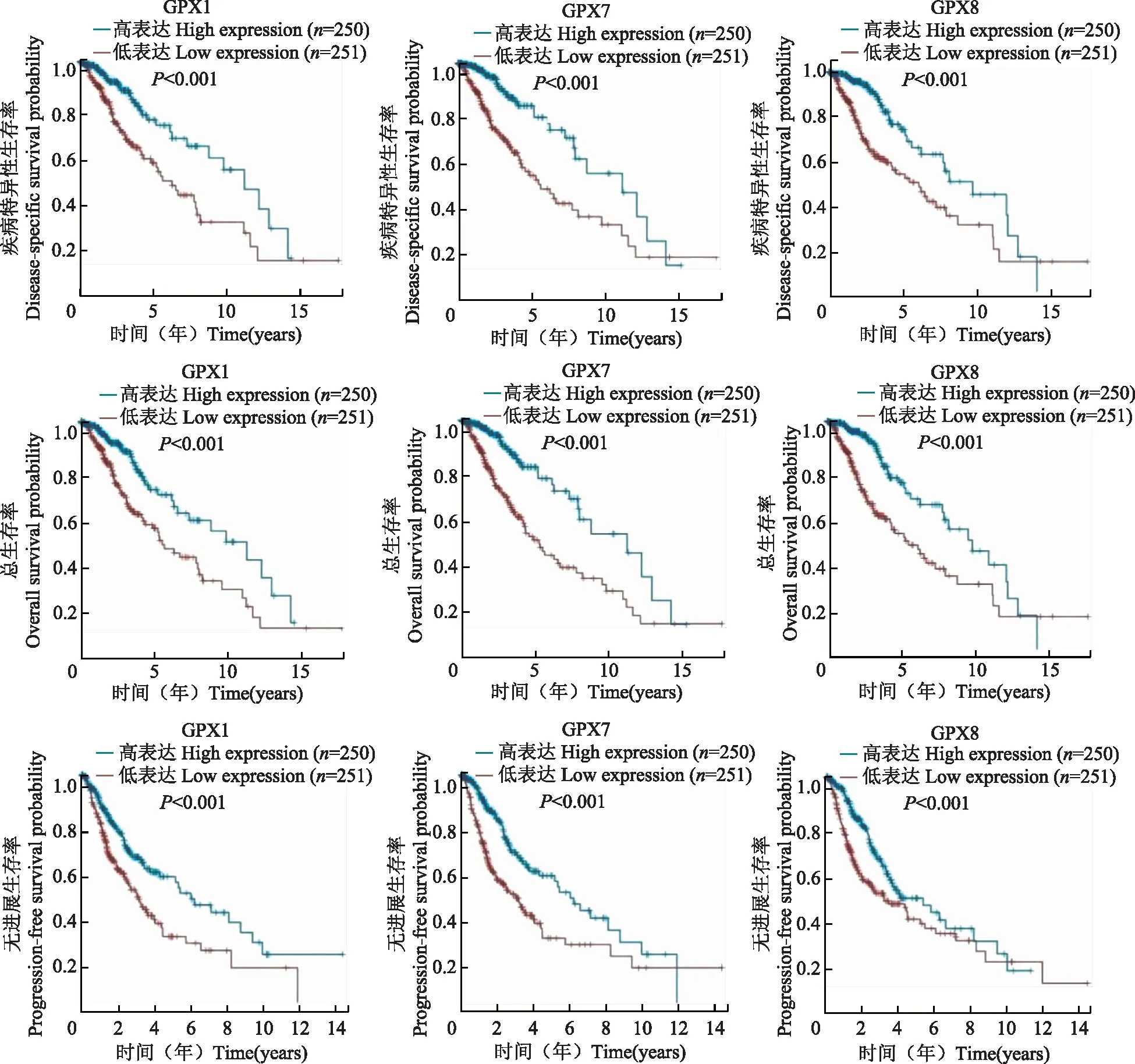
图4 GPX表达与LGG患者预后的关系
胶质瘤患者生存预后的影响因素单因素Cox风险回归显示,年龄是影响GBM患者生存的因素,GPX表达对GBM患者生存无影响(图5)。GPX7、GPX8、年龄和肿瘤分级是影响LGG患者生存的重要因素(图6A)。为避免这4个因素之间的交互作用,进一步进行多因素Cox风险回归分析,结果提示GPX7和年龄是LGG患者生存的独立影响因素(图6B)。使用Lasso回归将GPX1~GPX8纳入进行再次筛选,并使用交叉验证建立模型,进一步分析GPX对LGG患者OS的影响,结果显示风险评分=0.2996×GPX7+0.3898×GPX8,即GPX7和GPX8是影响LGG患者生存预后的关键基因(图7)。
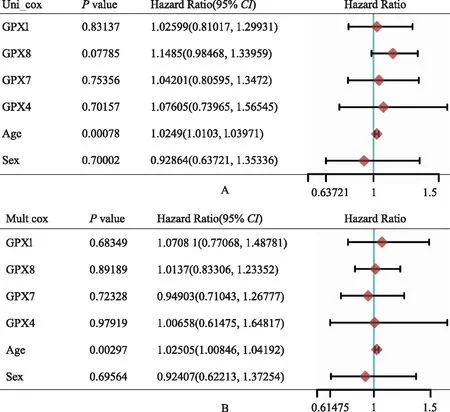
图5 单因素(A)和多因素(B)Cox回归分析GBM患者预后
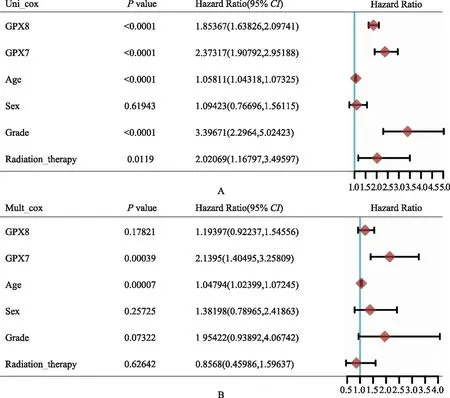
图6 单因素(A)和多因素(B)Cox回归分析LGG患者预后
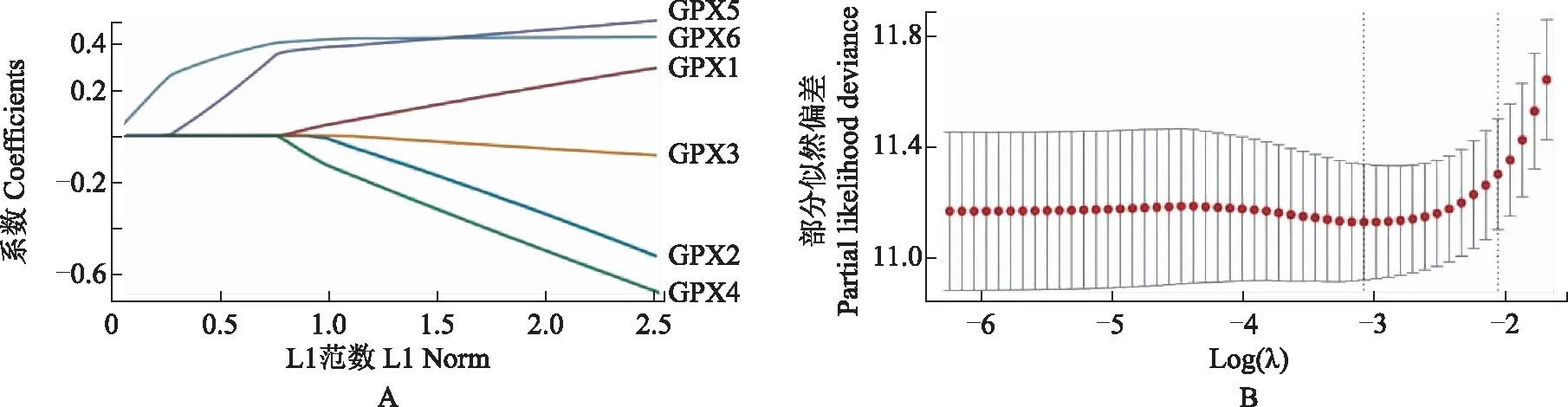
图7 LGG患者最小绝对收缩选择算子关键基因筛选(A)和交叉验证(B)
LGG患者生存预测模型建立基于多因素Cox回归结果构建LGG患者OS列线图,最终进入模型的危险因素为GPX7,一致性指数为0.843(95%CI=0.809~0.853),表明该模型具有较好的预测价值。为进一步验证预测效果,使用校正曲线对列线图进行验证,结果显示预测效果基本上未偏离真实标签结果,再次证明该模型具有可靠的预测性能(图8)。
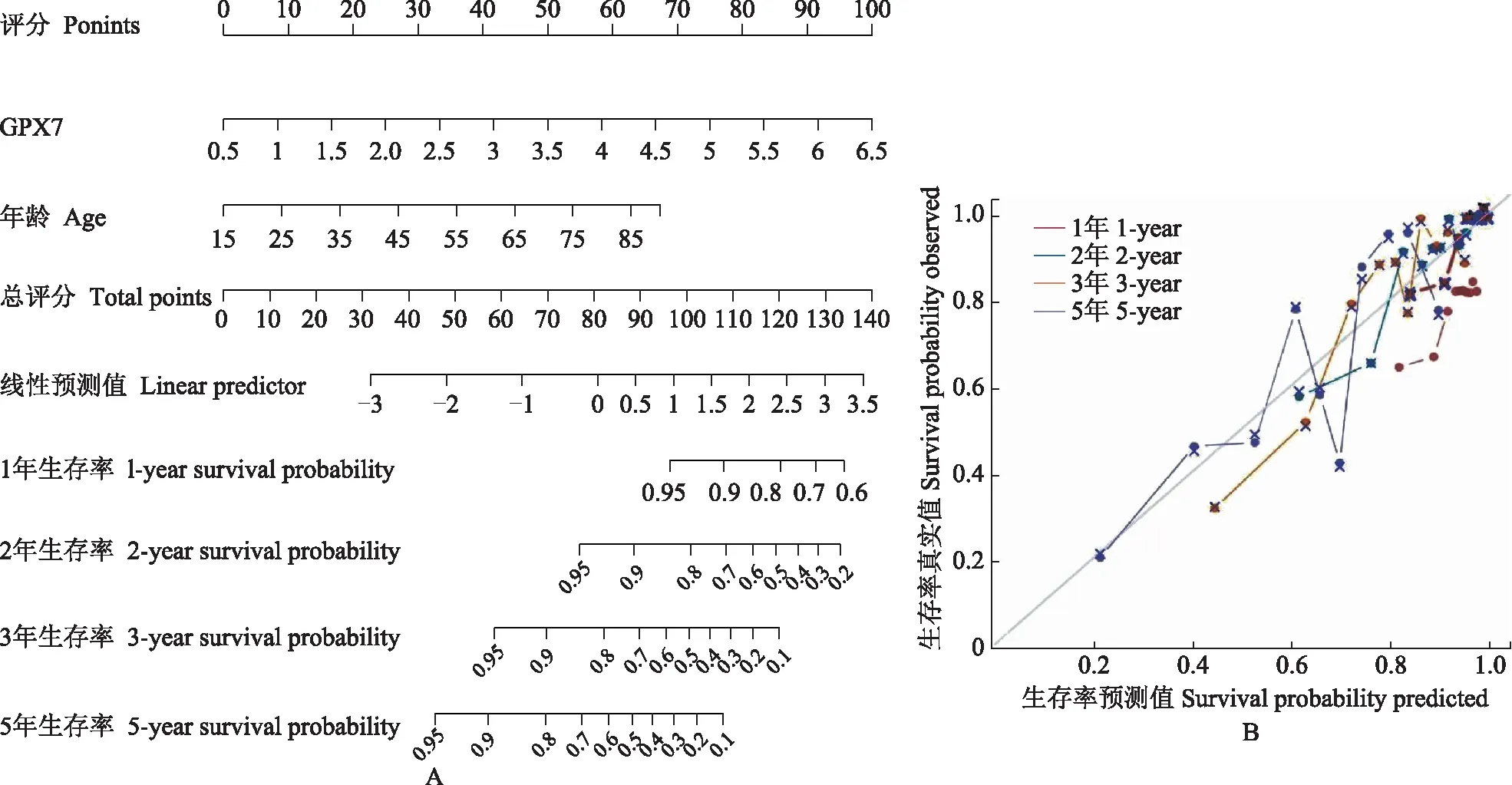
图8 LGG患者总生存率列线图(A)及校准曲线(B)
危险因素验证中国脑胶质瘤基因组图谱计划数据库的mRNA-seq_325数据集中包含具有GPX7有效数据的LGG患者90例,验证结果显示,与GPX7高表达组比较,低表达的LGG患者生存期限明显延长(P<0.001)(图9),与利用TCGA数据库获得的研究结果一致。

图9 GPX7表达与中国LGG患者预后的关系
讨 论
颅内肿瘤是危害人类生命和健康的重要肿瘤之一,2018年全世界颅内肿瘤新发病例接近30万例,在全部恶性肿瘤新发病例中约占1.6%,位居恶性肿瘤发病顺位的第17位[7]。其中胶质瘤是最常见的颅内肿瘤,其年发病率为5/10万~8/10万,5年病死率仅次于胰腺癌和肺癌[8]。临床医生通常根据年龄、病理分期、肿瘤类型等对患者的生存率进行预测。GPX是机体内广泛存在的一种重要的过氧化物分解酶,能够有效清除代谢中产生的过多的活性氧簇,减轻细胞氧化损伤,两者在维持机体内氧化-抗氧化平衡中发挥重要作用[2]。
研究显示GPX1的表达状态对GBM细胞的活力、迁移和侵袭能力有显著的调控作用[9]。GPX4参与肝癌[10]、前列腺癌[11]、乳腺癌[12]等肿瘤的发生,其低表达水平能够诱导肿瘤细胞发生铁死亡,提高肿瘤细胞对化疗药物的敏感性[13]。GPX7能够在内质网上介导蛋白质的折叠[14],其异常表达通过影响细胞氧化应激和基因甲基化水平参与肿瘤的发生和发展[15]。GPX的异常高表达能清除某些肿瘤药物诱导产生的活性氧簇而出现耐药[16],进而对肿瘤患者的预后造成影响。
本研究结合生存资料和临床资料,对663例胶质瘤患者进行了Kaplan-Meier生存分析,并利用生物信息学技术,分析其组织中GPX的表达情况,结果显示GPX1、GPX3、GPX4、GPX7、GPX8的表达在胶质瘤患者中明显升高,且GBM组的表达水平显著高于LGG组。进一步关于GPX表达水平与患者生存分析结果显示,GPX1和GPX4高表达的GBM患者PFS明显缩短,GPX1、GPX7和GPX8高表达的LGG患者OS、DSS和PFS明显缩短。
GPX4是一种单体蛋白,能够通过高效还原磷脂过氧化物和抑制花生四烯酸的活化发挥保护细胞免受氧化损伤的作用。研究显示NADH脱氢酶铁-硫蛋白8高表达会导致肺癌患者的OS明显缩短,而其表达水平与GPX4呈显著正相关[17]。此外,细胞中的不饱和脂肪酸在受到氧化损伤时会产生磷脂氢过氧化物,进而引发Fenton反应,最终导致铁死亡的发生[18]。近年来,诱导癌细胞铁死亡已经逐渐发展为一些肿瘤的治疗措施。抑制GPX4的表达也因此成为潜在的抗癌策略[19]。本研究显示GBM患者体内GPX4呈现明显的高表达,患者无进展生存期明显缩短,严重影响预后,推测这可能与高表达的GPX4干扰了肿瘤细胞的铁死亡及影响肿瘤代谢有关。
Cox和Lasso回归分析结果显示,GPX7、GPX8和年龄是LGG患者生存的独立影响因素,但仅年龄是GBM患者生存的影响因素,GPX表达对GBM患者生存无影响,这可能与数据库中GBM患者样本量较小有关,有待于进一步通过大样本研究确定。
GPX1是一种机体内广泛存在的过氧化物分解酶,其在肿瘤中的作用目前尚无定论。陈文彬和钟文洲[20]的研究结果提示,结直肠癌组织GPX1 mRNA的表达明显低于癌旁组织。邵帅等[21]的研究显示,在肺癌细胞模型BERP35T1细胞中,GPX1蛋白的过度表达可以通过缓解细胞DNA氧化损伤抑制癌细胞的恶性表型发挥肿瘤抑制作用。然而,在头颈部肿瘤中,GPX1的表达增加,增强了肿瘤的增殖和侵袭能力[22]。有研究显示GPX1的过表达与G蛋白α抑制活性肽2、蛋白酶体亚单位β10和Ras同源基因家族成员G表达呈显著正相关,反映了GPX1对肿瘤发生、炎症和血管生成的调控作用[23- 25]。研究显示GPX1的异常表达可能与肿瘤患者对抗肿瘤药物的耐药相关,在顺铂耐药的非小细胞肺癌细胞系中,GPX1的表达明显上调,而其表达下调又可以恢复癌细胞对顺铂的敏感性[26]。本研究显示GPX1是影响LGG患者预后的独立危险因素之一,推测这可能与高表达的GPX1导致的氧化应激和肿瘤耐药有一定关系。
GPX7是GPX家族中的非含硒成员,被称为非硒代半胱氨酸。目前关于GPX7在肿瘤发生发展中的作用说法不一。有研究显示GPX7敲除小鼠的淋巴瘤、肺腺癌、白血病等多种肿瘤的发生率明显增加[27],食管腺癌组织中GPX7表达水平显著低于正常食管组织[28]。但另有研究显示甲状腺癌组织中GPX7表达水平显著升高,且其表达水平与肿瘤最大径呈正相关[29- 30]。Guerriero等[31]研究显示,与肝硬化对照组相比,肝癌细胞中GPX7的表达明显升高,且在Ⅲ级肝癌细胞样本比Ⅰ级肝癌细胞中的表达更高。GPX7过表达与羟烷基辅酶A脱氢酶表达呈正相关,而羟烷基辅酶A脱氢酶高表达的急性髓系白血病和肾透明细胞癌混着预后较差[32- 33]。本研究显示TCGA数据库中胶质瘤患者的GPX7表达明显升高,这与中国脑胶质瘤基因组图谱计划数据库中的验证结果一致,表明GPX7高表达是影响不同种族和地区LGG患者预后的独立危险因素。笔者认为GPX7的表达可能对肿瘤的发展具有双重作用,需要更多的研究进一步发现其在肿瘤发生、发展和迁移过程中的作用及其机制。
有研究表明与正常组织相比,GPX8在胃癌组织中高表达,且其表达水平与胃癌分期相关,表达水平越高的患者预后越差,而抑制GPX8的表达可以提高胃癌患者的生存率[34- 35]。在非小细胞肺癌患者中,GPX8能够促进肿瘤细胞的增殖和侵袭能力,抑制肿瘤细胞的凋亡,其高表达与病理分化不良、临床分期较晚、远处转移等造成不良预后的危险因素密切相关[36]。本研究GPX8在患者中呈现明显的高表达水平,且其高表达显著影响LGG患者的预后,笔者推测GPX8可能通过多种途径影响肿瘤细胞的增殖和凋亡,进而严重影响患者预后。
综上,GPX7是影响LGG患者预后的危险因素,通过降低GPX7的表达水平可能对改善患者预后发挥促进作用。

