丛枝菌根真菌对栗钙土水稳性团聚体特征的影响
吴 娜,李 朕,王 娟,杨 艳
(山西大同大学 a 生命科学学院,b 应用生物技术研究所,c 石墨烯林业应用国家林业和草原局重点实验室, 山西 大同 037009)
山西大同盆地是我国著名的能源基地,地势较高、降水稀少和风力强,环境条件恶劣,加之不合理的垦殖和利用,导致该地区的生态环境十分脆弱[1]。大量实践证明,生态恢复的关键是生态系统功能的恢复和结构的重建,即恢复系统中非生物成分(土壤等)的功能,进而恢复微生物、植被和动物群落[2-3]。然而,大同盆地土壤(栗钙土)结构不良、植被覆盖率低,生态系统稳定性差,不利于植被的恢复。有效稳定大同盆地土壤结构,改善土壤营养条件,是大同盆地生态重建的第一步。
土壤团聚体是土壤成分在自然条件下形成的大小不一的多孔单元,具有维持水汽平衡、促进养分循环和抵御土壤侵蚀等多种生态功能[4-5]。良好的团聚体结构是优质土壤的基础,对非农业生态系统的恢复十分关键[6]。团聚体的形成及稳定机制受多种因素的影响,微生物既是土壤的重要组成部分,又是土壤团聚体形成过程中最活跃的生物因素[7]。丛枝菌根真菌(arbuscular mycorrhizal fungi,AMF)是一类重要的植物共生微生物,能与绝大多数的陆生植物根系形成共生结构,增强宿主植物对逆境的耐受能力[8-9]。此外,AMF也是土壤团聚体有机胶结的主要因子,对土壤团聚体的形成和稳定有重要作用,有“土壤结构工程师”之称[10]。AMF定殖后,一方面根外菌丝能起到类似根系的作用,将微型团聚体包裹缠绕形成大团聚体,稳定土壤结构[11];另一方面AMF的菌丝分泌物——球囊霉素(glomalin)是土壤有机质的重要来源,直接参与土壤团聚体的形成[12-13]。
目前,国内关于AMF对栗钙土土壤结构特征影响的报道很少。本研究采用盆栽试验分析了AMF对丝棉木(Euonymusmaackii)根际栗钙土水稳性团聚体稳定性的影响,并运用相关性分析研究不同因子间的相互关系,以期为退耕还林工程的有效实施提供理论依据。
1 材料与方法
1.1 试验材料
1.1.1 供试菌剂 供试AMF分别为摩西球囊霉(Funneliformismosseae,Fm)、幼套球囊霉(Claroideoglomusetunicatum,Ce)和根内球囊霉(Rhizophagusintraradices,Ri)[14]。AMF菌种由北京市农林科学院植物营养与资源研究所提供,经三叶草(Trifoliumrepens)扩繁,将含有孢子、菌丝片段以及定殖根段的根土混合物作为供试AMF菌剂。每10 g供试菌剂中含有约150个孢子。
1.1.2 供试植物 挑选饱满的丝棉木种子,用5 g/L KMnO4溶液浸泡20 min进行表面消毒,蒸馏水冲洗3次,再用无菌水浸泡24 h后,置于铺有纱布的托盘中,在25 ℃光照培养箱中催芽,每天光照12 h,换水1次。当种子胚根伸出约0.1 cm时,将种子播种在装有蛭石的育苗钵(47 cm×33 cm,66孔)中,每孔播种3 粒,将育苗钵置于25 ℃光照培养箱中继续培养,每天早上浇水(20 mL/孔),1个月后挑取长势一致的幼苗进行移栽。
1.1.3 供试基质 供试土壤为栗钙土,采自山西大同大学苗圃。土壤基本理化性质为有机碳18.21 g/kg,速效钾42.08 g/kg,速效氮23.17 mg/kg,速效磷10.33 mg/kg;pH(土壤(g)∶水(mL)为1∶5)7.9。用γ射线对风干土壤进行灭菌[15]。
1.2 试验方法
1.2.1 试验设计 采用单因素试验,共设置不接种AMF(CK)以及接种Fm、Ce和Ri等4个处理,每个处理重复30盆,共计120盆,完全随机区组排列。将供试基质装在长、宽、高分别为17.5,12.5,16 cm的塑料盆中(1.7 kg/盆),于基质表层下2 cm处接种20 g供试菌剂(菌剂量为11.76 g/kg),每盆移栽1棵丝棉木幼苗,置于25 ℃温室中进行培养,每天光照12 h,正常水分供应,常规育苗管理,每周浇1次Hoagland营养液(50 mL/盆),以确保营养元素供应。盆栽3个月后,每个处理随机选定6株植株,采集其根际土壤及植株样品。采集根际土壤时,需注意沿其自然结构小心掰成小土块,风干备用。采集植株样品时,将地上和地下部分分开。
1.2.2 丝棉木生物量的测定 将植株地上部分和地下部分样品于105 ℃杀青0.5 h,70 ℃烘干至质量恒定,称质量,即为生物量。
1.2.3 AMF定殖率和菌丝密度的测定 丝棉木根系中AMF定殖率采用放大交叉法[16]测定。土壤菌丝密度按照Abbott等[17]的方法测定。
1.2.4 根际土壤球囊霉素及有机质含量的测定 总球囊霉素(total glomalin,TG)和易提取球囊霉素(easily extractable glomalin,EEG)含量按照Wright等[18]的方法测定。称取过2 mm孔径筛的风干土样2份,每份1 g,分别加入pH 7.0、20 mmol/L和pH 8.0、50 mmol/L的柠檬酸钠溶液8 mL作为TG和EEG的浸提剂,充分混匀后于121 ℃分别高压灭菌30和60 min,灭菌后的混合溶液于5 000 r/min离心15 min,取上清液。在TG的提取过程中需重复以上操作至上清液无色,最终合并上清液用于测定。使用Bradford蛋白质分析试剂盒(Tiangen Biotech CO.,LTD,Beijing,China)测定上清液中的TG和EEG含量。土壤有机质含量采用重铬酸钾外加热法(K2Cr2O7-H2SO4法)[19]测定。
1.2.5 土壤水稳性团聚体含量及其特征参数的测定 不同粒径(>5,5~>2,2~>1,1~>0.5,0.5~>0.25,≤0.25 mm)土壤水稳性团聚体(water stable aggregates,WSA)含量按照Wu等[20]的方法测定。根据Wang等[21]的方法测定任一粒径团聚体的平均重量直径(xi)及其质量占土壤样品干质量的百分比(wi),计算平均重量直径(mean weight diameter,MWD)和几何平均直径(geometric mean diameter,GMD):
(1)
(2)
分形维数(D)按照以下公式进行计算[22]:
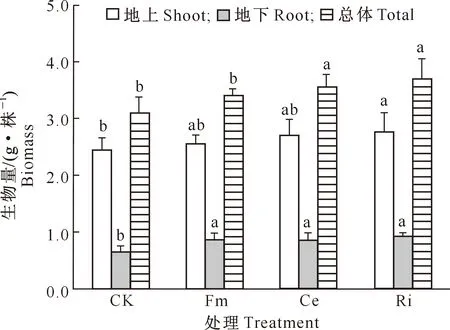
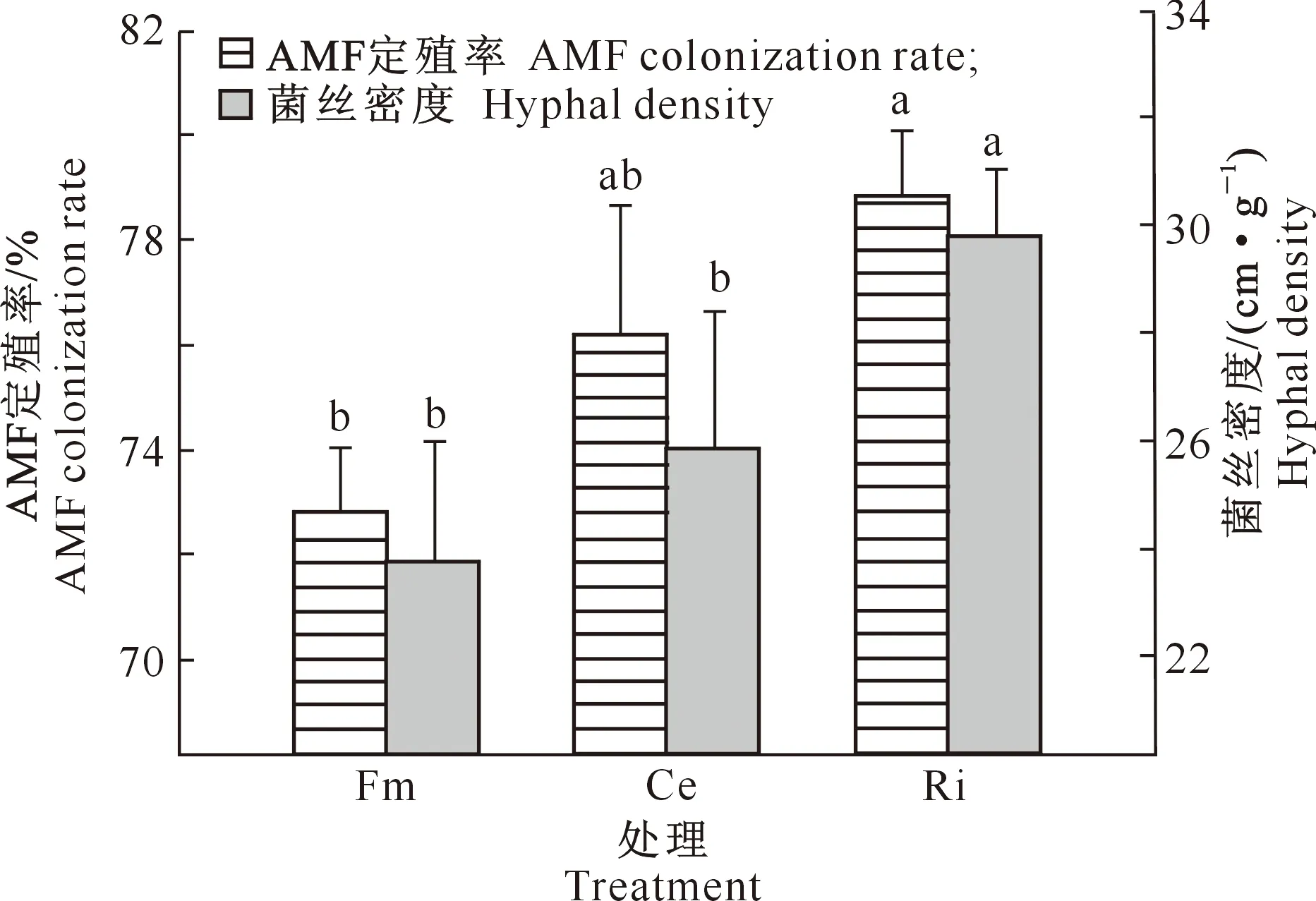
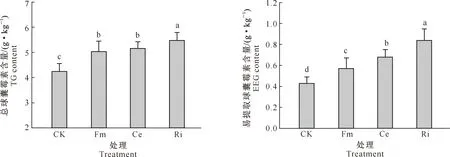
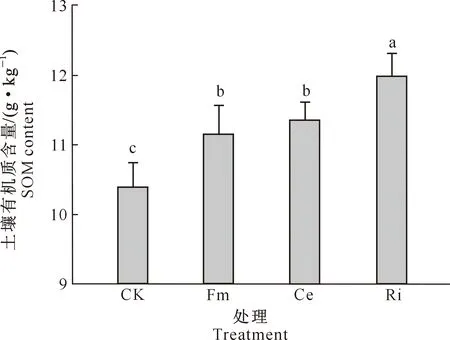
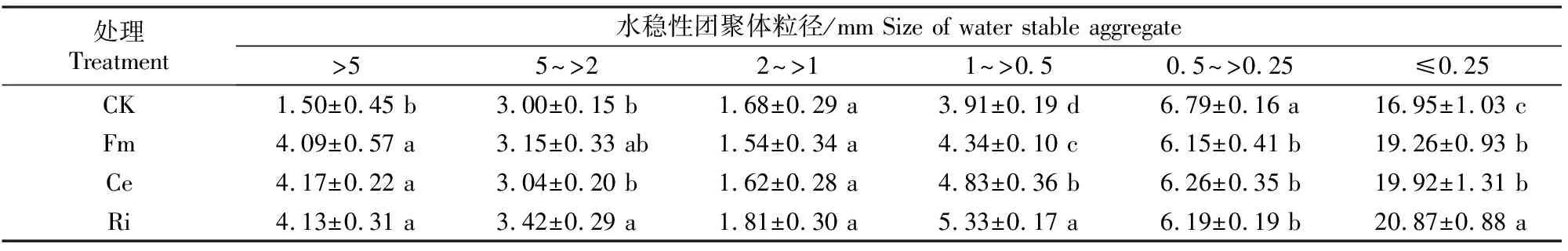
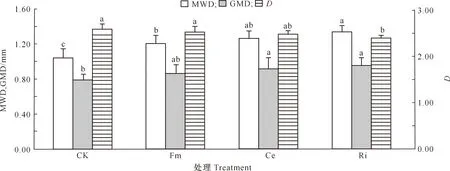
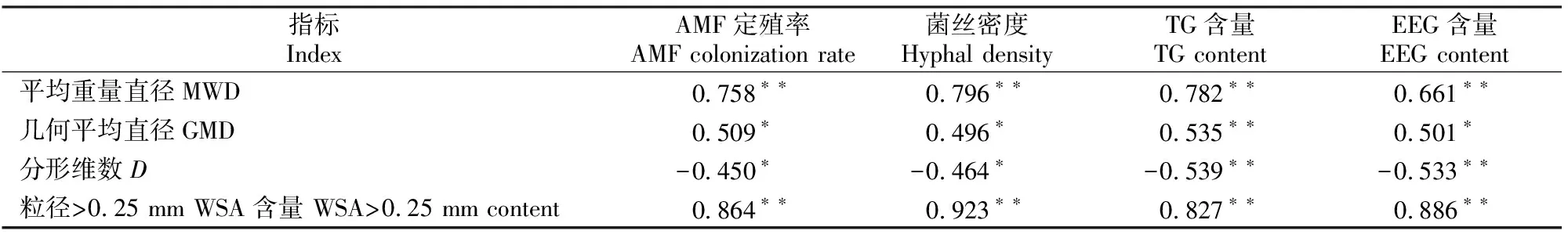
D=3-lg[W(δ (3) 式中:di为某级水稳性团聚体的平均直径,W(δ 1.2.6 数据处理 结果用“平均值±标准差”表示。数据经Excel(V2016)处理后,采用SPSS(V17.0)生物统计软件进行单因素方差(One-Way ANOVA)分析和Pearson相关性分析,使用Duncan’s法进行显著性检验。 如图1所示,与未接种AMF处理(CK)相比,Fm、Ce、Ri处理丝棉木地上部分的生物量分别增加了4.08%,8.63%和13.06%,其中Ri处理差异达显著水平;地下部分的生物量分别显著增加了32.81%,34.38%和43.75%,差异均达显著水平;总生物量分别增加了10.03%,14.89%和19.42%,其中Ce和Ri处理差异达显著水平。 同一指标不同处理相比,图柱上标不同小写字母表示差异显著(P≤0.05)。图2,5同Different lowercase letters indicate significant difference among treatments (P≤0.05). The same in Fig.2 and Fig.5.图1 不同AMF对丝棉木生物量的影响(n=6)Fig.1 Effect of AMF on biomass of E. maackii(n=6) 图2显示,在整个生长季中,Fm、Ce和Ri处理丝棉木根系中的AMF定殖率分别为72.79%,76.15%和78.80%,根际土壤菌丝密度分别为23.78,25.91和29.77 cm/g,Ri处理显著高于Fm处理。可见,AMF和丝棉木能够形成良好的互惠共生关系,丝棉木接种AMF后,土壤中弥漫着大量的根外菌丝。 如图3所示,与CK相比,Fm、Ce和Ri处理的TG含量分别显著增加了19.53%,18.59%和24.90%,EEG含量分别显著增加了31.92%,57.31%和94.62%,其中Ri处理的增加效应最为明显。结果表明,接种AMF可大幅增加丝棉木根际土壤中的EEG和TG含量,其中EEG含量增幅更大。 与CK相比,Fm、Ce和Ri处理的丝棉木根际土壤中有机质含量均显著提高,其中Ri处理有机质含量提高幅度最大,为12.88 %(图4)。 图2 丝棉木根系中AMF的定殖率和根际土壤中的菌丝密度(n=6)Fig.2 AMF colonization rate in roots and soil hyphal density in rhizosphere of E. maackii (n=6) 图柱上标不同小写字母表示不同处理间差异显著(P≤0.05)。图4同 Different lowercase letters indicate significant difference (P≤0.05) among treatments. The same in Fig.4 图4 不同AMF对丝棉木根际土壤中有机质含量的影响(n=6)Fig.4 Effect of AMF inoculation on soil organic matter content in rhizosphere soil (n=6) 人们通常将水稳性团聚体分为粒径>0.25 mm的大团聚体和粒径≤0.25 mm的微团聚体,大团聚体的含量与土壤肥力状况呈正相关效应[15,23-24]。由表1可知,与CK相比,Ri处理显著增加了粒径>5,5~>2,1~>0.5和≤0.25 mm的WSA含量,显著降低了粒径为0.5~>0.25 mm的WSA含量;Ce和Fm处理显著增加了粒径>5 mm,1~>0.5 mm和≤0.25 mm的WSA含量,显著降低了粒径为0.5~>0.25 mm的WSA含量。此外,Ri、Ce和Fm处理均增加了粒径>0.25 mm的WSA含量,增幅分别为13.63%,17.52%和23.13%。由此可见,3种AMF均有利于水稳性团聚体的形成,且3种AMF的效应由大到小表现为Ri>Ce>Fm。 表1 AMF对丝棉木根际土壤不同粒径水稳性团聚体(WSA)含量的影响(n=6) MWD和GMD是反映土壤团聚体大小分布及其稳定性的常用指标。MWD是不同粒级团聚体的综合指标,其值越大,说明大粒级团聚体含量越高,团聚体的水稳性越好。GMD可以描述不同粒径团聚体的分布情况,其值越大,说明大粒级团聚体分布越多,孔隙度越好[15]。如图5所示,与CK相比,接种3个AMF处理均显著增加了丝棉木根际土壤的MWD,接种Ri和Ce均显著增加了土壤团聚体的GMD。3种处理中,Ri处理对团聚体MWD和GMD的增加效果最为显著,与CK相比增幅分别为30.17%和21.47%,说明Ri处理的团聚体水稳性最优。 分形维数D可以反映土壤结构和稳定性状况,D越小土壤的结构与稳定性越好。由图5可知,与CK相比,Ri处理土壤的D显著降低了6.92%。由此可见,Ri能显著增加丝棉木根际栗钙土的稳定性,提高其抗侵蚀能力。以上结果表明,不同AMF处理对丝棉木根际栗钙土团粒结构的改善作用存在菌种差异,水稳性团聚体的MWD和GMD均表现为Ri>Ce>Fm。 图5 不同AMF对土壤水稳性团聚体平均重量直径(MWD)、几何平均直径(GMD)和分形维数(D)的影响(n=6)Fig.5 Effect of AMF inoculation on MWD,GMD and D of water stable aggregates(n=6) 如表2所示,AMF定殖率、菌丝密度、TG含量、EEG含量均与MWD、GMD和粒径>0.25 mm土壤WSA含量均呈显著或极显著正相关关系,与D均呈显著或极显著负相关关系。结果表明,AMF能够通过增加根外菌丝和分泌球囊霉素的方式增加土壤MWD、GMD和粒径>0.25 mm土壤WSA含量,降低D,改善土壤水稳性团聚体的稳定性。 表2 AMF定殖状况、球囊霉素含量与水稳性团聚体特征的相关性分析Table 2 Correlation analysis between AMF status,glomalin content and water stable aggregates characteristics AMF能够改善宿主植物的水分状况,促进其对营养元素的吸收,从而促进植物生长和生物量积累,并提高多种耐性[25-27]。本研究中,供试的3种AMF均能够与丝棉木建立良好的共生关系,显著提高丝棉木的生物量。 AMF在与宿主植物根系形成共生体系后,能够在根际土壤中形成庞大的菌丝网络,其菌丝体和分泌的球囊霉素是土壤碳库的重要来源,直接参与土壤团聚体的形成[28-30]。本研究结果显示,与CK相比,接种AMF处理植物的根际土壤有机质、TG和EEG含量显著增加。有研究表明,AMF与宿主植物之间存在一定的偏好性,从而显著影响植物群落内的竞争关系,导致植物群落组成改变,间接对土壤环境产生影响[3,27]。在本研究中,相较于其他2种供试AMF,Ri处理土壤有机质含量增加最多,这与其根系定殖率、根际土壤中菌丝密度、TG和EEG含量较高的结果一致。 AMF是土壤团聚体主要的有机胶结因子,在土壤团聚体形成和稳定中作用巨大[31]。AMF与植物根系的共生体系建立后,在根际土壤中形成了大量的根外菌丝,起到类似根系的作用,将土壤原生颗粒、有机物和微型团聚体包裹和缠绕,进而形成大团聚体,消除微团聚体形成的空间限制[6]。同时,AMF根外菌丝分泌大量球囊霉素,直接或间接影响土壤团聚体状况[3]。球囊霉素粘结土壤颗粒的能力较强,能将微团聚体结合形成大团聚体,改变粒径> 0.25 mm的水稳性团聚体的分布模式,是水稳性团聚体形成过程中重要的胶结剂,促进土壤水稳态结构的形成[32]。而根外菌丝和球囊霉素对土壤团聚体形成的作用受到宿主植物种类、AMF种类和培养基质等因素的影响[33]。Zhang等[23]研究表明,接种根内球囊霉和地表球囊霉(G.versiforme)可显著提高刺槐(Robiniapseudoacacia)根际土壤水稳性团聚体的MWD和GMD。本研究结果显示,与CK相比,接种AMF处理的丝棉木根际土壤MWD和GMD均显著增高,土壤D显著降低,大粒级团聚体和水稳性团聚体数量显著增加,土壤结构和稳定性得到改善。这与接种AMF处理对根际土壤菌丝密度及TG、EEG含量的影响结果一致,说明AMF可通过根外菌丝和分泌球囊霉素的方式直接或间接改善土壤团聚体结构[12,23,34]。 相关性分析结果表明,在丝棉木根际土壤水稳性团聚体形成过程中,AMF根外菌丝和球囊霉素起到了关键性的作用。本研究中,丝棉木根系AMF定殖率、根际土壤菌丝密度、TG含量、EEG含量与土壤MWD、GMD、粒径>0.25 mm土壤WSA含量均呈显著或极显著正相关,与D均呈显著或极显著负相关,说明AMF能够通过增加根外菌丝和分泌球囊霉素的方式改善土壤水稳性团聚体的稳定性[12]。此外,本研究还发现,3种AMF接种处理的植物根际土壤有机质含量、TG含量、EEG含量、MWD、GMD、粒径>0.25 mm WSA含量之间存在差异,与AMF定殖率、根际土壤菌丝密度间的差异基本一致,说明土壤状况的差异是由于菌种类别的不同造成的,而这种差异可能与菌种与宿主植物间的偏好性有关[3,27]。 本研究中,不同AMF处理对丝棉木根际栗钙土团粒结构的改善作用存在菌种差异,水稳性团聚体的MWD和GMD均表现为Ri>Ce>Fm,说明接种Ri更能提高丝棉木幼苗根际栗钙土水稳性团聚体的稳定性,使土壤微环境朝着适合植物生长的方向变化。因此,在利用菌根技术修复生态系统时,需要针对不同植株、不同土壤类型以及不同微生态环境筛选合适的菌种,以获得最佳的修复效果。2 结果与分析
2.1 AMF对丝棉木生物量的影响
2.2 丝棉木根系中AMF的定殖率和根际土壤中的菌丝密度
2.3 AMF对土壤球囊霉素及有机质含量的影响
2.4 AMF对栗钙土水稳性团聚体特征的影响
2.5 AMF定殖状况、球囊霉素含量与水稳性团聚体特征的相关性分析
3 讨 论

