光催化-生物膜耦合体系的构建及其处理ECF漂白废水的研究
梁吟娜 熊建华,,* 王双飞 杨崎峰
(1.广西大学资源环境与材料学院,广西南宁,530004;2.广西清洁制浆造纸与污染控制重点实验室,广西南宁,530004;3.广西博世科环保科技股份有限公司,广西南宁,530007)
二氧化氯漂白技术于1946年开始在制浆造纸工业化生产中应用,且大部分为含氯漂白技术。虽然该技术有使纸浆白度更高的优点,但会导致产生低浓度的漂白浆料和大量含高浓度Cl-的废水,该废水不仅具有腐蚀性,会损伤制浆造纸设备,而且含有大量难降解氯代有机污染物[1-2]。为解决含氯漂白技术存在的问题,研究人员随后提出无元素氯漂白(ECF)技术并得到了广泛应用[3-4]。虽然ECF漂白方法能减少75%~85%的氯代难降解有机污染物的生成,但不能完全阻止该类物质和其他有毒、难降解有机物的生成和积累[5]。因此,对制浆造纸ECF漂白废水的排放治理仍十分必要。
光催化氧化生物降解直接耦合(ICPB)技术是一种新兴的处理难降解有机污染物的方法,2008年由美国工程院Marsolek教授课题组首次提出[6]。该方法是在直接耦合技术中,将光催化剂负载于多孔载体的外表面,而生物膜则分布于载体内表面的孔隙中。起初载体外表面被生物膜全包覆,在紫外光/可见光的照射及微生物的新陈代谢过程中,外表面微生物脱落,将载体外部催化剂暴露出来发生光催化反应,分解废水中的难降解有机物,而载体内部的生物膜进一步降解污染物,从而达到净化废水的目的。从首次构建至今,ICPB所研究的目标污染物包含氯苯酚、苯酚、染料、硝基苯、抗生素等[7-11];充分表明了该技术在治理有毒、难降解有机污染物、生物抑制性污染物方面的优势。
ICPB体系的生物膜主要来源于活性污泥,而活性污泥中的菌属种类多样,菌属间的相互竞争作用会影响优势菌属的生长,从而降低生物膜对有机物的降解效果。为分析解决这一问题,本研究将对ECF漂白废水具有降解优势的白腐菌属加入ICPB体系中,以单独活性污泥和单独白腐菌构建的ICPB体系为对照,对比分析白腐菌强化的ICPB体系在驯化过程中的理化特性和降解ECF漂白废水过程中的效率,为优化ICPB技术提供一种新思路,并为ECF漂白废水达标排放及重复利用提供技术支撑和理论依据。
1 实验
1.1 实验材料
取广西来宾某制浆造纸厂漂白车间排放的ECF漂白废水为实验对象,呈淡棕黄色,化学需氧量(CODCr)为1000 mg/L,生化需氧量(BOD5)为372 mg/L,可吸附有机卤化物(AOX)为43 mg/L,pH值为6.95。蔗渣纤维素由广西贵港市贵糖有限公司提供;纳米TiO2由柳州若思纳米材料科技有限公司提供;氯化锌(ZnCl2)、无水硫酸钠、七水合硫酸镁(MgSO4·7H2O)、三水合乙酸钠(NaAc·3H2O)和二水合磷酸二氢钠(NaH2PO4·2H2O)购自广东省化学试剂工程技术研究开发中心;聚乙烯醇和无水氯化钙(CaCl2)购自成都市科龙化工试剂厂;戊二醛、三水合磷酸氢二钾(K2HPO4·3H2O)购自天津市大茂化学试剂厂;以上药品均为分析纯。
1.2 蔗渣纤维素/TiO2复合载体的制备
由于蔗渣纤维素具有亲水亲生物性、可生物降解性、孔隙率高、比表面积大等优点[12],因此本研究以蔗渣纤维素为基本骨架,以纳米TiO2为光催化剂,构建蔗渣纤维素/TiO2复合载体,其具体制备过程本课题组已有详细研究[13],基本制备工艺流程如图1所示。
1.3 菌种和营养液
本研究所用菌种为白腐菌(Phanerochaetechrysosporium),购自广东省微生物菌种保藏中心,菌种于4℃下冷藏保存。
土豆营养液:20%土豆浸出液、0.15%(质量分数,下同)MgSO4·7H2O、0.3%KH2PO4、2%葡萄糖和2%琼脂,自来水加至1000 mL,用于白腐菌的培养与保存。
液体营养液:10%土豆浸出液、0.3%KH2PO4、0.15%MgSO4·7H2O、1%葡 萄 糖、0.01%CaCl2、0.02%酒石酸铵,加自来水至1000 mL,用于构建单独白腐菌ICPB体系。
活性污泥营养液:按照微生物生长繁殖所需的C∶N∶P=100∶5∶1的比例及利用CaCl2、MgSO4·7H2O等无机盐制备营养液。其中,C源为NaAc·3H2O,N源为NH4Cl,P源为K2HPO4·3H2O和NaH2PO4·2H2O。
1.4 实验方法
1.4.1 不同ICPB体系的驯化
驯化开始,将300 mL活化后的污泥混合液投入1000 mL的量筒中,随后将经活性污泥营养液稀释的ECF漂白废水补充至1000 mL,记为活性污泥(n)组;将300 mL活化后的污泥混合液及20 mL白腐菌丝液投入1000 mL的量筒中,随后将经活性污泥营养液稀释的ECF漂白废水补充至1000 mL,记为活性污泥混合白腐菌(n+b)组。两组污泥浓度均为8 g/L,并分别加入0.6 g/L蔗渣纤维素/TiO2复合载体。两个量筒中溶解氧浓度(DO)均控制在约0.6 mg/L,测定时间为12 h,每24 h更换一次经营养液稀释的ECF漂白废水。
驯化过程中逐渐增加ECF漂白废水的比例,驯化经历4个阶段,即活性污泥营养液与ECF漂白废水的体积比分别为6∶4、4∶6、2∶8、0∶10,活性污泥营养液具体配比见1.3小节。驯化过程中每天定期测定体系的DO和pH值,并使其分别维持在0.6 mg/L和7.0。同时,每天测定进出水CODCr浓度,当出水CODCr去除率稳定在较高水平时即可进入下一驯化阶段。每个驯化阶段结束后,测定污泥各项理化指标(混合液悬浮固体(MLSS)、污泥体积指数(SVI)及污泥絮凝性能)。驯化完成后,将载体在特定温度下干燥后保存待用,使用前在水中曝气活化一定时间[14]。
将250 mL经灭菌后的驯化营养液(分别含体积分数为25%、50%、75%、100%ECF漂白废水的液体营养液)加入500 mL锥形瓶中,同时加入白腐菌孢子悬浮液和灭菌后的复合载体,记为白腐菌(b)组,在摇床转速为140 r/min、温度为27℃的条件下培养驯化,每隔12 h测定溶液的CODCr,CODCr去除率稳定在较高水平时即为驯化的终点;达到每个驯化阶段的终点时测定白腐菌生物量。驯化完成后,将载体在特定温度下干燥后保存待用,使用前在水中曝气活化一定时间。
1.4.2 不同ICPB体系处理ECF漂白废水
将单独活性污泥、单独白腐菌和活性污泥混合白腐菌生物膜构建的ICPB体系置于反应器中,对ECF漂白废水进行降解,具体实验条件如表1所示。

表1 不同ICPB体系处理ECF漂白废水的实验条件Table 1 Experimental conditions for ECF bleaching wastewater degradation by different ICPB systems
1.5 微生物理化特性分析
1.5.1 MLSS测定
将定量滤纸在103℃~105℃的烘箱中烘干至恒定质量,称量质量计为W1(g);在n组及n+b组每阶段驯化完成时,分别取驯化混合液100 mL,记为V,利用上述滤纸进行过滤,将过滤后的滤纸置于103℃~105℃的烘箱中烘干至恒定质量,称量质量计为W2(g)。MLSS(g/L)计算公式如式(1)所示。

1.5.2 SVI测定
SVI(mL/g)是衡量活性污泥沉降性能的指标[15],计算公式如式(2)所示。

式中,SV30为驯化混合液静沉30 min后的污泥容积,mL/L。
1.5.3 白腐菌生物量测定
每阶段驯化完成时,取10 mL驯化营养液于比色管中定容至25 mL,在330 nm下测定其浊度,记录实验数据,从标准曲线查出对应的吸光度值即可换算出驯化营养液中菌体的浓度,其中标准曲线的制作方法见王敏等[16]的研究。本研究标准曲线的回归方程为:y=0.75566x+1.2187,R2=0.9973,说明线性关系良好。
1.5.4 胞外多聚物(ECP)中蛋白质(PN)、多糖(PS)的测定
ECP的提取:采用稀硫酸法提取胞外多聚物,具体方法见闫海波[17]的研究。
PN的测定:采用考马斯亮蓝法[18]进行测定。标准曲线方程为:y=2.4112x+0.0082,R2=0.9977;其中,x为蛋白质浓度,mg/mL;y为吸光度,A。将驯化过程中提取的胞外多聚物(1 mL)置于50 mL的比色管中,随后加入5 mL考马斯亮蓝g-250试剂,然后立即在旋涡混合器中混合2~5 min,在595 nm处测定混合后样品的吸光度,根据所测得的吸光度值,利用标准曲线计算PN含量。
PS的测定:采用苯酚-硫酸[19]法对驯化过程中各组多糖含量进行测定。标准曲线方程为:y=3.7222x+0.0009,R2=0.9978;x为多糖浓度,mg/mL;y为吸光度,A。取1 mL胞外多聚物于50 mL比色管中,然后加入1 mL 5%苯酚及5 mL浓硫酸,摇匀冷却,室温放置20 min后于490 nm处测定吸光度。根据吸光度,通过标准曲线计算PS含量。
1.6 降解效果分析
1.6.1 溶解有机碳(DOC)
取4 mL过滤后的ECF漂白废水样并加入16 mL超纯水,混合均匀后得到稀释5倍后的样品,利用TOC测定仪(TOC-L CPH;日本岛津公司)进行测定,其测定值即为DOC。
1.6.2 CODCr
CODCr采用微波消解法测定。
1.6.3 AOX的测试方法
使用AOX总有机卤素测定仪(multiX2500,德国耶拿公司)对ECF漂白废水中AOX进行测定。
2 结果与讨论
2.1 驯化阶段CODCr去除率
图2为不同ICPB体系驯化过程中CODCr去除率的变化。由图2可知,在驯化过程中,CODCr去除率由高到低分别为活性污泥混合白腐菌(n+b)组、单独活性污泥(n)组及单独白腐菌(b)组。每当驯化进入下一个阶段的前期时,3组CODCr去除率首先会大幅下降,然后再缓慢提高,这是因为每进入下一阶段驯化时,ECF漂白废水的浓度会增加,增加了有机物对微生物的毒害性,因此CODCr去除率下降。经过一段时间驯化后,微生物对环境具有了一定的适应能力,CODCr的去除率又有所提高[20-21]。
驯化第一阶段,即活性污泥营养液与ECF漂白废水的体积比为6∶4时,结合图2(a)可知,n组CODCr去除率在第72 h达到较高的稳定水平,为96%,表明此时ECF漂白废水的浓度较低,活性污泥能较快适应及对CODCr的去除率较高。图2(b)显示b组在96 h时,CODCr去除率趋于稳定,为87%;图2(c)显示在第一阶段的驯化中,n+b组在第48 h时,CODCr去除率达到稳定状态,为98%。对比3组CODCr去除率发现,n组和n+b组的CODCr去除率均高于b组,达到稳定所需时间均比b组所需时间短,说明单独的白腐菌对ECF漂白废水的CODCr降解有一定的局限性。同时,n+b组对CODCr的去除率高于n组,表明在活性污泥中投加白腐菌对废水CODCr降解具有协同增强作用[14,22]。驯化的第二~第四阶段,即活性污泥营养液与ECF漂白废水的体积比依次为4∶6、2∶8、0∶10时,3组CODCr去除率的变化规律与第一阶段相似,最终n组在第288 h、b组在第336 h、n+b组在第252 h时达到驯化终点。
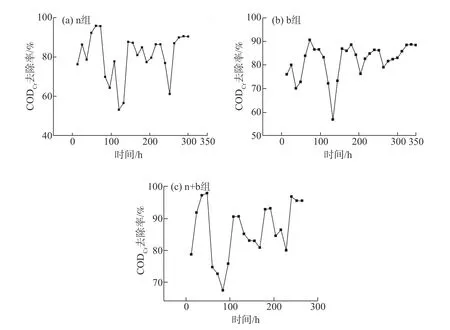
图2 不同ICPB体系驯化过程中CODCr去除率变化情况Fig.2 Removal rate of CODCr during domestication in different ICPBsystems
2.2 驯化过程污泥及白腐菌理化特性表征
2.2.1 驯化过程MLSS的变化
驯化过程中n组及n+b组MLSS的变化如图3所示。由图3可知,驯化过程中,n组和n+b组的MLSS值分别在5~7和6~8 g/L之间。各驯化阶段(除2∶8外),n+b组的MLSS值均高于n组,这主要是因为白腐菌投加至活性污泥中,增加了活性污泥负载于复合载体的能力,从而使大量微生物在复合载体表面和内部富集,不仅能在一定程度上减少活性污泥絮体,降低活性污泥膨胀率,还有助于微生物的生长并改善其群落结构。MLSS值较高,表明体系的微生物浓度高,从而对废水中污染物的降解效果更好[23],这与CODCr去除率分析结果一致。
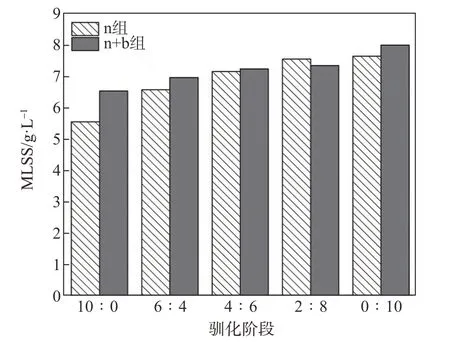
图3 驯化过程中MLSS的变化Fig.3 Variation in MLSSduringdomestication
2.2.2 驯化过程SVI的变化
运用驯化过程中SVI的变化分析了n组及n+b组体系的松散性及沉降性能,结果如图4所示。从图4可以看出,在不同的驯化阶段中,两组SVI值均保持在60~85 mL/g之间,即保持在正常的SVI值(50~120 mL/g)之内[24];表明在驯化过程中,两组体系均没有出现污泥膨胀现象。
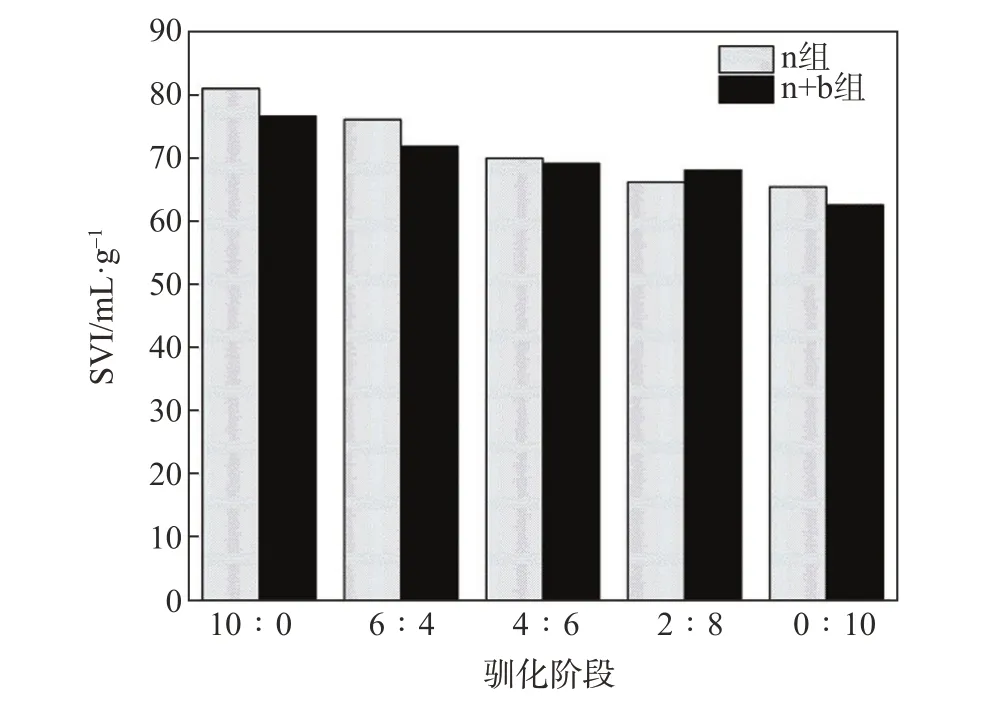
图4 驯化过程中SVI的变化Fig.4 Variation of SVIduringdomestication
通过分析可知,随着驯化阶段的改变,两组体系的SVI值不断下降,n组从初始80.9 mL/g降至65.4 mL/g,n+b组从76.5 mL/g降至62.5 mL/g。在4个驯化阶段中,n+b组与n组的SVI值均在6∶4阶段取得最大值,分别为71.8和76.0 mL/g;这是因为首次向两组体系中投加ECF漂白废水对两组体系具有冲击性,体系结构在一定程度上遭到了破坏,致使体系内絮体松散,SVI值较高[25]。经过比较可以发现,n+b组的SVI值普遍低于n组,表明在驯化过程中,n+b组产生的无机物含量高于n组,间接反映了其将有机物转化为无机物的能力优于n组。同时也表明,n+b组中白腐菌的存在增强了体系的耐受力。
2.2.3 驯化过程ECP的变化
ECP是位于微生物细胞壁外围的膜状天然有机物,其具有黏附性和保护微生物的特性,影响着絮体之间的聚集,其间接反映了污泥的絮凝性能[26]。ECP含量通常由PN和PS之和表示,ECP含量越高,表示泥水分离能力越强,废水处理效果越好。ECP含量在合适范围内时,一般以PN/PS作为衡量污泥内聚力的指标。驯化过程中,n组及n+b组ECP含量的变化如表2所示。
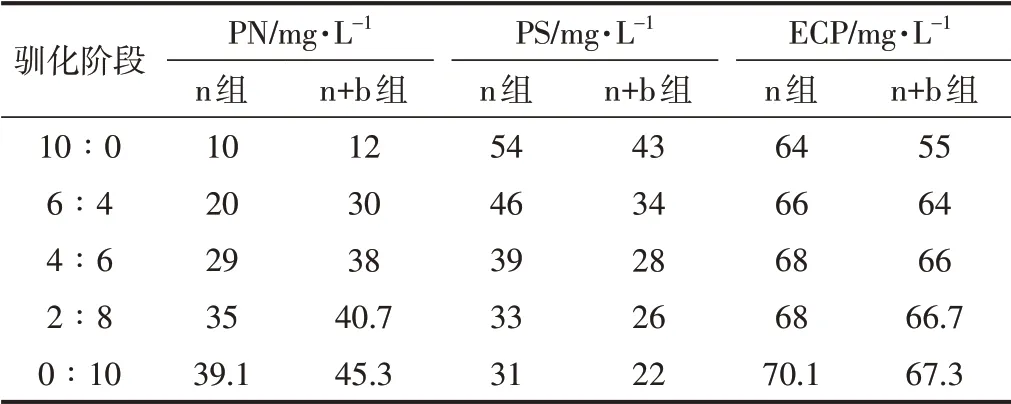
表2 ECP含量变化Table 2 Changes of ECP content
图5显示了驯化过程中PN/PS的变化情况。由图5可知,随着驯化阶段的进行,两组PN/PS值均呈递增的趋势。在0∶10阶段中,两组PN/PS值的增长率低于前3个驯化阶段,此时,n组和n+b组的PN/PS值增长率分别为18.8%和2.6%。表明在经过2∶8阶段的驯化后,两组体系中均已形成较为稳定的优势菌群,因此在体系全部为ECF漂白废水的最后一个驯化阶段,菌群受ECF漂白废水毒性的影响较小,因此分泌的PN量和PS量较稳定,活性污泥的絮凝性能较好。由图5还可知,在4个驯化阶段中,n+b组的PN/PS值均高于n组,表明在活性污泥中添加白腐菌增加了体系的耐受能力,有助于污泥ECP中PN的增加,降低活性污泥表面的负电,提高污泥的凝聚性,使得泥水易于分离[27]。
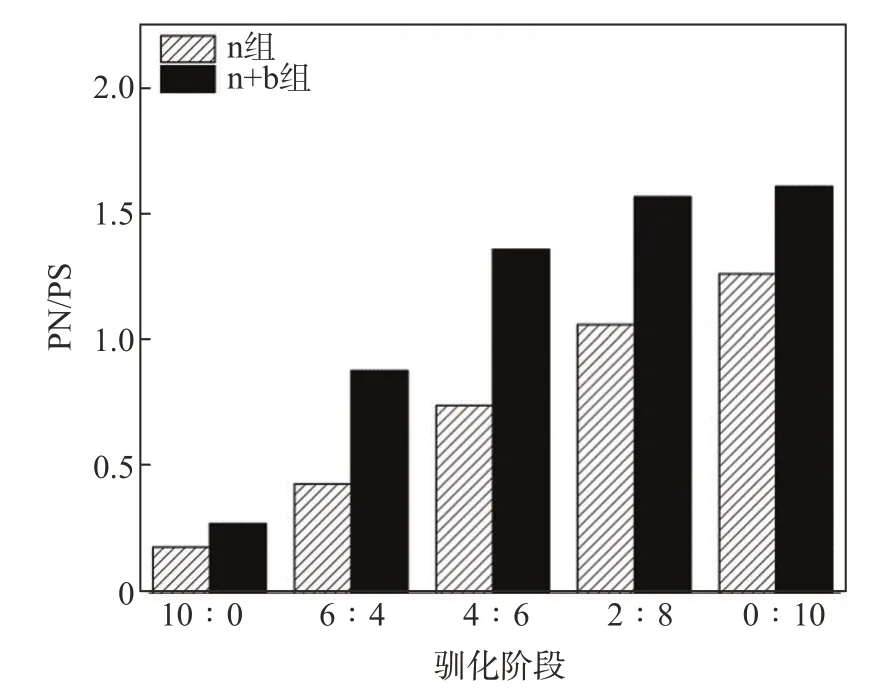
图5 驯化过程中PN/PS的变化Fig.5 Variation of PN/PSduring domestication
2.2.4 驯化过程白腐菌生物量变化
图6显示了不同驯化阶段白腐菌的菌液质量浓度。从图6可以看出,白腐菌经驯化营养液培养后,菌液质量浓度为15 g/L,将其进行第一阶段驯化后,菌液质量浓度降至10 g/L,这是因为在第一阶段中首次将ECF漂白废水加入驯化营养液中,白腐菌受到了外来有机物的影响,处于适应阶段,因此菌液质量浓度有所降低。在之后的3个驯化阶段中,菌液质量浓度均呈上升趋势,菌液质量浓度增长率均为约7%,表明白腐菌已经缓慢适应ECF漂白废水的加入,且开始利用ECF漂白废水中的物质以进行自身的新陈代谢,处于菌种生长繁殖较为旺盛的对数增长期[28]。
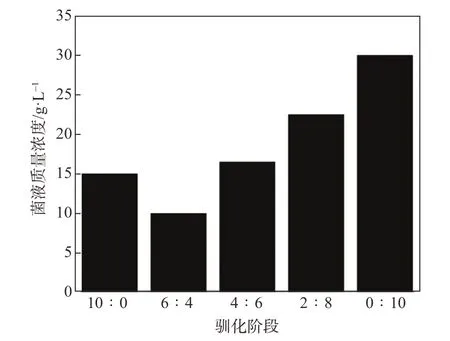
图6 驯化过程中白腐菌的菌液质量浓度变化Fig.6 Variation of mass concentration of Phanerochaete chrysosporium duringdomestication
2.3 不同ICPB体系对ECF漂白废水的降解效果分析
图7显示不同ICPB体系对ECF漂白废水AOX的降解效果。由图7可知,经12 h反应后,单独活性污泥构建的ICPB体系将ECF漂白废水的AOX从43.0 mg/L降至15.0 mg/L,去除率为65%,单独白腐菌构建的ICPB体系将ECF漂白废水的AOX降至8.6 mg/L,去除率为80%,活性污泥混合白腐菌构建的ICPB体系将ECF漂白废水的AOX降至3.4 mg/L,去除率为92%。综上所述,活性污泥混合白腐菌构建的ICPB体系降解ECF漂白废水中AOX的能力较其他2种体系强。
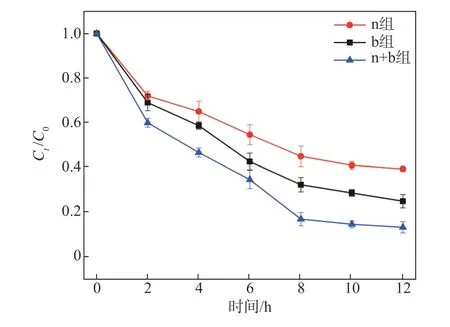
图7 不同ICPB体系对ECF漂白废水AOX的降解效果Fig.7 Degradation effect of different ICPBsystems on AOX in ECFbleachingwastewater
图8显示不同ICPB体系对ECF漂白废水CODCr的降解效果。由图8可知,经12 h反应,单独白腐菌构建的ICPB体系将ECF漂白废水的CODCr从1000 mg/L降至350 mg/L,去除率为65%;单独活性污泥构建的ICPB体系将ECF漂白废水CODCr降至320 mg/L,去除率为68%;活性污泥混合白腐菌构建的ICPB体系将ECF漂白废水CODCr降至230 mg/L,去除率为77%。3种体系对废水CODCr的去除率依次为:n+b>n>b。
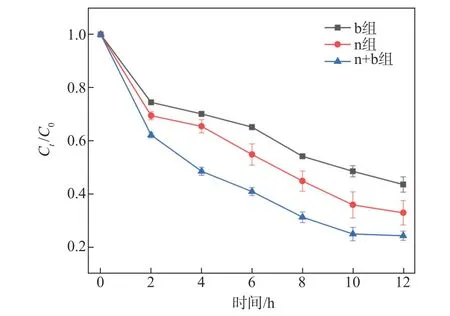
图8 不同ICPB体系对ECF漂白废水CODCr的降解效果Fig.8 Degradation effect of different ICPBsystems on CODCr in ECFbleachingwastewater
图9显示不同ICPB体系对ECF漂白废水DOC的降解效果。由图9可知,经12 h反应后,单独白腐菌、单独活性污泥和活性污泥混合白腐菌构建的3种ICPB体系对ECF漂白废水DOC的去除率分别为55%、62%及75%,3种ICPB体系对ECF漂白废水的DOC均具有一定的降解效果,而活性污泥混合白腐菌构建的ICPB体系的DOC去除率最高,比单独活性污泥和单独白腐菌构建的ICPB体系的DOC去除率分别提高13%和20%。这一结果与上述3种体系对ECF漂白废水CODCr的降解效果规律一致。
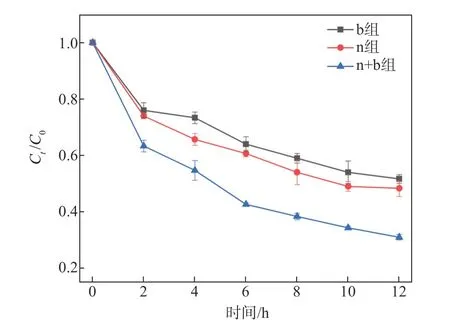
图9 不同ICPB体系对ECF漂白废水DOC的降解效果Fig.9 Degradation effect of different ICPBsystemson DOC in ECFbleachingwastewater
3 结论
本研究以蔗渣纤维素-TiO2复合材料为光催化-生物膜耦合(ICPB)体系的载体,引进对无元素氯漂白(ECF)废水具有降解优势的菌种——白腐菌,与活性污泥进行混合,制备出新型的ICPB体系。分析活性污泥混合白腐菌构建的ICPB体系的微生物理化特性及其降解ECF漂白废水的能力,并以单独白腐菌、单独活性污泥构建的ICPB体系作为对照组。研究结果表明,活性污泥混合白腐菌构建的ICPB体系的混合液悬浮固体(MLSS)为6~8 g/L,污泥体积指数(SVI)为60~85 mL/g,蛋白质/多糖(PN/PS)值为1.61,表明该体系具有较好的理化性能和较强的适应ECF漂白废水环境的能力。该体系对废水可吸附有机卤化物(AOX)、化学需氧量(CODCr)及溶解有机碳(DOC)的去除率分别可达92%、77%和75%。优势菌种的加入,为ICPB技术的优化提供了一种新思路;也为高效处理蔗渣浆ECF漂白废水技术的开发和研究提供了新方法、新思路和理论依据。今后的研究中,可通过分析生物膜对光催化的响应行为,即通过对生物膜的胞外聚合物(EPS)种类与含量分布的分析,考察自由基对生物膜的危害情况及生物膜对自由基的反馈等,进而完善光催化与生物氧化间的相互影响机制。

