芍药苷对高糖培养小鼠肾小球系膜细胞氧化应激及炎症反应的影响
谢亚平 叶莹 余枫 夏洪 李锐 张云 熊瑛 (武汉市武昌医院肾内科,湖北 武汉 430000)
在西方发达国家,糖尿病肾病(DN)已成为终末期肾病(ESRD)的主要原因,它被认为是慢性微血管并发症,同时发生在1型糖尿病(T1DM)和2型糖尿病(T2DM)中〔1〕。高血糖可通过多种分子机制介导糖尿病中的肾脏损害,其中包括氧化应激,促炎性细胞因子,诱导转化生长因子(TGF)-β1表达,成纤维细胞和肾素-血管紧张素系统(RAS)活化等〔2〕。有学者认为DN在中医学属“消渴”范畴,而尿毒清颗粒具有活血化瘀、通腑降浊、健脾利湿之功效,可用于DN早期肾衰竭患者的治疗,该研究已取得满意疗效〔3〕。芍药苷(PF)是尿毒清颗粒的主要活性成分〔4〕,具有广泛的药理作用,包括抗炎、镇痛和抗氧化等〔5,6〕。本研究旨在探讨PF是否通过抗氧化及抗炎作用对高糖环境下小鼠肾小球系膜细胞(SV40 MES 13)产生保护作用,揭示其可能作用机制。
1 材料和方法
1.1实验材料 SV40 MES 13小鼠肾小球系膜细胞购自中国科学院上海细胞库;PF购自Sigma公司;DMEM、F-12培养基、胎牛血清购自Gibco公司;CCK-8试剂盒、活性氧(ROS)检测试剂盒、肿瘤坏死因子(TNF)-α 、白细胞介素(IL)-6 、IL-1β酶联免疫吸附试验检测(ELISA)试剂盒、兔抗细胞外调节蛋白激酶(ERK)多克隆抗体、兔抗磷酸化(p)-ERK多克隆抗体、兔抗p38丝裂原活化蛋白激酶(MAPK)多克隆抗体、兔抗p-p38MAPK多克隆抗体购自bioswamp公司。
1.2实验仪器 352型酶标仪(芬兰LabSystems Multiskan MS公司)、AC-8洗板机(芬兰Thermo LabSystems公司)、NovoCyte流式细胞仪(艾森)、TG16W微量高速离心机(爱来宝(济南)医疗科技)、MD1000正置显微镜(徕卡显微系统有限公司)等。
1.3细胞模型构建及分组处理 细胞以含5%胎牛血清的DMEM(71.25%)和F-12(23.75%)培养基于37℃,5%CO2培养箱中培养,取对数生长期的细胞进行实验。实验细胞分组如下:①正常对照组;②高糖组:以60 mmol/L葡萄糖处理细胞48 h;③低、中、高剂量PF组:在高糖组基础上给予2.5、10.0、30.0 μmol/L PF预处理细胞6 h,之后继续培养48 h。
1.4CCK-8法检测肾小球系膜细胞增殖情况 收集对数期细胞,接种于96孔板(每孔180 μl,细胞密度5×103个/孔),每组细胞接种3个复孔,按1.3中分组方式培养细胞,培养结束后向每孔加入10 μl CCK-8溶液,继续培养4 h,酶标仪测定450 nm的光密度值。计算细胞增殖率(增殖率=试验组OD值/对照组OD值×100%)。
1.5炎性因子的测定 收集各组细胞培养上清液,按照试剂盒使用说明书测定TNF-α、IL-6、IL-1β水平。
1.6DCFH-DA荧光探针法检测肾小球系膜细胞ROS水平 调整DCFH-DA浓度为10 μmol/L,细胞浓度为1×107/ml,于37℃避光孵育20 min,待探针和细胞充分接触后,以无血清培养基洗涤,以去除未进入细胞内的DCFH-DA,收获细胞制备单细胞悬液,经流式细胞仪检测,使用NovoCyte数据分析软件定量分析各组细胞ROS相对水平。
1.7Western印迹 收集各组细胞裂解液,煮沸10 min,离心,取上清进行蛋白定量。之后,取20 μg总蛋白经十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)转移至聚偏氟乙烯(PVDF)膜上,用5%脱脂奶粉室温封闭2 h,加入相应抗体,4℃过夜。洗膜后,用辣根过氧化物酶(HRP)标记的二抗进行孵育,1 h后洗膜,进行显色。将膜置于全自动化学发光分析仪中检测,通过 TANON GIS 软件读取相关条带灰度值。
1.8统计学方法 采用SPSS19.0软件进行t检验、单因素方差分析。
2 结 果
2.1PF对肾小球系膜细胞增殖情况的影响 与正常对照组细胞增殖率〔(1.00±0.01)%〕相比,高糖组〔(0.66±0.01)%〕显著降低(P<0.01);与高糖组细胞增殖率相比,低、中、高剂量PF组〔(0.71±0.01)%、(0.82±0.01)%、(0.83±0.01)%〕均显著升高(均P<0.01);中、高剂量PF组显著高于低剂量PF组(P<0.05)。
2.2PF对肾小球系膜细胞炎症因子的影响 与正常对照组相比,高糖组IL-6、IL-1β、TNF-α表达水平显著升高(P<0.01);与高糖组比较,低、中、高剂量PF组IL-6、IL-1β、TNF-α表达水平显著降低,且呈剂量依赖性(均P<0.01)。见表1。
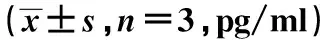
表1 各组细胞炎性因子水平
2.3PF对肾小球系膜细胞ROS水平的影响 与正常对照组相比,高糖组ROS水平显著升高(P<0.01);与高糖组比较,低、中、高剂量PF组ROS表达水平显著降低,且呈剂量依赖性(均P<0.01)。见表2。
2.4PF对肾小球系膜细胞ERK及p38MAPK蛋白磷酸化水平的影响 与正常对照组相比,高糖组p-ERK/ERK、p-MAPK/MAPK水平显著升高(P<0.01);与高糖组比较,低、中、高剂量PF组p-ERK/ERK、p-MAPK/MAPK水平显著降低,且呈剂量依赖性(均P<0.01)。见表2。
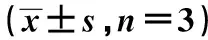
表2 各组ROS、p-ERK/ERK、p-MAPK/MAPK水平比较
3 讨 论
研究发现导致DN的原因不仅是血流动力学和代谢紊乱,也是机体氧化应激和炎症反应的结果〔7〕。并且氧化应激反应的水平与DN所造成的肾脏损伤呈正相关〔8〕。氧化应激是体内过度发生的氧化反应,可生成较多的ROS,ROS可直接氧化并破坏DNA、蛋白质和脂质,还通过激活许多细胞应激敏感途径如JNK、ERK1/2和p38MAPK间接诱导对组织的损害〔9〕。
研究发现PF在关节炎〔10〕、肝脏疾病〔11〕中均显著抑制炎性因子。Jia等〔10〕发现PF可通过调节机体氧化应激和炎症因子水平及环氧酶(COX)2的表达来改善类风湿关节炎。Fan等〔12〕研究表明PF可通过ROS介导的ERK1/2和p38信号通路抑制血小板衍生生长因子BB诱导的原代大鼠血管平滑肌细胞增殖。Xie等〔13〕通过构建大鼠肝脏缺血再灌注(I/R)模型,发现PF在肝脏I/R损伤中起延缓作用,与下调ERK1/2、JNK1/2、 p38的磷酸化表达有关。 Lin等〔14〕研究发现PF可显著减少血清中丙二醛(MDA)含量,增加超氧化物歧化酶(SOD)含量,减弱氧化应激水平。肾小球系膜细胞是维持肾小球正常形态和功能的重要组成部分,其主要作用是维持肾小球毛细血管网结构完整。在高糖培养基中培养MES-13细胞,将会使细胞内ROS的含量升高从而导致细胞凋亡的发生〔15〕。
综上,PF能减轻高糖诱导下肾小球系膜细胞所产生的氧化应激及炎症反应,可显著降低细胞炎症水平和ROS含量,其机制可能与ERK/p38MAPK信号通路的激活有关。

