老年人甲状腺体积和结节与碘、硒营养状态相关性分析
蔡劲薇 苏波 利锡贵 蒙丽恒 秦映芬
(1广西医科大学第一附属医院内分泌科,广西 南宁 530021;2南方医科大学第二临床医学院;3北海市中医医院内分泌科;4广西医科大学第一附属医院B超科)
正常甲状腺功能依赖于甲状腺激素合成和代谢所需的许多微量元素的存在。研究表明,碘与甲状腺功能之间的关系可能是非线性和复杂的〔1〕,充足的硒能改善甲状腺的结构及血管滤泡功能单元的结构和功能完整性〔2〕。2020年欧洲甲状腺协会报道,甲状腺结节(TNs)在成年女性中患病率高达50%,男性高达30%〔3〕。我国的TNs总发病率为17.7%~49.0%〔4〕,差异与不同研究中受试者的遗传、生活环境、饮食习惯和碘营养状况有关。本文旨在研究广西合浦县西场镇高龄及超高龄人群的碘、硒营养状态,并探讨老年人中微量元素与TNs及甲状腺体积(TV)的相关性。
1 资料与方法
1.1研究对象 入选标准:(1)在广西合浦县西场镇居住时间≥10年;(2)年龄≥65岁。排除标准:①近1年内服用过性激素、糖皮质激素、多巴胺类、抗癫痫类药物;②罹患甲状腺疾病及家族史、慢性肾上腺疾病、肝肾功能不全、肾衰竭或其他系统严重疾病;③半年内使用过含碘造影剂或胺碘酮。本研究经广西医科大学第一附属医院伦理委员会批准,纳入者均知情同意。研究共纳入符合入选标准老年人100例,总人群年龄中位数(四分位数区间)为72.0(67.0~78.5)岁,其中男45例,年龄73.0(67.0~78.0)岁,女55例,年龄70.0(67.0~79.0)岁;按65≤高龄组<80岁,超高龄组年龄≥80岁分组,高龄组78例,超高龄组22例。
1.2病史采集 抽样人群首先填写问卷调查表,包括基本信息、旅居史、生育史、吸烟饮酒饮茶史、职业暴露史,含碘及硒食物摄入习惯、饮用水及食盐种类调查,甲状腺疾病家族及个人史,系统回顾及用药史等;同时完善查体,包括基本生命征、体质指标测量等。
1.3调查西场镇碘盐覆盖率及盐碘中位数 采集部分调查对象所在家庭食用盐,每份样品量不少于30 g,由广西疾病预防控制中心实验室检测盐碘含量。根据国家GB26878-2011 标准〔5〕,食用碘盐中碘含量的平均水平(以碘元素计)为20~30 mg/kg。广西壮族自治区根据人群实际碘营养水平制定本地区合格碘盐浓度为25 mg/kg,允许波动范围为18~33 mg/kg。
1.4体液生化及辅助检查 抽取空腹静脉血检查游离甲状腺素(FT4,参考范围12.00~22.00 pmol/L)、游离三碘甲状腺原氨酸(FT3,参考范围3.10~6.80 pmol/L)、促甲状腺激素(TSH,参考范围 0.27~4.20 mIU/L)、甲状腺过氧化物酶抗体(TPOAb,参考范围 0~34 IU/L)、甲状腺球蛋白抗体(TgAb,参考范围 0~40 IU/L)、血清硒值(参考范围70~150 μg/L),留取晨尿10 ml检查尿碘(UIC,参考范围100~300 μg/L)。所有化验结果由广西金域医学检验实验室检测。甲状腺超声检查:WISONIC Clover60(探头频率10~12 MHz),深圳华声公司。心电图检查:MAC Link心电分析仪〔通用电气医疗系统(中国)有限公司〕。甲状腺体积的计算:分叶(ml)=长(cm)×宽(cm)×厚(cm)×π/6,π=3.141 6〔6,7〕。总体积为两分叶体积之和,结节及囊性组织可算入总体积,甲状腺峡部不计入〔8〕。腺体结构分为正常、弥漫性(无结节)、孤立性结节(1个甲状腺结节)或多结节(1个以上甲状腺结节)。若1个腺叶中有3个以上的结节,则仅记录最大结节经线。结节体积计算:纵径(cm)×横径(cm)。
1.5统计学分析 使用统计软件Stata13.0进行分析,通过Epidata3.1完成双录入。正态性检验使用Shapiro-wilk检验。组间比较采用t检验、χ2检验、Fisher确切概率法或秩和检验。应用对数变换使正偏态分布的数据正态化;应用简单线性回归及多元线性回归研究TV、TNs与血硒、UIC浓度及各影响因素之间的关系;应用 Logistic 回归分析研究血硒是否是甲状腺肿大的发生及TNs发生的影响因素;单因素分析中筛选出有意义的协变量纳入多重线性回归模型以探讨血硒和UIC浓度与TV的关系。
2 结 果
2.1不同性别、年龄组老人血硒、尿碘与甲状腺功能、体积及结节状态参数比较 以性别分组,老年女性TNs数量、TNs体积及多发TNs均显著高于男性(P<0.001,P<0.01);男性总TV及右侧TV显著高于女性(P<0.05);其余指标两组间无统计学差异(P>0.05)。高龄组血硒显著高于超高龄组(P<0.05);高龄组UIC高于超高龄组,但差异无统计学意义(P>0.05)。见表1。
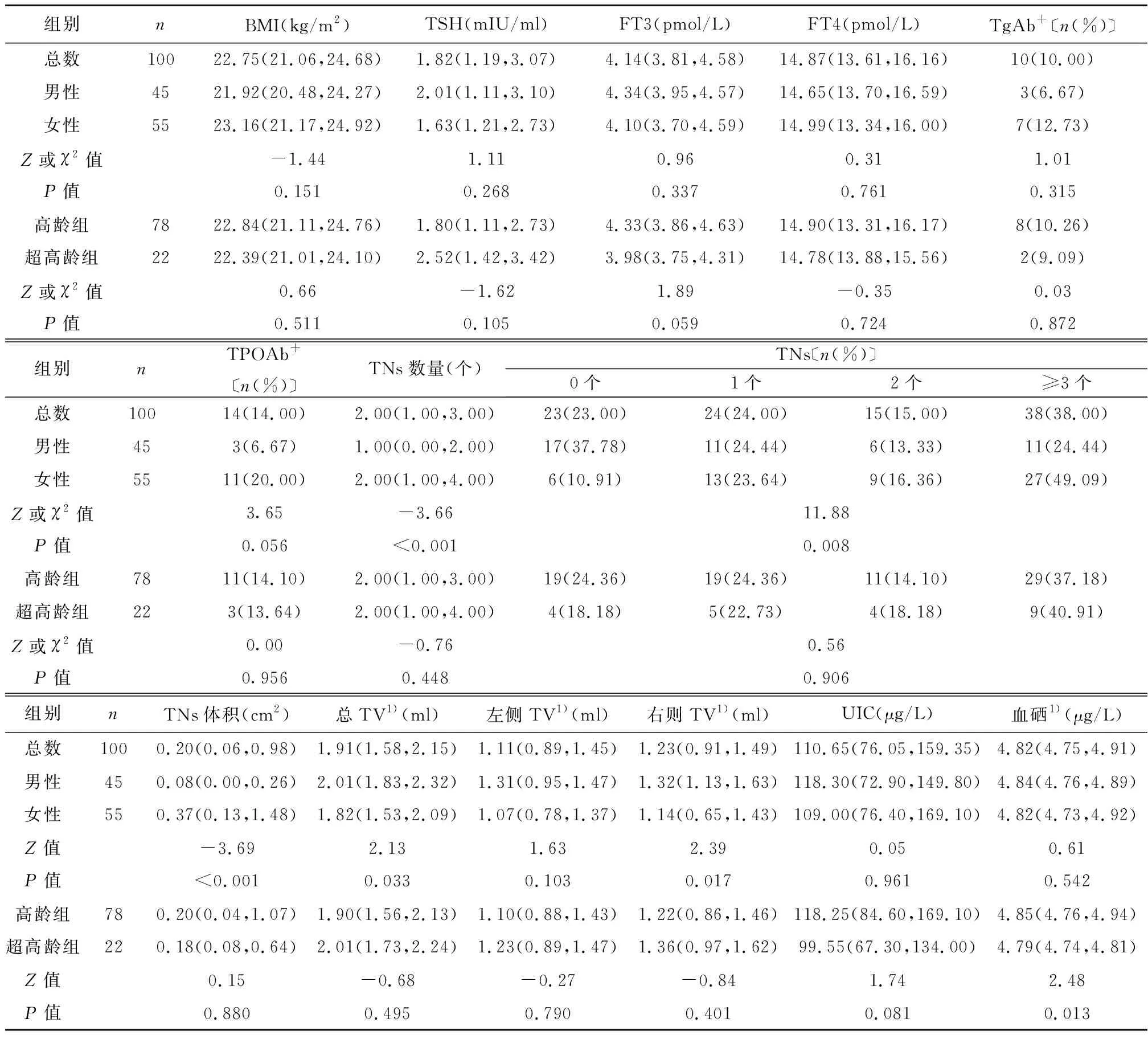
表1 不同性别、年龄组老人血硒、尿碘与甲状腺功能、体积及结节状态参数比较〔M(Q1,Q3)〕
2.2TV的影响因素 在简单线性回归模型中发现TV与BMI及TNs体积呈正相关(P<0.01,P<0.001);在多元线性回归模型中,TV仅与TNs体积显著正相关(P<0.001);与血硒、UIC均未发现显著相关性。见表2。

表2 甲状腺总体积与有关变量的简单及多元线性回归分析
2.3血硒、UIC在无TNs者、单发TNs者、多发TNs者中的浓度比较 在无TNs组、单发TNs组、多发TNs组中血硒、UIC均不存在统计学差异(P>0.05)。UIC显示在无TNs组、单发TNs组和多发TNs组中呈负相关趋势,提示低UIC可能是TNs发生及多发TNs的危险因素,但可能因样本量偏小未发现统计学意义。未发现血硒是TNs发生及多发TNs的影响因素。见表3。

表3 血硒、UIC浓度在不同TNs状态组中的比较
3 讨 论
3.1TNs与TV影响因素 TNs与TV受多种因素影响。Su等〔9〕发现,高密度脂蛋白是TNs的保护性因素,腰围是TV的独立危险因素。林清英〔10〕指出,TNs的影响因素包括年龄、女性、现或曾患甲状腺疾病、有糖尿病史、文化程度低,而职业、高血压史、碘营养水平、碘盐、BMI、辐射情况等因素与TNs发病风险无关。Buscemi等〔11〕报道了年龄、女性、BMI、糖尿病史和牛奶消费少与TNs独立相关。Turcios等〔12〕研究显示,TV随着体表面积及BMI的增加而增加,有吸烟史及血型为AB或B的人TV也较大。Dauksiene等〔13〕报道,女性、吸烟、TNs、高BMI及TSH水平是TV的独立预测因素,而女性、高TSH和TV则是TNs的独立危险因素。Yao等〔14〕对874名100岁以上海南老人(平均年龄102.8±2.8岁)队列研究结果显示TNs总患病率为74.3%,女性、高血压和糖尿病病史、食用槟榔和红肉是独立危险因素,体重不足和食用坚果则是TNs的独立保护因素。
在本研究人群中年龄中位数为72岁,TNs总发病率为77%,与上海报道的1 012例老年男性(平均73.1±7.1岁)TNs发病率81.1%相近〔15〕,显著高于我国中老年人群(≥40岁)的TNs检出率(46.98%~69.50%)〔16,17〕,提示TNs发病率随增龄显著上升;超高龄组TNs发生率较高龄组高(81.82% vs 75.64%)且多发TNs比例随增龄呈上升趋势(59.09% vs 51.28%);女性TNs检出率显著高于男性(89.09% vs 62.22%);简单线性回归模型中发现TV与BMI及TNs体积呈正相关,在多元线性回归模型中,TV与TNs体积相关等特征与上述研究结果基本一致。TNs在高龄人群中患病率较高与衰老引起的甲状腺功能下降有关。随年龄增长,甲状腺组织发生纤维化、细胞浸润和滤泡变化,最终促使TNs形成。女性TNs患病率较高可能源于雌激素是甲状腺干/祖细胞生长的有效刺激物〔18〕。腰围、高BMI与糖尿病病史与TV及TNs的发生风险相关则主要在于体脂增多引起瘦素水平升高、胰岛素抵抗和代偿性高胰岛素血症诱导胰岛素样生长因子(IGF)-1增多有关,其中瘦素可能通过瘦素受体直接作用于TSH释放激素神经元对甲状腺激素介导负反馈调节使TSH水平升高,而胰岛素是甲状腺生长的病理生理标志物之一〔19〕,TSH与胰岛素或IGF-1协同刺激了各种甲状腺细胞的细胞周期进展和增殖〔20〕。
3.2碘营养对TNs和TV的影响 碘元素不仅是合成甲状腺激素的主要成分,也为甲状腺细胞的增殖提供了必要的微环境〔9〕。世界卫生组织/联合国儿童基金会/国际控制碘缺乏病理事会的碘营养状况评价方法及标准(2007年)〔21〕指出UIC反映近期碘摄入量,TV反映长期碘营养状态,普通人群碘营养水平“适宜”的标准为UIC中位数为100~199 μg/L。在本研究中,合浦西场镇65岁以上老年人群的中位数为110.65 μg/L,碘盐覆盖率为100%,盐碘中位数为23 mg/kg,为碘摄入适宜地区,该地区老年人群碘营养状态适宜。
国外研究报道,人群碘营养水平与甲状腺疾病之间的关系呈U形曲线,低碘和高碘状态都会增加疾病风险,UIC排泄<120 mg/24 h与多TNs自主生长、中老年人甲状腺肿大和功能亢进相关〔22〕。何纳轮等〔23〕采用分段函数分位数回归方法,以Sigmoid函数模型拟合人群中不同区间UIC与TNs患病率的剂量效应曲线后发现,高低UIC中间切点值为198 μg/L,在预测模型中可认为UIC<198 μg/L时是低碘性TNs,UIC>198 μg/L时,是高碘性TNs。Song等〔24〕在上海对15~69岁的人群横断面调查发现UIC与总TNs患病率呈U形曲线,UIC在140~400 μg/L时,TNs患病率最低且中位数在无TNs、单发TNs及多发TNs受试者中呈递减改变。与本研究中UIC在无TNs、单发TNs和多发TNs中呈负相关趋势,提示低UIC可能是TNs发生及多发TNs的危险因素的研究结果一致。机制为碘缺乏可能通过促进甲状腺细胞生长和DNA突变机制形成自主甲状腺细胞簇而导致TNs的增加〔25〕。丹麦一项前瞻性队列研究〔26〕提示,在轻中度碘缺乏地区,碘摄入与TV中位数负相关,而与TNs患病率及大小无关。在本研究中,未发现TV与UIC之间有显著性关联,可能与本地区碘及硒营养均适宜有关。
3.3硒营养对TV和TNs的影响 硒和铁是良性甲状腺疾病的流行病学和干预研究结果显示的重要限制性营养因素〔2〕。甲状腺是人体每单位组织中硒含量最高的组织,大部分甲状腺内的硒都存在于甲状腺细胞的功能性硒蛋白中〔27,28〕。硒蛋白具有从抗氧化、抗炎到产生活性甲状腺激素等的广泛功能〔27〕。充足的硒可以提高甲状腺激素的合成效率,防止长期碘缺乏导致的转化生长因子β依赖性过程诱导的TSH水平升高,甲状腺损伤,过氧化氢(H2O2)、活性氧(ROS)和ROS中间体的增多。值得注意的是,补硒之前必须先保证足够的碘水平〔2〕,以防脱碘酶硒蛋白对硒诱导的外周甲状腺激素代谢激活可能导致甲状腺激素转换增加、脱碘和肾丢失碘增多。
大型干预研究表明,硒摄入不足与女性TV增加有关〔29〕。丹麦人群研究则证实硒和TV与TNs之间呈负相关,低血硒与形成大小超过10 mm的多TNs风险相关,但不影响孤立TNs的形成风险〔30〕。一项中国基于社区的研究(n=6 152)报道〔31〕,在碘充足或过量地区,低硒地区〔血硒为57.4(39.4~82.1)μg/L〕甲状腺肿大的患病率显著高于硒适宜地区〔血硒为103.6(79.7~135.9)μg/L〕;在血硒最低(<47 μg/L)的地区,甲状腺肿大的患病率最高。硒缺乏患者甲状腺肿大和TNs风险增加的分子机制可能与谷胱甘肽过氧化物酶异常有关〔32〕。Liu等〔33〕研究显示,血硒可能影响严重缺碘地区的TV,在碘充足地区则与TV及甲状腺肿均无关。辛笑笑等〔34〕报道了山西太原1 339人的横断面调查结果显示血硒与年龄呈负相关,与BMI、TSH不相关;在线性回归分析中,血硒与TV、TNs发生率及甲状腺肿大均无显著相关。与本研究结果基本一致。
标准血硒为60~120 μg/L或(0.8±0.36)μmol/L,硒蛋白P可以反映体内的硒储量〔32〕。甲状腺功能与硒的剂量-效应、获益-风险关系呈现典型的J形曲线,最佳血硒浓度为125 μg/L〔2〕。美国NHANES Ⅲ随访18年的死亡数据表明血硒为137 μg/L时全因死亡率最低〔35〕。Sakiz等〔36〕则指出,血硒>70 μg/L对于产生足够的硒蛋白及≥100 μg/L对于预防甲状腺肿大和自身免疫性甲状腺疾病或抗癌活性至关重要。本研究结果提示广西合浦≥65岁老年人硒营养状态适宜。
自身免疫性甲状腺炎、Graves病和甲状腺肿大的风险增加与低硒状态有关,补硒可能可以更快地缓解甲状腺功能亢进,并改善轻度甲状腺眼病患者的生活质量和眼部受累。值得注意的是,硒也与碘相似,与疾病风险之间呈现U形关系。超过一定的硒暴露水平对于动物和人类都是有毒元素。硒中毒最明显的症状是脱发、指甲脱落和皮炎〔37〕。还有其他研究发现,硒替代治疗可能增加了前列腺癌〔38〕、鳞状细胞癌〔39〕和2型糖尿病〔40〕的发生风险。目前仅建议在硒缺乏及Graves眼病患者中进行硒替代治疗〔37〕。
随着全球老龄化的发展,有必要关注老年人群的微量元素营养及甲状腺疾病发生风险。本研究结果显示增龄、女性及低碘可能是老年人TNs发生及多发TNs的危险因素;老年人甲状腺肿大则与BMI及TNs体积正相关;血硒随增龄而下降,但在碘充足的情况下,血硒与TNs及甲状腺肿大发生之间均未发现关联。受疫情影响,本研究样本量较小,在未来将继续扩大调查人群及研究变量,随访本地区老年人微量元素营养状态与TNs、TV及其他甲状腺疾病的相关性。

