逍遥散对四氯化碳诱导的急性肝损伤的保护作用及其机制
张文超,葛冰景,周 薏,阙任烨
(1. 上海中医药大学,上海 201203;2. 上海中医药大学附属上海市中西医结合医院,上海 200082)
肝脏是机体重要的合成代谢场所,在调节消化功能、物质代谢、营养贮存、解毒造血等生理功能方面发挥着重要作用。病毒感染、饮酒过度、服药不当、误食毒物等是临床上常见的引起急性肝损伤的原因,近年来由于临床新药的品种逐渐增多,药物性肝损伤的发病率呈现逐年增高的趋势。中医药是祖国医学的瑰宝,目前已有越来越多的研究表明一些中药复方或中药提取物具有显著的保肝作用。逍遥散出自《太平惠民和剂局方》,在临床上主要运用于多种急慢性肝脏疾病如急慢性肝损伤、肝纤维化、早期肝硬化等的治疗,其具有显著的保肝作用[1-2],但其作用机制目前仍未完全明确。本实验利用四氯化碳诱导的小鼠急性肝损伤模型,观察了逍遥散的保肝效应及其作用机制,现将结果报道如下。
1 实验材料与方法
1.1实验动物 SPF级雄性ICR成年小鼠60只,体重18~22 g,购自上海市实验动物中心,动物合格证号:SCXK(沪)2013-0016,饲养于上海市中医医院无特异病原体(SPF)级动物房,恒温(25±2)℃、恒湿,人工光照12 h、黑暗12 h,自由进食饮水。本动物实验规程遵循“实验动物关爱和使用指南”。
1.2试剂 四氯化碳及橄榄油购自国药集团化学试剂有限公司;双环醇片购自北京协和药厂,国药准字H20051712;苏木素-伊红染色液(P031IH) 购于湖南艾佳生物科技股份有限公司;B淋巴细胞瘤-2(Bcl-2)、p-Bcl-2、半胱氨酸天冬氨酸蛋白酶-3(Caspase-3)抗体(Abcam公司);辣根酶标记山羊抗鼠、兔IgG(cell signaling technology公司);Janus激酶2(JAK2)、p-JAK2、信号传导与转录激活因子3(STAT3)、p-STAT3、β-actin抗体(cell signaling technology公司);白细胞介素-6(IL-6)、肿瘤坏死因子-α(TNF-α)ELISA试剂盒购自上海西唐生物科技有限公司;丙二醛(MDA)、超氧化物歧化酶(SOD)比色法试剂盒购自南京建成生物科技有限公司。
1.3药物配制 逍遥散组方:柴胡15 g、当归15 g、白芍15 g、白术15 g、茯苓15 g、甘草7.5 g,粉碎成粗粉,加水1 500 mL煮沸,保持沸腾20 min,加入5 g煨姜和5 g薄荷,再保持沸腾煎煮10 min,煎煮液过5层纱布,滤液浓缩至1 g/mL、2 g/mL、3 g/mL(按生药量计)分别作为低、中、高剂量,经冷冻干燥制成粉末,用前以蒸馏水配制成混悬液。双环醇片制成粉末后用蒸馏水配制成浓度为110 mg/kg的混悬液。5%四氯化碳油剂按四氯化碳与橄榄油1∶20配制,现用现配。
1.4仪器 快速研磨仪JXFSTPRP-48(上海净信实业发展有限公司),多功能酶标仪Varioscan Flash(上海百基生物科技有限公司),RM2016切片机(莱卡公司),生物组织摊烤片机YT-6C(亚光医用电子技术有限公司),防脱载玻片P031IH(湖南艾佳生物科技股份有限公司),鼓风干燥箱DHC-9070A(天津津立仪器设备科技发展有限公司),光学显微镜AE41(麦克奥迪实业集团有限公司),AU400型全自动生化分析仪(日本奥林巴斯公司),小型垂直电泳转印系统(美国Bio-rad公司),ChemiDocTMXRS+凝胶成像系统(美国Bio-rad公司),Neofuge 15R型台式高速冷冻离心机(中国Heal force公司)。
1.5实验方法 取48只ICR小鼠,随机分为正常组、模型组、逍遥散低剂量组、逍遥散中剂量组、逍遥散高剂量组、双环醇组,每组8只。逍遥散低、中、高剂量组分别给予1 g/mL、2 g/mL、3 g/mL浓度逍遥散10 mL/(kg·d)灌胃,双环醇组给予110 mg/kg浓度的双环醇悬液灌胃,正常组及模型组灌胃等量生理盐水。灌胃1周后,除正常组外,其余组小鼠参照文献[3-4]方法进行四氯化碳诱导的急性肝损伤模型制作,即橄榄油稀释成的5%四氯化碳溶液10 mL/kg腹腔注射,正常组予腹腔注射同等剂量的橄榄油。所有小鼠在造模24 h后处死,取血清、肝组织标本。血清标本用蛋白酶抑制剂处理,-20 ℃中保存备用;肝组织标本用含0.01% DEPC的生理盐水清洗后保存于-80 ℃中,部分标本用中性福尔马林固定12 h后经石蜡包埋,3~5 μm厚连续切片备检。
1.6检测指标及方法
1.6.1血清肝功能指标测定 使用全自动生化分析仪检测各组小鼠血清丙氨酸氨基转移酶(ALT)、天门冬氨酸氨基转移酶(AST)、乳酸脱氢酶(LDH)水平。
1.6.2肝脏病理组织HE染色观察 取备检石蜡切片,经脱蜡、水化、染色、分化、透明、封片、镜检,分别观察各组切片肝脏病变严重程度,使用ImagePro Plus软件对坏死区域进行半定量分析。
1.6.3肝脏组织中氧化应激及炎性因子指标检测取各组小鼠部分肝组织,采用比色法检测MDA、SOD含量,采用ELISA法检测IL-6、TNF-α含量,均按照试剂盒说明书操作测定。
1.6.4肝组织中JAK2-STAT3信号通路及凋亡相关蛋白表达检测 采用Western blot法检测:取各组小鼠部分肝脏组织,裂解后提取蛋白,使用BCA蛋白试剂盒检测蛋白含量。以SDS-PAGE凝胶(5%浓缩胶,12%分离胶)进行电泳,分离蛋白,通过半干转法转移至PVDF膜,PVDF膜经5%的脱脂奶粉摇床上慢摇2 h封闭,分别与JAK2、p-JAK2、STAT3、p-STAT3、p-Bcl-2、Bcl-2、Caspase-3、β-actin抗体4 ℃过夜,室温孵育二抗2 h,ECL光化学显色。最后应用Image J分析软件对扫描条带进行定量分析,计算各蛋白相对表达量。

2 结 果
2.1各组小鼠血清肝功能指标水平 模型组小鼠血清ALT、AST、LDH水平均显著高于正常组(P均<0.05);逍遥散各剂量组和双环醇组血清ALT、AST、LDH水平均显著低于模型组(P均<0.05),且逍遥散各剂量组血清ALT、AST、LDH水平均呈剂量依赖性降低,两两比较差异均有统计学意义(P均<0.05)。见表1。
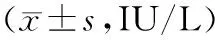
表1 正常组和急性肝损伤各组小鼠血清肝功能指标比较
2.2各组小鼠肝脏病理组织学HE染色情况 正常组小鼠肝组织结构正常,肝细胞排列整齐;模型组小鼠肝细胞结构紊乱,胞浆疏松,小叶内见多个坏死灶,坏死灶内见大量中性粒细胞浸润,肝细胞受损面积为(42.3±6.4)%;逍遥散低、中、高剂量组和双环醇组病灶炎症程度明显轻于模型组,肝细胞受损面积分别为(33.9±6.0)%、(23.8±4.0)%、(18.3±3.9)%、(18.9±4.2)%,均显著低于模型组(P均<0.05),且逍遥散各剂量组呈剂量依赖性降低,两两比较差异均有统计学意义(P均<0.05)。各组病理表现见图1。
2.3各组小鼠肝组织中氧化应激指标含量比较与正常组比较,模型组小鼠肝脏组织中MDA含量显著升高(P<0.05),SOD含量显著下降(P<0.05)。逍遥散各剂量组和双环醇组小鼠肝组织中MDA含量均显著低于模型组(P均<0.05),SOD含量均显著高于模型组(P均<0.05),且逍遥散各剂量组MDA、SOD含量均呈剂量依赖性降低或升高,两两比较差异均有统计学意义(P均<0.05)。见表2。
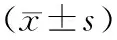
表2 正常组和急性肝损伤各组小鼠肝组织中氧化应激指标含量比较
2.4各组小鼠肝组织中炎症因子含量比较 模型组小鼠肝组织中IL-6、TNF-α含量均显著高于正常组(P均<0.05);逍遥散各剂量组和双环醇组小鼠肝组织中IL-6、TNF-α含量均显著低于模型组(P均<0.05),且逍遥散各剂量组IL-6、TNF-α含量均呈剂量依赖性降低,两两比较差异均有统计学意义(P均<0.05)。见表3。
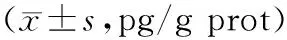
表3 正常组和急性肝损伤各组小鼠肝组织中炎症因子含量比较
2.5各组小鼠肝组织中JAK2/STAT3信号通路及凋亡相关蛋白表达情况比较 与正常组比较,模型组小鼠肝组织中p-JAK2、p-STAT3、Cleaved-Caspase-3蛋白相对表达量均显著升高(P均<0.05),p-Bcl-2蛋白相对表达量显著下降(P<0.05)。逍遥散各剂量组和双环醇组小鼠肝组织中p-JAK2、p-STAT3、Cleaved-Caspase-3蛋白相对表达量均显著低于模型组(P均<0.05),p-Bcl-2蛋白相对表达量均显著高于模型组(P均<0.05),且逍遥散各剂量组各指标均呈剂量依赖性降低或升高,两两比较差异均有统计学意义(P均<0.05)。见图2及表4。
3 讨 论
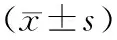
表4 正常组和急性肝损伤各组小鼠肝组织中JAK2/STAT3信号通路及凋亡相关蛋白相对表达量比较
急性肝损伤可由多种理化及生物因素所导致,根据致病因素的差异,一般可分为病毒性肝损伤、化学性肝损伤、药物性肝损伤、酒精性肝损伤、免疫性肝损伤、缺血再灌注肝损伤等[5]。急性肝损伤的本质是肝细胞受到外界刺激后引起的大量变性坏死,病情严重者可诱发休克、脓毒症、肝性脑病、凝血障碍,甚至有引起多脏器功能衰竭并最终导致患者死亡的风险。因此,积极探索合理有效的途径以减轻或逆转急性肝损伤具有十分重要的临床意义。
逍遥散是临床上广泛应用于急慢性肝炎、肝硬化、胆石症、胃及十二指肠溃疡、慢性胃炎等的中药方剂,课题组前期研究发现逍遥散可显著改善肝郁脾虚型乙肝后肝硬化代偿期患者肝功能[6]。在前期研究基础上,本实验探讨了其保肝作用的分子机制。
四氯化碳作为一种化工原料,因其具有无色、易挥发、不易燃、嗜肝性等特点,是用于建立急性肝损伤动物模型最经典的化学毒物。一般采用四氯化碳制作小鼠急性肝损伤模型可通过经皮下或腹腔注射的途径,其造模稳定性及成功率较高。四氯化碳诱导的急性肝损伤,其实质是肝细胞的氧化应激损伤。四氯化碳因其具有脂溶性,在正常情况下易透过肝细胞膜,在细胞色素酶P450的催化下进一步转化为自由基CCl3·和Cl·,CCl3·又可与O2结合为CCl3O2·,上述自由基可攻击肝细胞膜中的不饱和脂质,引起肝细胞脂质过氧化损伤[7]。MDA是脂质过氧化反应的最终产物,肝组织中MDA含量可反映氧化应激损伤程度。SOD是体内抗氧化体系中最重要的一种酶,其活性的强弱可反映机体的抗氧化能力。本研究中,模型组小鼠血清ALT、AST、LDH水平及肝组织中MDA含量显著升高,肝脏组中SOD含量显著降低,提示四氯化碳引起了肝脏氧化应激损伤,肝细胞损伤后细胞内ALT、AST、LDH等酶类即释放入血,血清中这些指标增高说明肝细胞受损。
肝细胞损伤后亦可释放多种细胞因子如TNF-α、IL-1β、IL-6等,这些物质可进一步诱导肝脏中中性粒细胞及肝脏库普弗细胞浸润,并激活库普弗细胞促使其分泌更多的TNF-α、IL-1β 、IL-6,形成正反馈途径。另外,四氯化碳进入人体后可直接激活库普弗细胞,加速炎症反应进程。因此,TNF-α、IL-1β 、IL-6等可作为反映急性肝损伤时肝脏炎症程度的指标。有多项研究表明,四氯化碳诱导的急性肝损伤小鼠血清及肝组织中TNF-α、IL-1β、IL-6水平均显著升高[8-10],本实验也发现该模型小鼠肝组织中TNF-α、IL-6含量较正常小鼠明显增高。这些细胞因子可激活细胞中多条信号通路,如MAPKs、JAK/STAT、TLR4/NF-κB等,进一步活化炎症级联反应。JAK2 /STAT3 信号通路能介导多种炎症及细胞因子的信号转导过程,在这些因子的作用下,可使JAK2发生磷酸化激活,活化的JAK2可进一步激活STAT3,调节下游基因转录过程,发挥调节肝细胞增殖分化、肝细胞凋亡、肝脏物质与能量代谢、炎症级联等过程的作用[3]。既往有实验研究证实四氯化碳诱导的急性肝损伤小鼠肝组织中JAK2/STAT3磷酸化水平显著升高[3,11],而柴胡皂苷d、黄连素、过墙风总黄酮可通过抑制JAK2/STAT3信号通路显著减轻肝脏的急性损伤[3,12-13]。本实验结果显示,模型组小鼠肝组织中p-JAK2、p-STAT3蛋白表达量显著升高,而逍遥散各剂量组肝组织中p-JAK2、p-STAT3蛋白表达量均显著低于模型组,提示逍遥散可抑制JAK2/STAT3磷酸化,减轻肝损伤。
四氯化碳所引起的脂质过氧化反应一方面可引起炎症和氧化应激,另一方面也可导致肝细胞膜通透性增加,胞浆内Ca2+浓度上升,通过激活JAK2/STAT3信号通路使促凋亡基因表达升高,诱发肝细胞凋亡。细胞凋亡是细胞的一种主动的程序性死亡方式,而肝组织细胞的过度凋亡是肝损伤发生发展的一个重要因素[14]。Bcl-2基因在细胞凋亡发生的过程中具有重要作用,其主要位于线粒体外膜、内质网膜及核膜上,有维持线粒体膜完整性的作用,可通过阻止线粒体向胞浆释放细胞色素C而发挥抗凋亡效应。因此,当Bcl-2表达下降时,细胞色素C被释放入胞浆,其可与凋亡相关因子-1结合成多聚体,随后逐步剪切活化Caspase-3。Caspase-3是细胞凋亡信号转导通路中最关键的效应分子,也是诱导细胞凋亡的最终执行者。研究表明,在四氯化碳诱导的急性肝损伤模型中,肝组织中Bcl-2磷酸化水平降低,Cleaved-Caspase-3表达量增加,提示细胞凋亡被诱发[15]。许庆庆[16]研究报道,使用凋亡抑制剂可显著减轻肝脏损伤程度。本实验中发现,四氯化碳诱导的小鼠急性肝损伤肝组织中p-Bcl-2蛋白相对表达量显著下降,Cleaved-Caspase-3蛋白相对表达量显著升高,与文献[15]报道相符;逍遥散各剂量组肝组织中p-Bcl-2蛋白相对表达量显著高于模型组,Cleaved-Caspase-3蛋白相对表达量显著低于模型组,提示逍遥散可抑制细胞凋亡。
综上所述,四氯化碳诱导的急性肝损伤与氧化应激、炎症级联反应、信号通路激活、细胞凋亡等多种作用机制有关,且它们之间相互促进、相互影响,共同加重疾病的发生发展。因此,抗氧化、抗炎、抑制信号通路活化、抑制凋亡等途径的药物有可能成为具有保肝作用的潜在治疗药物。逍遥散具有显著的保肝、抗炎、抗氧化作用,其作用机制可能与抑制JAK2/STAT3信号通路活化及细胞凋亡有关。本研究对中药经方逍遥散保肝作用机制作出了一定的探索,为其临床应用提供了实验依据,也为中药复方的现代化研究与应用提供了一种探索模式。
利益冲突:所有作者均声明不存在利益冲突。

